Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
тэд 8 класс
Содержание
- 1. тэд 8 класс
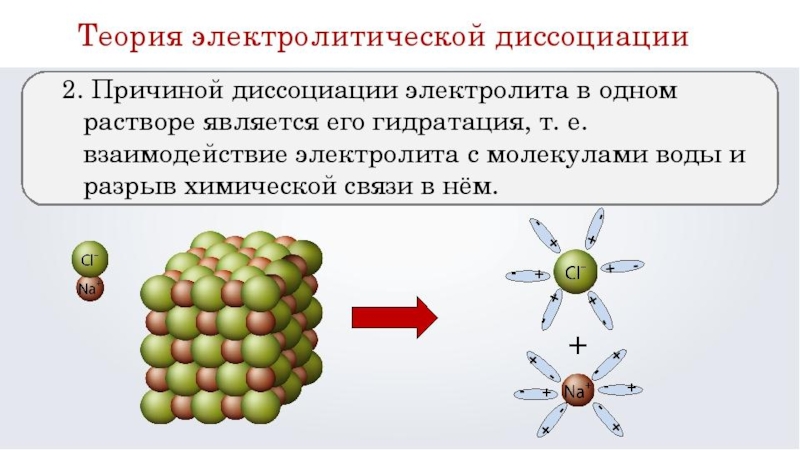
- 2. Сванте-Август АррениусАвтор теории электролитической диссоциации 1903 год.
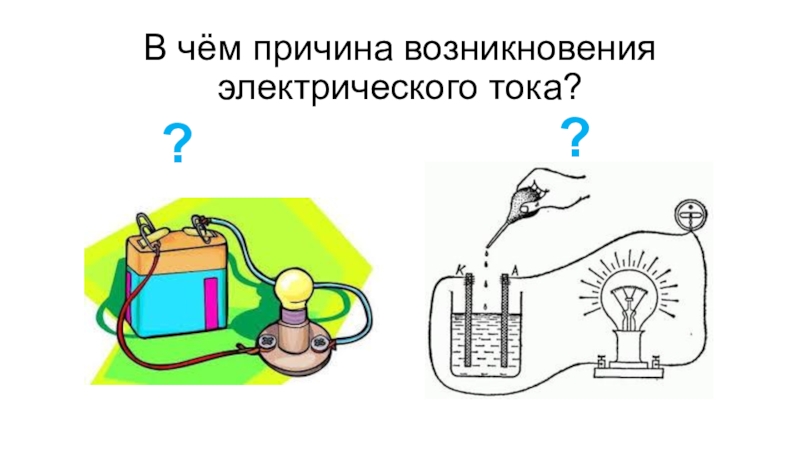
- 3. В чём причина возникновения электрического тока? ??
- 4. Причина возникновения электрического токанаправленное движение электроновобразование заряженных частиц в растворе или расплаве электролита
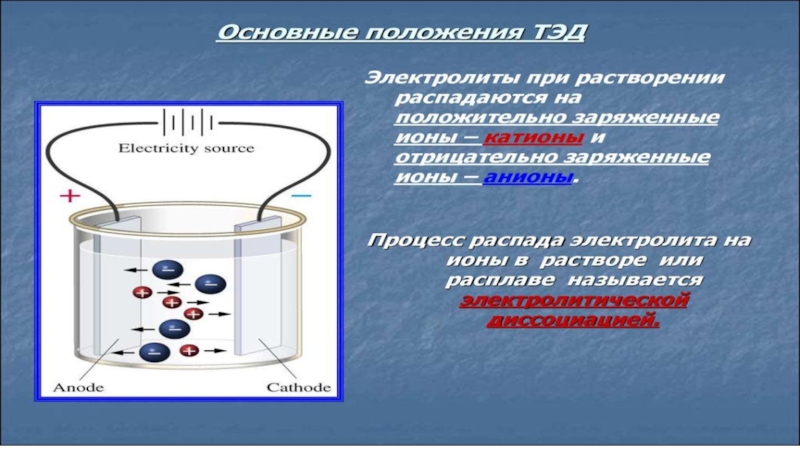
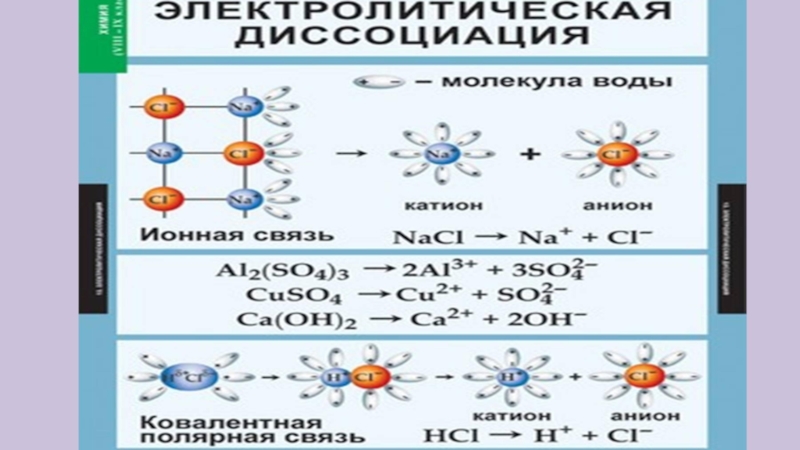
- 5. Все ли вещества проводят электрический ток?электролитывсе растворимые
- 6. Все ли вещества проводят электрический ток?электролитыNaCl (раствор)NaOH(раствор)Н2SO4 (раствор)СuSO4 (раствор)CH3COOH (раствор; столовый уксус 9%)неэлектролитыН2О (прот.)сахар (раствор)Н2О (дист.)NaCl (крист.)сахар (крист.)C2H5OH (этиловый спирт)
- 7. Слайд 7
- 8. Слайд 8
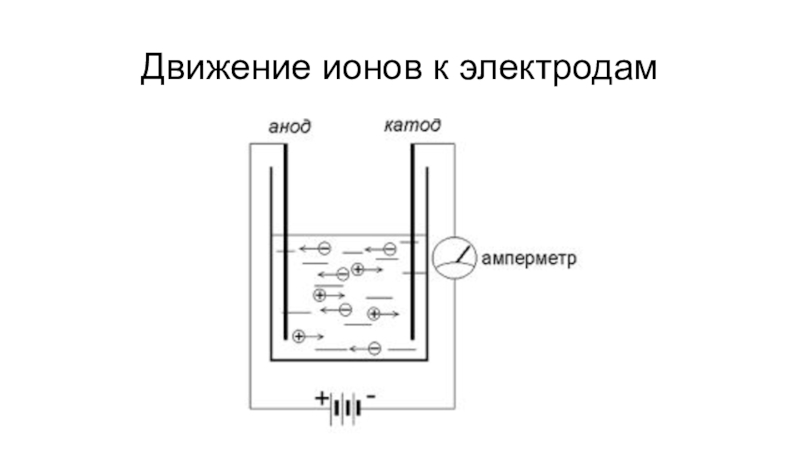
- 9. Движение ионов к электродам
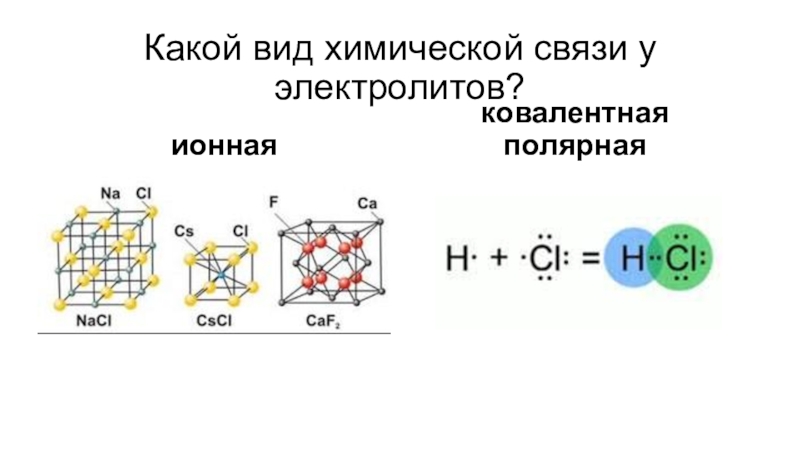
- 10. Какой вид химической связи у электролитов?ионнаяковалентная полярная
- 11. Слайд 11
- 12. Слайд 12
- 13. Степень диссоциации -это отношение числа частиц,
- 14. В зависимости от степени диссоциации электролиты делят
- 15. Слайд 15
- 16. Запишите уравнение диссоциацииДопишите уравнения диссоциацииNaCl = HCl=NaOH=CuSO4 =H2 SO4 =FeCl3 =
- 17. Домашнее заданиеИзучить п.36Закончить уравнения диссоциации
- 18. Скачать презентанцию
Сванте-Август АррениусАвтор теории электролитической диссоциации 1903 год. Лауреат Нобелевской премииРодился 19 февраля 1859 года в старинном шведском городе Упсале. В гимназии он был одним из лучших учеников, особенно легко ему давалось
Слайды и текст этой презентации
Слайд 2Сванте-Август Аррениус
Автор теории электролитической диссоциации 1903 год.
Лауреат Нобелевской премии
Родился
19 февраля 1859 года в старинном шведском городе Упсале.
гимназии он был одним из лучших учеников, особенно легко ему давалось изучение физики и математики. В 1876 году юноша был принят в Упсальский университет. И уже через два года (на шесть месяцев раньше срока) он сдал экзамен на степень кандидата философии.Слайд 4Причина возникновения электрического тока
направленное движение электронов
образование заряженных частиц в растворе
или расплаве электролита
Слайд 5Все ли вещества проводят электрический ток?
электролиты
все растворимые соли
щёлочи
растворимые кислоты
неэлектролиты
нерастворимые соли,
кислоты,
основания
оксиды
вещества с ковалентной неполярной связью (газы)
большинство органических веществ
Слайд 6Все ли вещества проводят электрический ток?
электролиты
NaCl (раствор)
NaOH(раствор)
Н2SO4 (раствор)
СuSO4 (раствор)
CH3COOH (раствор; столовый уксус 9%)
неэлектролиты
Н2О (прот.)
сахар
(раствор)
Н2О (дист.)
NaCl (крист.)
сахар (крист.)
C2H5OH (этиловый спирт)
Слайд 13Степень диссоциации
-это отношение числа частиц, распавшихся на ионы (N
д), к общему числу растворенных частиц (NP):
α=N д/NP
Слайд 14В зависимости от степени диссоциации электролиты делят на
сильные электролиты
1.Практически все
соли;
2.Сильные кислоты(HCl, HNO3,H2SO4и др.);
3.Все щелочи (KOH, NaOH,
Ca(OH)2 и др.)
слабые электролиты
1.H2O
2.Слабые кислоты (H2S, HNO2,
H2CO3 и др.);3.Водный раствор аммиака
NH3*H2O