Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ТЕЛОМЕРЫ И ТЕЛОМЕРАЗА
Содержание
- 1. ТЕЛОМЕРЫ И ТЕЛОМЕРАЗА
- 2. В начале 1960-х годов Леонард Хейфлик установил,
- 3. В 1998 г. группе американских ученых удалось
- 4. Теломеры – это- специализованные концевые районы линейной
- 5. Многократно повторяющиеся блоки в теломерной ДНК простейших
- 6. Чем можно объяснить такое сходство? В теломерной
- 7. Теломеры содержат ДНК-связывающие белки, специфические для двойных
- 8. Утрата теломерной ДНК. Теломерная ДНК утрачивается в
- 9. Основные сигнальные пути теломер. Механизм, посредством которого
- 10. ТеломеразаВ 1984 году Э. Блэкберн и Э.
- 11. Теломераза – это фермент‚ синтезирующий тандемно повторяющиеся
- 12. Теломеразные РНК у разных организмов сильно различаются
- 13. Как работает теломераза?На первой стадии теломераза находит
- 14. Нет сомнений в том, что в составе
- 15. Широкое распространение теломераз среди эукариот говорит о
- 16. Активность теломеразы у высших эукариот обнаружена лишь
- 17. В соматических клетках, культивируемых in vitro, теломераза
- 18. Опубликованная в 1998 году в журнале "Science"
- 19. Укорочение теломер можно рассматривать как молекулярный индикатор
- 20. Старение особи - это нормальная биологическая функция,
- 21. ТЕЛОМЕРАЗА, РАК И СТАРЕНИЕВопрос о том, в
- 22. Легковесность первого вывода (а именно его подхватили
- 23. Telomerehttp://publications.nigms.nih.gov/thenewgenetics/chapter2.htmlNon-coding repeated sequence
- 24. Слайд 24
- 25. Слайд 25
- 26. Слайд 26
- 27. Telomere also provide a means for
- 28. Слайд 28
- 29. Слайд 29
- 30. Слайд 30
- 31. Слайд 31
- 32. Слайд 32
- 33. Теломеразы: биомедицинское использованиеExpand cells for replacement therapies(burns, joint replacements, etc)Telomerase inhibitors to selectively kill cancer cells
- 34. Теломерная гипотеза старенияTelomeres shorten with each cell
- 35. SUMMARY Telomeres are essential for chromosome stabilityTelomere
- 36. Слайд 36
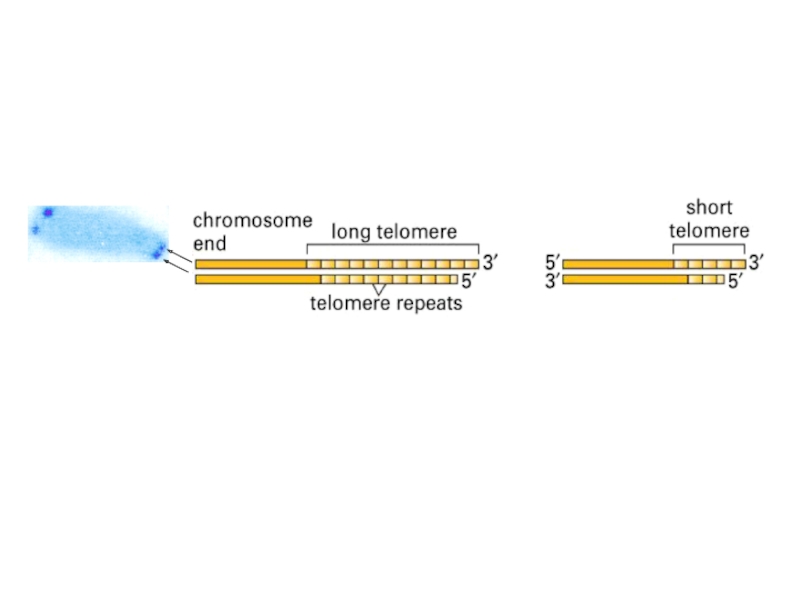
- 37. Теломерный участок хромосомы человека (а) и дрожжей (б)
- 38. Минина
- 39. Теломера: «телос» - конец и «мерос» -часть
- 40. Слайд 40
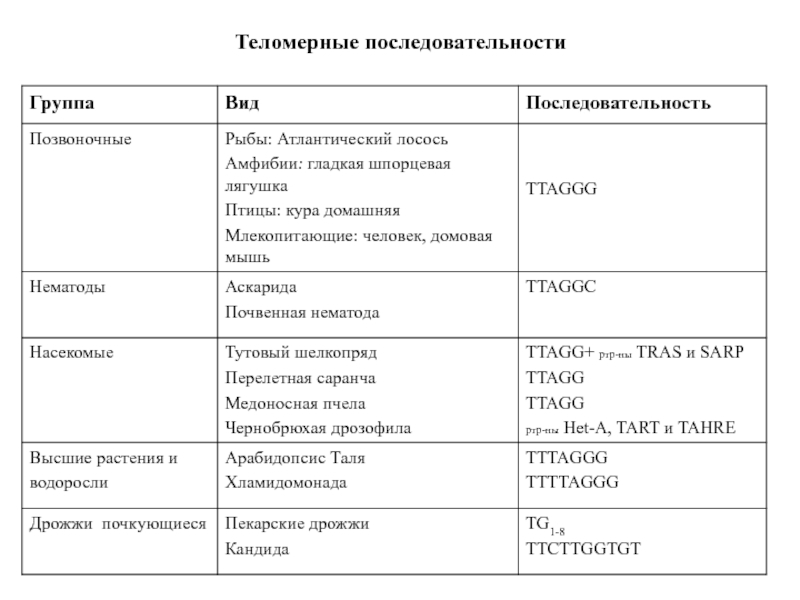
- 41. Теломерные последовательности
- 42. Замена теломерных повторов на другие: 1. Саттелитная
- 43. Прерывистые теломеры: Непрацентарные млекопитающие Бурозубка иберийская (Sorex
- 44. Длина теломерВид
- 45. Структура теломеры: теломерная петля 50-200 п.н. электронная микрофотография
- 46. Структура теломер: G-квадруплексы Химическая структура квадруплекса Образование
- 47. Белки, ассоциированные с теломерами - Shelterin Защитный
- 48. shelterin
- 49. Белки, ассоциированные с теломерами – не Shelterin
- 50. TERRA – Telomeric Repeat-containing RNA Транскрипция теломерной
- 51. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3В 1998 г. группе американских ученых удалось заставить нормальные клетки
человека преодолеть "лимит Хейфлика" почти вдвое.
Ученые из лабораторий Джерри
Шейя, Вудринга Райта, работающие под патронажем фирмы "Джерон корпорейшн" ("Geron Corporation"), с помощью изящных генетических манипуляций заставили в нормальных клетках человека работать фермент теломеразу, активность которой до этого была нулевой. Теломераза участвует в образовании теломер-специальных структур, расположенных на концах линейных хромосом эукариот. Таким образом, обновление теломер и стало причиной спасения клеток от одряхления. Появились статьи с заголовками вроде "Генетики уткнулись в бессмертие", "Лекарства от старения будут доступны, как аспирин", "Таблетки от старости становятся реальностью" и т.п
Слайд 4Теломеры – это
- специализованные концевые районы линейной хромосомной ДНК,
- состоят
из многократно повторяющихся коротких нуклеотидных последовательностей,
- представляют комплексов ДНК с
белками;- предотвращают деградацию и слияние хромосом,
- ответственны за прикрепление хромосом к специальной внутриядерной структуре, называемой ядерным матриксом;
Таким образом, теломеры играют важную роль в создании специфической архитектуры и внутренней упорядоченности клеточного ядра. Наличие на концах хромосом специальной теломерной ДНК позволяет решить так называемую проблему концевой недорепликации ДНК.
Существование таких участков было постулировано в 1938 году классиками генетики, лауреатами Нобелевской премии Барбарой Мак-Клинток и Германом Мёллером. Г. Мёллер предложил называть их теломерами (от греч. телос - конец и мерос - часть);
Первыми объектами исследования были одноклеточные простейшие
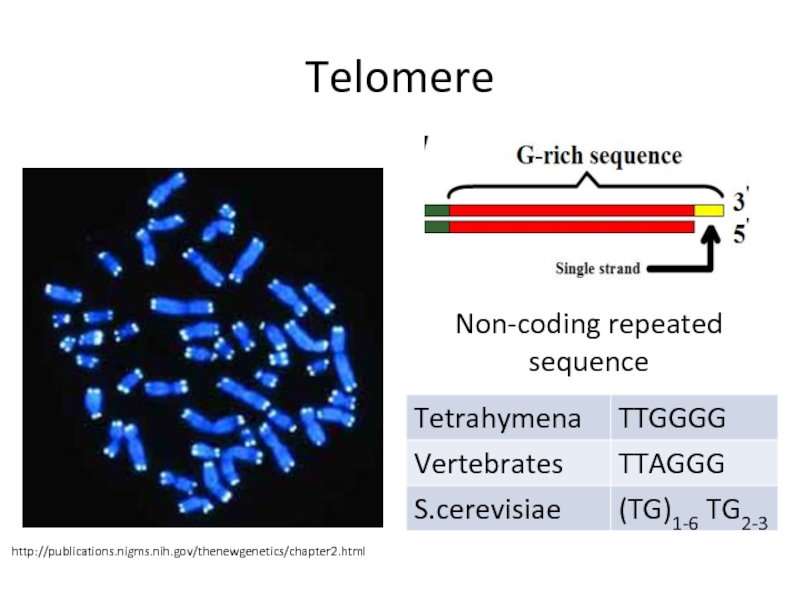
Слайд 5Многократно повторяющиеся блоки в теломерной ДНК простейших состоят всего лишь
из шести-восьми нуклеотидных остатков. При этом одна цепь ДНК сильно
обогащена остатками гуаниловой кислоты (G-богатая цепь; у тетрахимены она построена из блоков TTGGGG), а комплементарная ей цепь ДНК соответственно обогащена остатками цитидиловой кислоты (С-богатая цепь).У дрожжей повторяющиеся блоки в теломерной ДНК заметно длиннее, чем у простейших, и зачастую не столь регулярные.
Теломерная ДНК человека построена из TTAGGG-блоков, то есть отличается от простейших всего лишь одной буквой в повторе. Более того, из TTAGGG-блоков построены теломерные ДНК (вернее, их G-богатые цепи) всех млекопитающих, рептилий, амфибий, птиц и рыб. Столь же универсален теломерный ДНК-повтор у растений: не только у всех наземных растений, но даже у их весьма отдаленных родственников - морских водорослей он представлен последовательностью TTTAGGG
Слайд 6Чем можно объяснить такое сходство? В теломерной ДНК не закодировано
никаких белков (она не содержит генов), у всех организмов теломеры
выполняют универсальные функции. Есть редкие, но важные исключения. Например, теломерная ДНК плодовой мухи дрозофилы представлена не короткими повторами, а ретротранспозонами - подвижными генетическими элементами.Очень важная характеристика теломерных ДНК - их длина. У человека она колеблется от 2 до 20 тыс. пар оснований (т.п.о.), а у некоторых видов мышей может достигать сотен т.п.о.
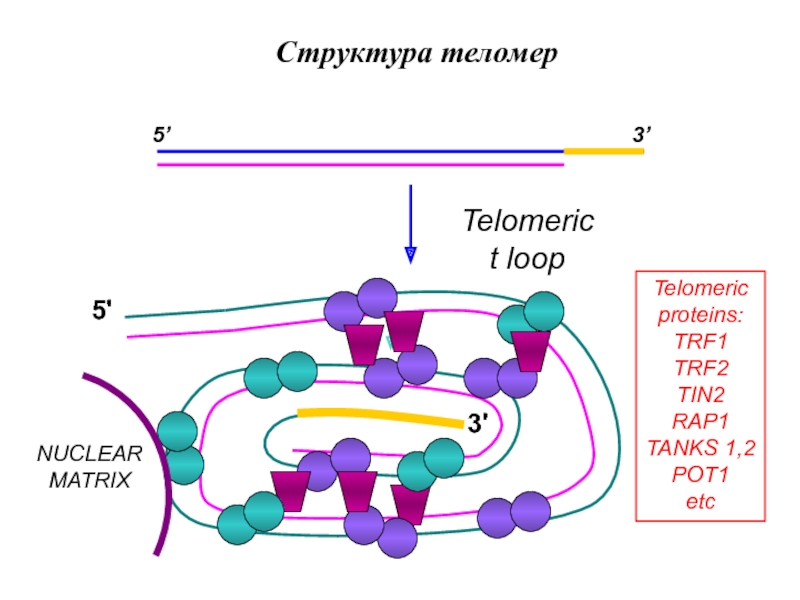
У многих видов двуспиральная теломерная ДНК на самом конце содержит однотяжевой "хвост, представленый ее G-богатой цепью и заканчивающийся свободной 3'-гидроксильной группой. Соответственно белки теломер принято подразделять на две группы: белки, которые связаны с однотяжевой теломерной ДНК, и белки, связанные с двутяжевой ДНК теломеры. Эти белки изучаются весьма интенсивно, но знаем мы о них еще мало. Нет сомнений в том, что теломерные белки участвуют во всех функциях теломер, поддерживая их структуру и регулируя длину теломерной ДНК (как мы увидим ниже, длина теломер - чрезвычайно важный параметр). Установлено, что некоторые из белков, ассоциированных с двуспиральной теломерной ДНК, регулируют активность определенных генов, повышая или подавляя их экспрессию. Например, дрожжевой белок Rap1p. Это означает, что изменения или нарушения в структуре теломер могут затрагивать не только их собственные функции, но и экспрессию жизненно важных генов, находящихся в других районах хромосом. Кроме того, важные для поддержания общей структуры хромосом белки располагаются на ДНК, непосредственно примыкающей к теломерной (иногда ее называют субтеломерной ДНК).
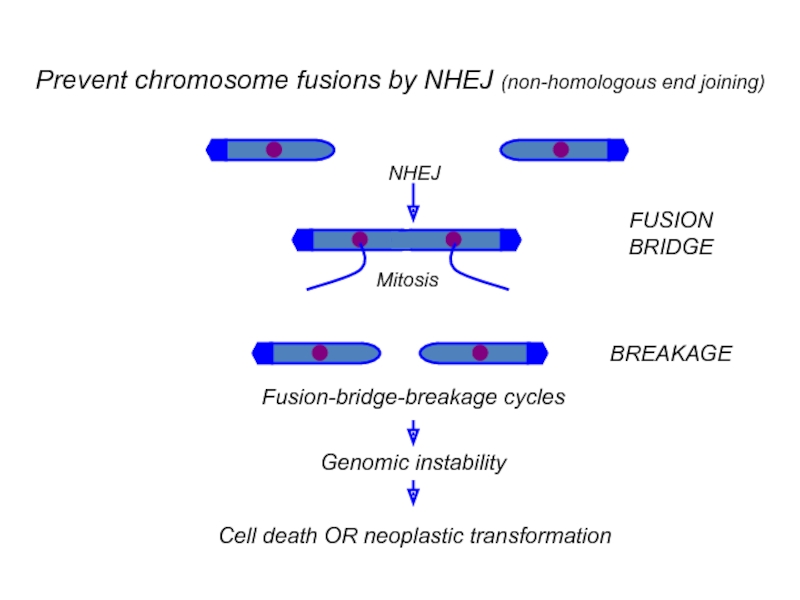
Слайд 7Теломеры содержат ДНК-связывающие белки, специфические для двойных теломерических ДНК, которые
включают TRF1 и TRF2, и специфический белок для одиночного нитевидного
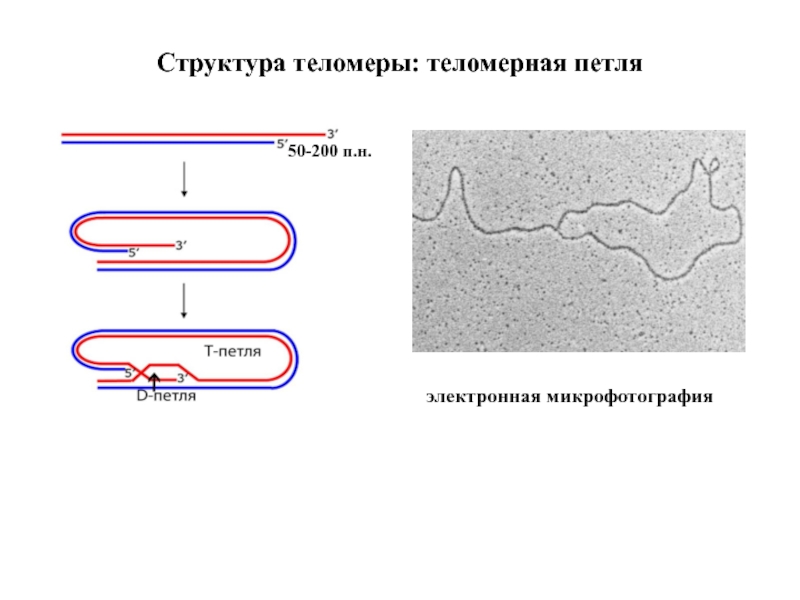
выступа, который обычно присутствует на 3′-концах хромосом.Известно также, что многие другие белки не напрямую связывают теломеры (через TRF1 и TRF2). Однонитевые выступы в 3’-конце теломеразных складок возвращаются к двойной теломерической ДНК, формируя защитную Т-петлю. С теломерными повторами 3’-выступ связывается через TRF1 путем, который еще не совсем понятен, но является важным для теломерной активности.
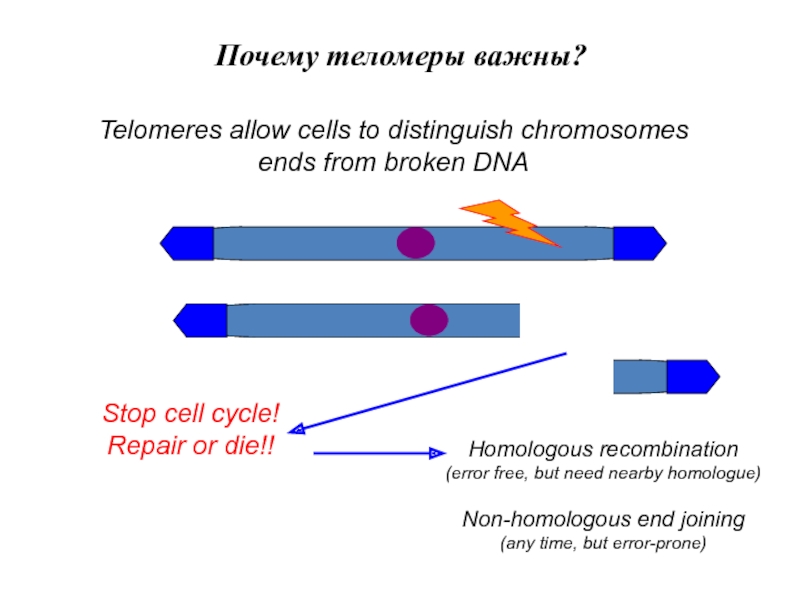
Слайд 8Утрата теломерной ДНК.
Теломерная ДНК утрачивается в клетках человека в
процессе репликации, репарации и ремоделирования ДНК. Причины утраты теломер включают
«проблемы репликации конечных участков», нуклеолитический процессинг 5′-конца цепи и ошибки в репарации повреждений теломерной ДНК, вызванных окислением. Относительный вклад каждого из этих механизмов в общее укорочение теломер с возрастом неизвестен и, скорее всего, варьирует в зависимости от типа клеток и возраста.Процесс укорочения теломер в связи с окислительными повреждениями был обнаружен совсем недавно. Известно, что теломерная ДНК, богатая G-повторами, в 10 раз больше подвержена окислительным повреждениям, чем нетеломерная геномная ДНК. Восстановление окислительных повреждений происходит обычным путем, то есть вырезанием поврежденных нуклеотидов. Этот механизм может быть неэффективным для теломерных участков, так как при достижении репликационной вилкой конца хромосомы связь между матрицей и вновь синтезированной цепью ослабевает. В целом, вклад окислительных повреждений в укорачивание теломерных участков требует тщательных исследований.
Слайд 9Основные сигнальные пути теломер.
Механизм, посредством которого теломеры сигнализируют о
повреждении ДНК, изучен крайне недостаточно. В настоящее время установлено, что
индивидуальный теломерный участок может быть «включен» или «выключен» в плане сигнализации о повреждении. Представляется, что 3′-конец ДНК генерирует такие сигналы. В этот процесс включаются также ATM и р53, остальные детали неизвестны.На каком этапе клеточного цикла возникает сигнал? Репликация ДНК обязательно включает в себя процесс ремоделирования структуры теломер. Так как известно, что утрата теломер происходит во время репликации ДНК, то предполагается, что сигнал о повреждении ДНК возникает во время S — или С2-фаз клеточного цикла. Однако, когда в диплоидных фибробластах человека процессы репликации замедляются, их рост необратимо останавливается в фазе G. Было также показано, что теломеры постоянно «включены» или «выключены», даже когда клетки находятся в фазе G0/Gj. При этом предполагается, что включенное состояние обратно и непрямо коррелирует с длиной теломерных повторов. В соответствии с этим сила сигнала о повреждении ДНК, генерируемого теломерами, будет возрастать по мере укорочения теломер. С этой моделью согласуются антиапоптозный эффект длинных теломер, экспрессия теломеразы, повышение уровня р53 в стареющих клетках (с укороченными теломерами). Усложняют исследование длины теломер различия между организмами и клетками в длине теломер, необходимой для активации сигнальных процессов. Нет сомнений, что эти отличия частично объясняют выраженные различия в длине теломер у клеток одинаковых типов различных индивидуумов одного и того же возраста.
Слайд 10
Теломераза
В 1984 году Э. Блэкберн и Э. Грайдер выделили фермент,
который с помощью механизма, отличного от механизма реакций, лежащих в
основе репликации ДНК, синтезирует теломерную ДНК. Этот фермент был назван теломеразой.Слайд 11Теломераза – это фермент‚ синтезирующий тандемно повторяющиеся сегменты ДНК, из
которых состоит G-цепь теломерной ДНК. Она относится к классу ДНК-полимераз,
это РНК-зависимая ДНК-полимераза или обратная транскриптаза.Теломераза — рибонуклеопротеин, содержащий белок теломеразы обратной транскрипции (hTERT) и теломеразную РНК-матрицу (hTR) в качестве обязательных компонентов.
Ферменты, синтезирующие ДНК на РНК-матрицах, закодированы и содержатся в ретровирусах и служат для синтеза ДНК-копий их геномов, который в ретровирусе представлен РНК. В клеточном геноме обратные транскриптазы закодированы в ретротранспозонах.
РНК, используемая теломеразой для синтеза теломерной ДНК в качестве матрицы, входит в состав этого фермента. В этом уникальность теломеразы: на сегодня это единственная известная РНК-содержащая обратная транскриптаза.
Слайд 12
Теломеразные РНК у разных организмов сильно различаются по длине и
структуре.
- у простейших РНК длиной в 150-200 нуклеотидных остатков (н.о.),
-
длина теломеразной РНК человека - 450 н.о.,теломераза дрожжей содержит аномально длинную РНК (около 1300 н.о.).
теломеразная РНК обладает специфической вторичной и третичной структурой (вторичная структура изолированной теломеразной РНК достоверно установлена только для теломераз простейших, пространственная структура теломеразной РНК в составе ферментативного комплекса пока еще неизвестна).
Матричный участок представлен в теломеразной РНК только один раз. Его длина не превышает длину двух повторов в теломерной ДНК, которые он кодирует и которым он, разумеется, комплементарен.
Так как теломераза синтезирует сегменты ДНК, повторяющиеся много раз, используя только один сегмент своей РНК, она должна обладать способностью периодически (после завершения синтеза каждого повтора) перемещать (транслоцировать) матричный участок в район 3'-конца синтезируемой теломерной ДНК. Источником энергии для такого перемещения, по-видимому, служит сама реакция синтеза цепи теломерной ДНК, поскольку дезоксинуклеозидтрифосфаты - субстраты этой реакции - высокоэнергетические вещества.
Слайд 13
Как работает теломераза?
На первой стадии теломераза находит 3'-конец теломерной ДНК,
с которым часть матричного участка теломеразной РНК образует комплементарный комплекс.
При этом теломераза использует 3'-конец хромосомной ДНК в качестве праймера.2. Далее наступает очередь РНК-зависимой ДНК-полимеразной активности теломеразы. Она обеспечивается специальной субъединицей теломеразы, которая по устройству своего каталитического центра во многом сходна с обратными транскриптазами ретровирусов и ретротранспозонов.
3. Когда синтез ДНК-повтора заканчивается, происходит транслокация, то есть перемещение матрицы и белковых субъединиц фермента на заново синтезированный конец теломерной ДНК, и весь цикл повторяется вновь.
Знакомство даже с весьма схематичным описанием механизма теломеразной реакции приводит к заключению, что двумя компонентами - обратной транскриптазой и теломеразной РНК - для ее осуществления обойтись нельзя.
Слайд 14Нет сомнений в том, что в составе теломеразного комплекса должны
быть
- субъединица, отвечающая за поиск и связывание 3'-конца хромосомы
(и выполняющая таким образом своеобразную якорную функцию); - субъединица, ответственная за транслокацию;
- субъединицы, связывающие продукт реакции (однотяжевую ДНК).
- В составе теломеразы обычно обнаруживается и белковая субъединица с нуклеазной активностью, которая, по-видимому, отщепляет от 3'-конца теломерной ДНК один за другим несколько нуклеотидов до тех пор, пока на этом конце не окажется последовательность, комплементарная нужному участку матричного сегмента теломеразной РНК.
Нужно еще раз подчеркнуть, что полный белковый состав фермента не известен до сих пор ни в одном случае.
Слайд 15Широкое распространение теломераз среди эукариот говорит о том, что механизм
синтеза теломерной ДНК, который мы наблюдаем у современных организмов, возник
очень давно. Более того, эволюционно-генетический сравнительный анализ нуклеотидных последовательностей генов каталитических субъединиц теломераз и других обратных транскриптаз показывает, что этот механизм мог существовать еще до появления первых эукариотических клеток.С-цепь теломерной ДНК синтезируется с помощью обычной ДНК-полимеразы. Поэтому 3'-концевой участок G-цепи, на котором, по-видимому, первоначально была РНК-затравка, в конечном итоге остается в однотяжевом состоянии (то есть в принципе он готов к тому, чтобы теломераза нарастила на нем новый повтор).
Слайд 16Активность теломеразы у высших эукариот обнаружена лишь в трех типах
клеток:
- генеративных,
- раковых
- линиях иммортализованных клеточных культур.
половых и стволовых клетках.
В остальных типах клеток синтез этого фермента прекращается еще в эмбриональный период развития
В организме при дифференцировке клеток теломераза репрессируется. Экспрессию теломеразы считают фактором иммортализации клеток.
Слайд 17В соматических клетках, культивируемых in vitro, теломераза не работает и
теломеры постепенно укорачиваются. Длина теломер достоверно коррелирует с пролиферативным потенциалом
(например, в фибробластах человека). Укорочение теломер может играть роль митотических часов, отсчитывающих число делений клетки. По достижении критической длины теломерной ДНК запускаются процессы остановки клеточного цикла. Блок клеточных делений наступает еще до того, как теломера исчезла вовсе. Существует некоторая минимальная длина теломеры, когда деление еще разрешено. Иными словами, прекращение деления наступает до того, как начал разрушаться смысловой текст генома. Таким способом эукариоты страхуют себя от появления монстров вследствие недорепликации ДНК.Слайд 18Опубликованная в 1998 году в журнале "Science" статья американских исследователей
благодаря средствам массовой информации привлекла внимание не только ученых (а
в первую очередь не ученых) в связи с проблемами старения и "клеточного бессмертия". В этой прекрасной работе коллектива, возглавляемого Джерри Шеем, удалось на 40% увеличить число делений нормальных соматических клеток человека в культуре. С помощью генно-инженерных методов в клетки был введен ген каталитической белковой субъединицы теломеразы и прилегающий к нему участок ДНК, регулирующий его работу. При активной работе гена увеличивался как размер теломерной ДНК, так и продолжительность жизни клеточных культур. Сверх обычных 50 делений клетки прошли дополнительно 20 делений.Слайд 19Укорочение теломер можно рассматривать как молекулярный индикатор количества делений, но
не старения клетки. Так, на культуре нормальных фибробластов человека, взятых
от доноров в возрасте от 0 до 93 лет, выявили корреляцию между начальной длиной теломер и пролиферативной способностью клетки во всем диапазоне возрастов. А размер теломерной ДНК сперматозоидов не уменьшался в соответствии с возрастом мужчины, что говорит об экспрессии теломеразы в линии половых клеток. Прекращение работы теломеразы, отмечаемое в подавляющем большинстве дифференцированных соматических клеток животных, является свидетельством их зрелости, а стало быть, и неизбежно следующих затем процессов увядания и гибели.Слайд 20Старение особи - это нормальная биологическая функция, способствующая прогрессивной эволюции
вида, размножающегося половым путем. Давление естественного отбора ослабевает после достижения
животным репродуктивного успеха, поскольку существование особи после этого имеет меньшее значение для вида. Смерть от старости удаляет из популяции выполнивших свою роль предков и дает простор потомкам - носителям новых полезных признаков. Как любая важная биологическая функция, старение обусловлено параллельным действием нескольких молекулярных механизмов. Выключение теломеразы - лишь один из них.Не стоит рассматривать гены, кодирующие белковые субъединицы теломеразы и входящую в ее состав РНК, как "гены бессмертия". Поддержание длины теломерной ДНК на определенном уровне зависит не только от взаимодействия с ней теломеразы и теломерсвязывающих белков, но и некоторых, пока неизвестных факторов, регулирующих образование самих компонентов теломеробразующего комплекса.
Вряд ли бессмертие, достигнутое раковыми клетками, размножающимися в культуре десятилетиями без укорочения теломер, - это то, к чему нужно стремиться. Лекарства от смерти нет. Но тот факт, что введение в такие клетки препаратов, связывающих РНК-компонент теломеразы, приводит к укорочению теломер с последующей гибелью клеток, вселяет надежду на появление новых средств борьбы с раком.
Понимание механизма работы теломеразы, а главное, регуляции экспрессии ее в клетке приблизит нас к пониманию процессов и злокачественной трансформации и старения.
Слайд 21ТЕЛОМЕРАЗА, РАК И СТАРЕНИЕ
Вопрос о том, в какой мере теломерный
механизм участвует в старении многоклеточных организмов. Вполне возможно, что они
изобрели совсем иные программы старческого феноптоза. Однако несомненно, что у людей - рекордсменов по долгожительству уменьшение длины теломер уже приближается к той роковой черте, за которой наступает запрет на размножение клеток. Так, по данным группы К. Сасаджимы из Японии, теломеры в клетках печени стариков старше 80 лет оказываются почти вдвое короче, чем у детей до 8 лет. По-видимому, продлить жизнь тем, кому за 100, можно лишь при условии, что удастся нарастить их теломеры, включив на какое-то время теломеразу в печени и других тканях, где этот фермент выключился еще во время эмбрионального развития.Однако и здесь есть редкие, но важные исключения: теломеразная активность обнаруживается в таких "смертных" клетках, как макрофаги и лейкоциты.
Недавно было установлено, что нормальные соматические клетки потому лишены теломеразной активности, что в них полностью подавлена экспрессия гена ее каталитической субъединицы (обратной транскриптазы). Другие же составляющие теломеразы, включая теломеразную РНК, образуются в этих клетках, хотя и в меньших количествах, чем в их "бессмертных" прародителях, но постоянно (или, как говорят, конститутивно). Открытие этого важного факта Дж. Шеем, В. Райтом и их сотрудниками и стало основой для той сенсационной работы по преодолению "лимита Хейфлика". Действительно, все остальное было уже делом техники (хотя и очень непростой).
Слайд 22Легковесность первого вывода (а именно его подхватили средства массовой информации)
очевидна: между культурой клеток и клеточной тканью, а тем более
организмом дистанция огромного размера. В то же время существуют вполне реальные планы активировать теломеразу в клетках кожи.Что же касается разработки методов избирательного подавления теломеразной активности в раковых опухолях, большинство работ связано с испытанием ингибиторов обратных транскриптаз (каталитических субъединиц теломераз). Главная трудность заключается в том, что каталитическая субъединица теломеразы - это одна из ДНК-полимераз и искомый ингибитор должен быть направлен именно на теломеразную ДНК-синтезирующую активность. В противном случае он будет токсичен для нормальных клеток.
Изучение тонкой структуры теломер и механизма действия теломераз находится еще только в начальной стадии. Однако они привлекают к себе огромный интерес исследователей, работающих в самых разных областях биологии и медицины, и здесь уже в ближайшее время можно ждать новых интересных открытий.
Слайд 23Telomere
http://publications.nigms.nih.gov/thenewgenetics/chapter2.html
Non-coding repeated sequence
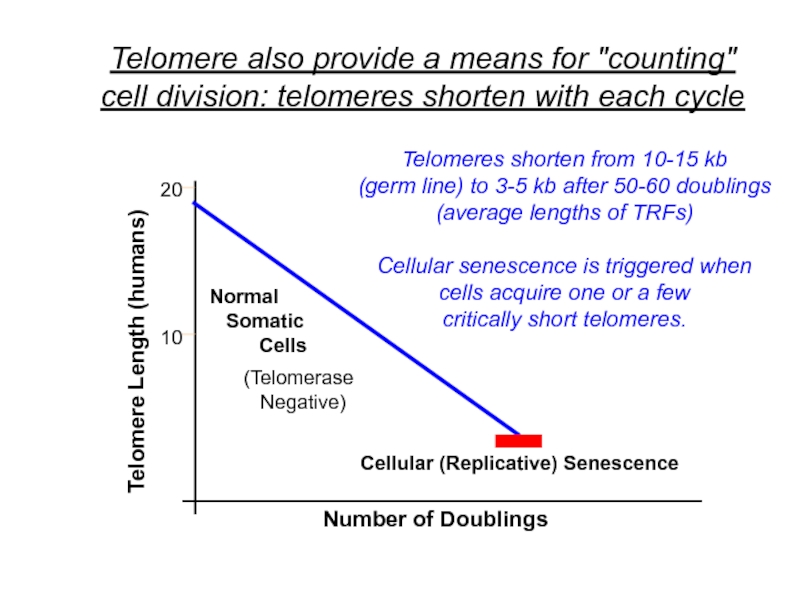
Слайд 27Telomere also provide a means for
"counting" cell division
How do
cells "know" how many
divisions they have completed??
Слайд 33Теломеразы: биомедицинское использование
Expand cells for replacement therapies
(burns, joint replacements, etc)
Telomerase
inhibitors to selectively kill cancer cells
Слайд 34Теломерная гипотеза старения
Telomeres shorten with each cell division and therefore
with age
TRUE
Short telomeres cause cell senescence and senescent cells may
contribute to agingTRUE
HYPOTHESIS:
Telomere shortening causes aging and telomerase will prevent aging
TRUE OR FALSE?
Telomere length is not related to life span (mice vs human; M musculus vs M spretus)
Telomeres contribute to aging ONLY if senescent cells contribute to aging
Telomerase protects against replicative senescence but not senescence induce by other causes
Слайд 35SUMMARY
Telomeres are essential for chromosome stability
Telomere shortening occurs owing
to the biochemistry of
DNA replication
Short telomeres cause replicative senescence
(other
senescence causes are telomere-independent)Telomerase prevents telomere shortening and
replicative senescence
The telomere hypothesis of aging depends on the
cellular senescence hypothesis of aging
Слайд 39Теломера: «телос» - конец и «мерос» -часть (с греческого)
Herman
Muller (1890-1967) 1946 Нобелевская премия по физиологии и медицине за
исследование мутаций, индуцированных облучениемBarbara McClintock (1902–1992) 1983 Нобелевская премия по физиологии и медицине за открытие мобильных генетических элементов
Открытие теломер – 1932 г.
Слайд 42Замена теломерных повторов на другие:
1. Саттелитная ДНК:
Лук-батун (Аllium
ßstulosum)
2. Ретротранспозоны:
Дрозофила (Drosophila melanogaster)
Тутовый шелкопряд (Bombyx mori)
3. Рибосомная ДНК и другие тандемные повторы:
Лук репчатый (Allium сера)
Хирономусы
Москиты
Слайд 43Прерывистые теломеры:
Непрацентарные млекопитающие
Бурозубка иберийская (Sorex granarius)
Флуоресцентная гибридизация
in situ на фибриллах S. granarius с 18S рибосомной и
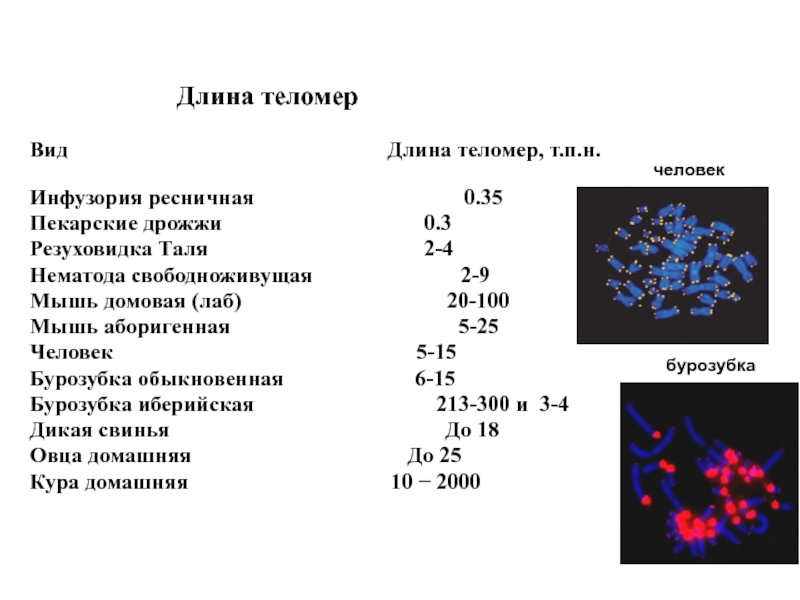
PNA теломерной пробамиСлайд 44Длина теломер
Вид
Длина теломер, т.п.н.
Инфузория ресничная 0.35
Пекарские дрожжи 0.3
Резуховидка Таля 2-4
Нематода свободноживущая 2-9
Мышь домовая (лаб) 20-100
Мышь аборигенная 5-25
Человек 5-15
Бурозубка обыкновенная 6-15
Бурозубка иберийская 213-300 и 3-4
Дикая свинья До 18
Овца домашняя До 25
Кура домашняя 10 − 2000
человек
бурозубка
Слайд 46Структура теломер: G-квадруплексы
Химическая структура квадруплекса
Образование «стопок» на концах
хромосом
Вид сверху
3D структура внутримолекулярного теломерного G-квадруплекса хромосомы человека
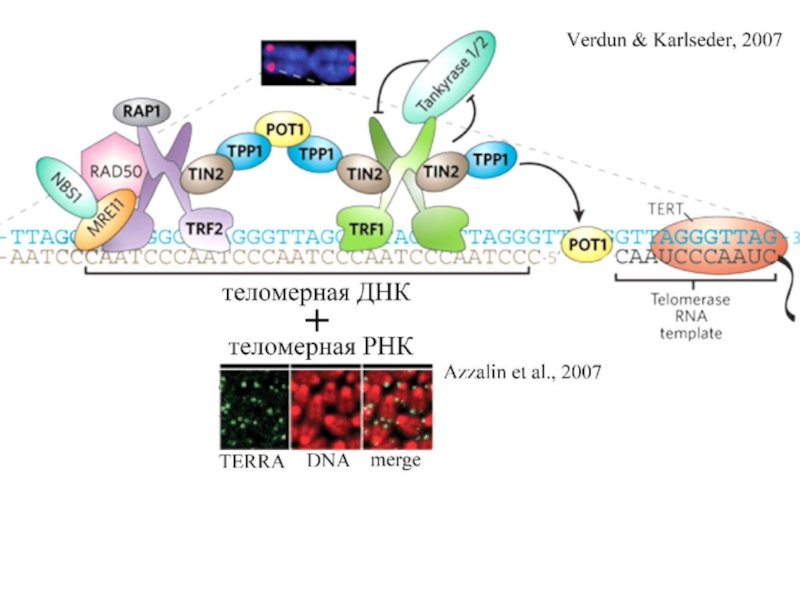
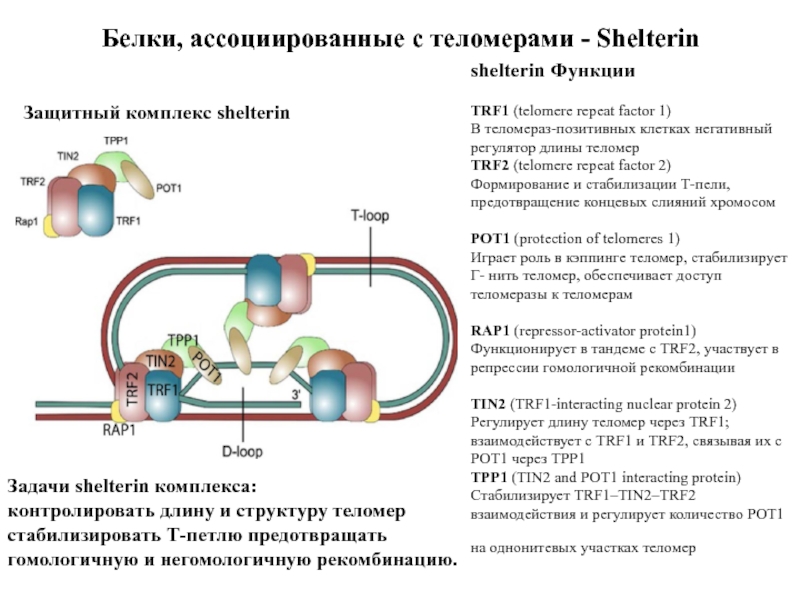
в растворе калия. Центр структуры содержит 3 слоя G-квадратов. Синим представлены водородные связи слоев. Слайд 47Белки, ассоциированные с теломерами - Shelterin
Защитный комплекс shelterin
Задачи
shelterin комплекса:
контролировать длину и структуру теломер
стабилизировать Т-петлю предотвращать
гомологичную и негомологичную рекомбинацию. shelterin Функции
TRF1 (telomere repeat factor 1)
В теломераз-позитивных клетках негативный
регулятор длины теломер
TRF2 (telomere repeat factor 2)
Формирование и стабилизации Т-пели,
предотвращение концевых слияний хромосом
POT1 (protection of telomeres 1)
Играет роль в кэппинге теломер, стабилизирует Г- нить теломер, обеспечивает доступ
теломеразы к теломерам
RAP1 (repressor-activator protein1)
Функционирует в тандеме с TRF2, участвует в
репрессии гомологичной рекомбинации
TIN2 (TRF1-interacting nuclear protein 2)
Регулирует длину теломер через TRF1;
взаимодействует с TRF1 и TRF2, связывая их с
POT1 через TPP1
TPP1 (TIN2 and POT1 interacting protein)
Стабилизирует TRF1–TIN2–TRF2
взаимодействия и регулирует количество POT1
на однонитевых участках теломер
Слайд 48shelterin
Функции
TRF1 (telomere repeat factor 1) В теломераз-позитивных клетках негативн ый регулятор длины теломер
TRF2 (telomere repeat factor 2) Формирование и стабилизации Т-пели, предотвращение концевых слияний хромосом
POT1 (protection of telomeres 1) Играет роль в кэппинге теломер, стабилизирует Г- нить теломер, обеспечивает доступ теломеразы к теломерам
RAP1 (repressor-activator protein1) Функционирует в тандеме с TRF2, участвует в репрессии гомологичной рекомбинации
TIN2 (TRF1-interacting nuclear protein 2) Регулирует длину теломер через TRF1; взаимодействует с TRF1 и TRF2, связывая их с POT1 через TPP1
TPP1 (TIN2 and POT1 interacting protein) Стабилизирует TRF1–TIN2–TRF2 взаимодействия и регулирует количество POT1 на однонитевых участках теломер
Слайд 49Белки, ассоциированные с теломерами – не Shelterin
Белки, не входящие
в Shelterin Функции
Ku, связывается через TRF1 Связывается с двунитевыми
разрывами ДНК и регулирует репарациию ДНК путем негомологичной рекомбинации, регулирует количество теломеразы на теломерах. комплекс MRN (Mre11-Rad50-Nbs1 ), связывается через TRF2 Белки репарации путем рекомбинации, на теломерах участвуют в формировании Т-петли
ATM, связывается через TRF2 Является сигнальным белком на двунитевые разрывы ДНК при критическом укорочении теломер
WRN helicases, связывается через TRF2 Участвует в процессах репарации и репликации ДНК. Раскручивает Т-петли и Г-квадруплексы на теломерах, подавляет сестринские обмены хроматид
BLM helicase участвует в репарации поврежденных репликативных вилок, облегчает репликацию теломер за счет раскручивания двунитевой ДНК впереди репликативной вилки
Tankyrases, связывается через TRF1 Позитивно регулируют длину теломеры путем ингибирования TRF1
Rad51 Участвует в рекомбинационной репарации двунитевых разрывов ДНК и в защите теломер за счет стабилизации T-петли
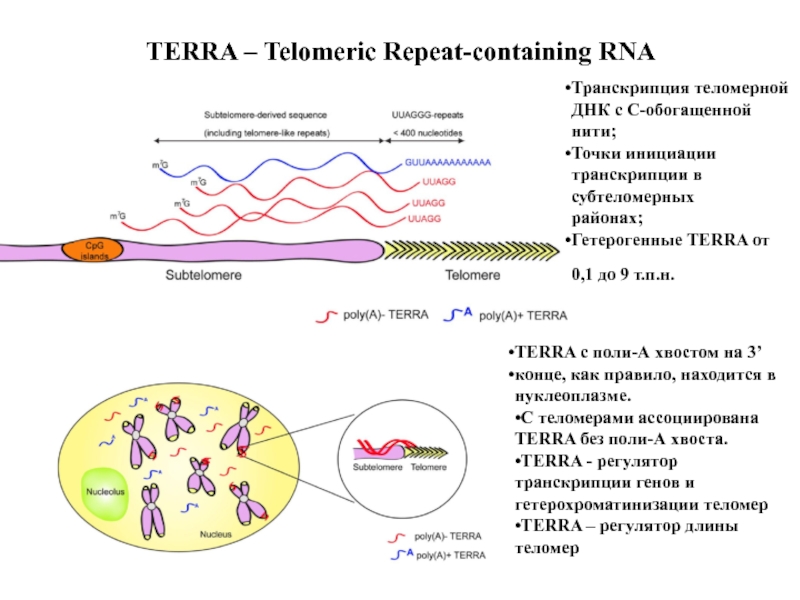
Слайд 50TERRA – Telomeric Repeat-containing RNA
Транскрипция теломерной ДНК с C-обогащенной
нити;
Точки инициации транскрипции в субтеломерных
районах;
Гетерогенные TERRA от
0,1 до 9 т.п.н.
TERRA c поли-А хвостом на 3’
конце, как правило, находится в нуклеоплазме.
•С теломерами ассоциирована TERRA без поли-А хвоста.
•TERRA - регулятор транскрипции генов и гетерохроматинизации теломер
•TERRA – регулятор длины
теломер