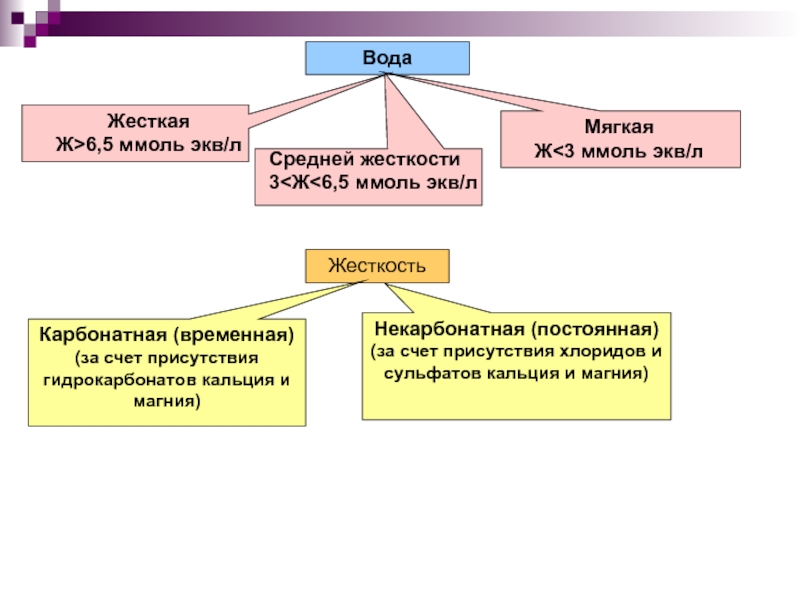
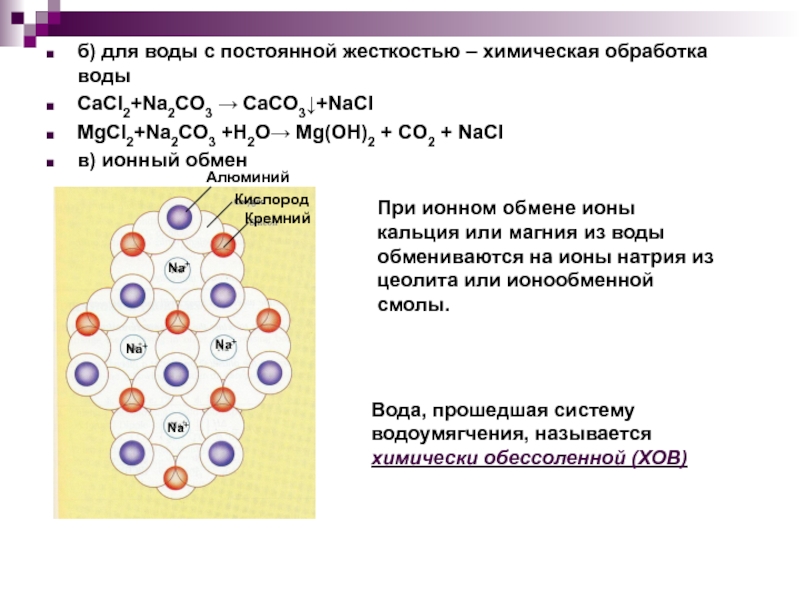
сталкиваясь, передают друг другу какие-либо частицы
Сущность протекающих при обменных реакциях
процессов наиболее полно выражают уравнения реакций в ионно-молекулярной форме. При записи уравнения реакции в ионно-молекулярной форме газы, слабые и средние электролиты записывают в виде молекул, а сильные – в виде ионов.
NaOH + HBr→ NaBr + H2O
Na+ + OH- + H++ Br-→ Na++ Br- + H2O
H++ OH- → H2O
Любая ионообменная реакция протекает в сторону образования слабого электролита. Если в результате реакции слабого электролита не образуется, реакция не идет.












![Тема 10. Обменные реакции в растворах электролитов 3) Определение условий выпадения осадка при сливании растворов двух солейBa(NO3)2+Na2SO4 → 3) Определение условий выпадения осадка при сливании растворов двух солейBa(NO3)2+Na2SO4 → BaSO4↓+ 2NaNO3Ba2++SO42- → BaSO4[Ba2+][SO42- ] =](/img/thumbs/768723e6f70349eadc760f58b07a9874-800x.jpg)