Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Тема: Белки соединительной ткани – коллаген, эластин, протеогликаны
Содержание
- 1. Тема: Белки соединительной ткани – коллаген, эластин, протеогликаны
- 2. Слайд 2
- 3. Все разновидности соединительной ткани содержат клетки, волокнистые
- 4. Коллаген – основной структурный белок соединительной тканиКоллагены
- 5. Строение молекул коллагенов Молекулы коллагенов
- 6. Особенности аминокислотного состава коллагенаПолипептидная цепь коллагена состоит
- 7. Схематически цепь коллагена может быть
- 8. Синтез коллагена Коллаген синтезируется внутри различных
- 9. Созревание коллагена (процессинг)После синтеза цепи коллагена следует
- 10. Уникальные свойства коллагеновКоллагеновые волокна обладают огромной прочностью
- 11. Катаболизм коллагенаРаспад коллагена происходит медленно под действием
- 12. Основной маркер распада коллагенаВажнейший метаболитом характеризующим скорость
- 13. Типы коллагенаВ настоящее время известно около 20
- 14. Наиболее распространенные типы коллагенов.
- 15. Эластин – это основной компонент эластических волокон
- 16. Особенности аминокислотного состава эластинаЭластин – гликопротеин с
- 17. Структура эластинаНативные волокна эластина построены из молекул,
- 18. Строение протеогликанов В структуре протеогликанов выделяют коровый
- 19. Основную часть протеогликанов составляют гликозамингликаны (ГАГ)Гликозаминогликаны –
- 20. Схема агрегатов протеогликанов
- 21. Метаболизм протеогликановСинтез протеогликанов начинается с синтеза корового
- 22. Витамин С или аскорбиновая кислота – одно
- 23. Витамин С играет роль ко-фактора в реакции
- 24. Спасибо за внимание
- 25. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2
. Соединительная ткань чрезвычайно распространена в организме. Она есть у
всех органах и служит основой для их образования и исправления
повреждений. В соединительнотканных образований относят кожу, подкожную жировую ткань, кости, зубы, фасции, строму паренхиматозных внутренних органов, нейроглии, стенки крупных кровеносных сосудов и тому подобное.Слайд 3Все разновидности соединительной ткани содержат клетки, волокнистые структуры и основную
межклеточное вещество. Волокна построены из фибриллярных белков коллагена и эластина, а
углеводно-белковые комплексы, протеогликаны, образуют основную межклеточное вещество. Углеродными компонентами протеогликанов является гетерополисахариды гликозаминогликаны (старое название мукополисахариды). Основные низкомолекулярные компоненты соединительной ткани – вода и ионы натрия. Содержание волокнистых структур, основного вещества и воды неодинаков в разных видах соединительной ткани. В среднем доля основного межклеточного вещества в организме составляет 20% массы тела, а вся соединительная ткань – около 50% массы тела. С возрастом в соединительной ткани уменьшается содержание воды и гликозаминогликанов, а растет содержание коллагена; одновременно изменяются физико-химические свойства волокон.Слайд 4Коллаген – основной структурный белок соединительной ткани
Коллагены составляют приблизительно 30
% общего количества белка в организме, синтезируется клетками соединительной ткани.
В настоящее время идентифицировано более 20 разновидностей коллагенов, которые кодируются отдельными генами.
Слайд 5
Строение молекул коллагенов
Молекулы коллагенов имеют трехспиральную структуру, полученную
при скручивании трех полипептидных α – цепей, где отдельные цепи
связаны между собой водородными связями. Количество аминокислот в каждой из α – цепей около 1000.Слайд 6Особенности аминокислотного состава коллагена
Полипептидная цепь коллагена состоит из повторяющихся триплетов:
[Гли-Х-Y],
где Гли – глицин, Х и
Y могут быть любыми аминокислотами, но чаще всего:Х –пролин или аланин
Y - гидроксипролин или гидроксилизин.
Коллаген содержит 33% глицина.
На рисунке аминокислотные остатки
глицина окрашены в черный цвет,
а других аминокислот – в белый.
Слайд 7
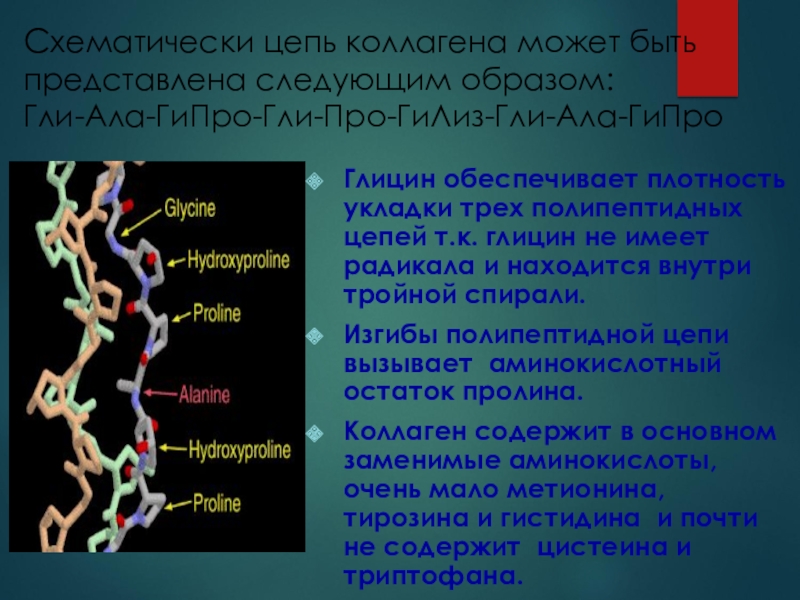
Схематически цепь коллагена может быть представлена следующим образом:
Гли-Ала-ГиПро-Гли-Про-ГиЛиз-Гли-Ала-ГиПро
Глицин обеспечивает
плотность укладки трех полипептидных цепей т.к. глицин не имеет радикала
и находится внутри тройной спирали.Изгибы полипептидной цепи вызывает аминокислотный остаток пролина.
Коллаген содержит в основном заменимые аминокислоты, очень мало метионина, тирозина и гистидина и почти не содержит цистеина и триптофана.
Слайд 8Синтез коллагена
Коллаген синтезируется внутри различных клеток соединительной ткани
в виде препроколлагена, содержащего на N – конце сигнальную последовательность
из 100 аминокислотных остатков.Слайд 9Созревание коллагена (процессинг)
После синтеза цепи коллагена следует сложный многоступенчатый процесс
- созревания коллагена.
Включает 2 этапа:
- внутриклеточный
-
внеклеточныйНа первом этапе происходит пострансляционная модификация полипептидных цепей препроколлагена.
Во втором этапе – образуются зрелые коллагеновые волокна.
Слайд 10Уникальные свойства коллагенов
Коллагеновые волокна обладают огромной прочностью и практически нерастяжимы.
Они могут выдерживать нагрузку, в 10 000 раз превышающую их
собственный вес.Именно поэтому большое количество коллагеновых волокон, состоящих из коллагеновых фибрилл, входит в состав кожи, сухожилий, хрящей и костей.
Слайд 11Катаболизм коллагена
Распад коллагена происходит медленно под действием коллагеназ.
Основной фермент
- Са 2+, Zn 2+ - зависимая коллагеназа (металлопротеиназа) расщепляет
пептидные связи в определенных участках коллагена.Образующиеся фрагменты спонтанно денатурируют и становятся доступными для действия других протеолитических ферментов.
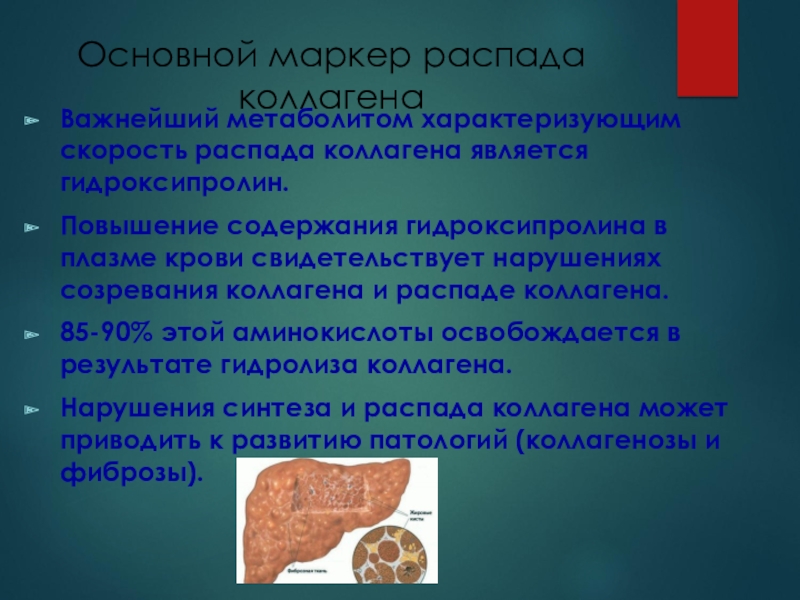
Слайд 12Основной маркер распада коллагена
Важнейший метаболитом характеризующим скорость распада коллагена является
гидроксипролин.
Повышение содержания гидроксипролина в плазме крови свидетельствует нарушениях созревания
коллагена и распаде коллагена. 85-90% этой аминокислоты освобождается в результате гидролиза коллагена.
Нарушения синтеза и распада коллагена может приводить к развитию патологий (коллагенозы и фиброзы).
Слайд 13Типы коллагена
В настоящее время известно около 20 различных типов коллагена,
различающихся по первичной и пространственной структурам, по функциям, локализации в
организме и биологической роли.Различают два основных типа цепей коллагена:
α1 и α2,
а также четыре разновидности цепи α1:
α1(I), α1(II), α1(III), α1(IV).
Для обозначения каждого вида коллагена пользуются формулой,
Например: коллаген I типа - [α1(I)]2 α2
Слайд 15Эластин – это основной компонент эластических волокон
Содержатся в
тканях, обладающих значительной эластичностью - кровеносные сосуды, легкие,
связки в большом количестве. Свойства эластичности
проявляются высокой
растяжимостью волокон и быстрым восстановлением
исходной формы и размера
после снятия нагрузки.
Слайд 16Особенности аминокислотного состава эластина
Эластин – гликопротеин с молекулярной массой 70кДа,
содержит много гидрофобных аминокислот - глицина, аланина, валина, лейцина и
пролина.Наличие гидрофобных радикалов препятствует созданию вторичной и третичной структуры, в результате молекулы эластина принимают различные конформации в межклеточном матриксе.
В эластине мало гидроксилизина и практически нет цистеина, триптофана.
Слайд 17Структура эластина
Нативные волокна эластина построены из молекул, соединенных в тяжи
с помощью жестких поперечных сшивок – десмозина и изодесмозина,
а также лизиннорлейцина.В образовании этих сшивок участвуют остатки аллизина и лизина двух, трех и четырех пептидных цепей.
Связывание полипептидных цепей десмозинами формирует резиноподобную сеть.
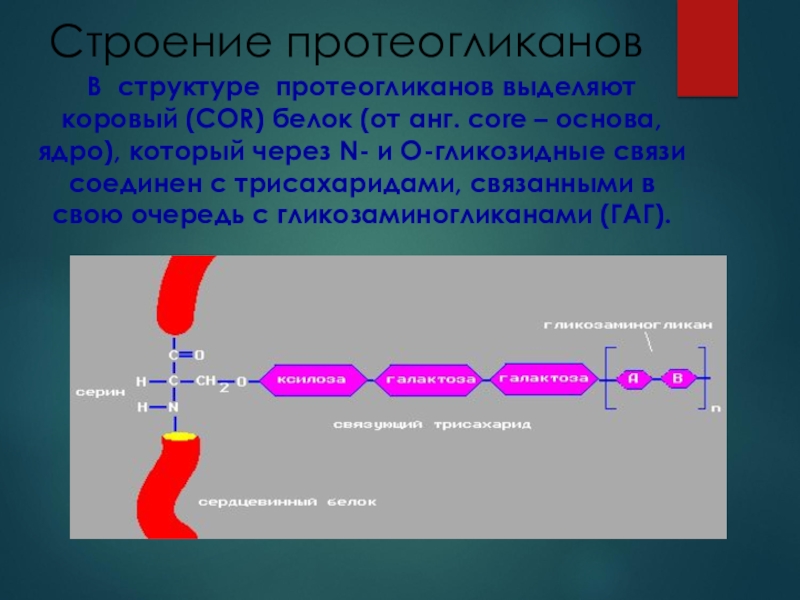
Слайд 18Строение протеогликанов
В структуре протеогликанов выделяют коровый (COR) белок (от
анг. сore – основа, ядро), который через N- и О-гликозидные
связи соединен с трисахаридами, связанными в свою очередь с гликозаминогликанами (ГАГ).Слайд 19Основную часть протеогликанов составляют гликозамингликаны (ГАГ)
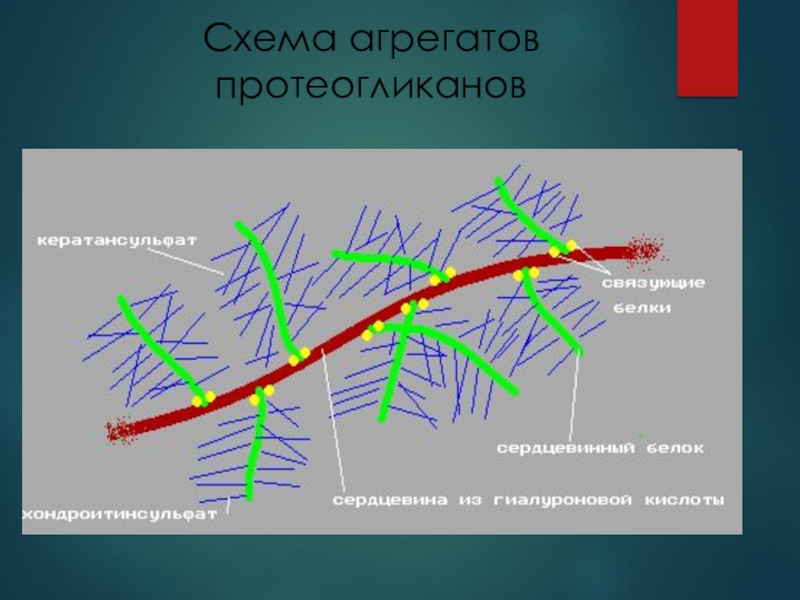
Гликозаминогликаны – гетерополисахариды, состоящие из
повторяющихся дисахаридов, в состав которых могут входить глюкуроновая кислота и
N - ацетилированный гекзозамин (N-ацетилглюкозамин или N – ацетилгалактозамин)В составе протеогликанов входят сульфатированные и несульфатированные ГАГ.
Самые распространенные сульфатированные ГАГ в организме человека – хондроитинсульфаты, кератинсульфаты и дерматансульфаты.
Слайд 21Метаболизм протеогликанов
Синтез протеогликанов начинается с синтеза корового белка в клетках
соединительной ткани, далее к нему присоединяются ГАГ, синтезированные в аппарате
Гольджи и образовавшийся протеогликан выходит из клетке в внеклеточный матрикс (рис).Распад протеогликанов происходит в межклеточном матриксе соединительной ткани под действием ферментов.
Слайд 22Витамин С или аскорбиновая кислота – одно из важнейших веществ,
необходимых человеческому организму, незаменимый витамин, который обязательно должен поступать с
пищей.Роль витамина С в организме давно и хорошо изучена, однако его роль в процессе биосинтеза костного вещества, основных белков сухожилий, сосудов, связок была изучена относительно недавно. Сейчас можно уверенно утверждать – витамин С – одно из важнейших веществ, определяющих здоровье соединительной ткани и опорно-двигательного аппарата в целом.





![Тема: Белки соединительной ткани – коллаген, эластин, протеогликаны Особенности аминокислотного состава коллагенаПолипептидная цепь коллагена состоит из повторяющихся триплетов: Особенности аминокислотного состава коллагенаПолипептидная цепь коллагена состоит из повторяющихся триплетов: [Гли-Х-Y], где Гли – глицин,](/img/tmb/7/636130/c387eee5c9d6c9c343bd8186ebf7eeae-800x.jpg)