Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Тема Химическая связь и строение вещества Ижевск 2013 Кафедра Химия и
Содержание
- 1. Тема Химическая связь и строение вещества Ижевск 2013 Кафедра Химия и
- 2. План лекции Природа химической связиКовалентная связьМетод валентных
- 3. Природа химической связиХимическая связь имеет электростатическую природу,
- 4. Изменение потенциальной энергии системы из двух функции расстояния между ними.
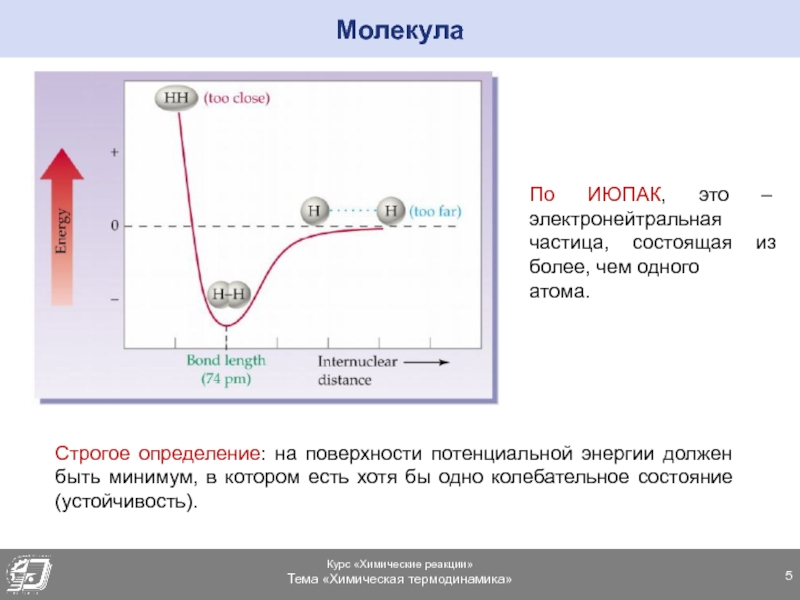
- 5. Молекула По ИЮПАК, это – электронейтральнаячастица, состоящая
- 6. Основные типы химической связиПолярная связьДелокализованная связь
- 7. Сравнительная характеристика методов валентной связи и молекулярных орбиталей
- 8. Ковалентная связьМетод валентных связей (МВС):Связь образуется при
- 9. Аналогично по донорно-акцепторному механизму образуется связь в
- 10. Свойства ковалентной связи Насыщаемость – способность атомов
- 11. Свойства ковалентной связи Поляризуемость – это мера
- 12. Дипольные моменты молекул СО2
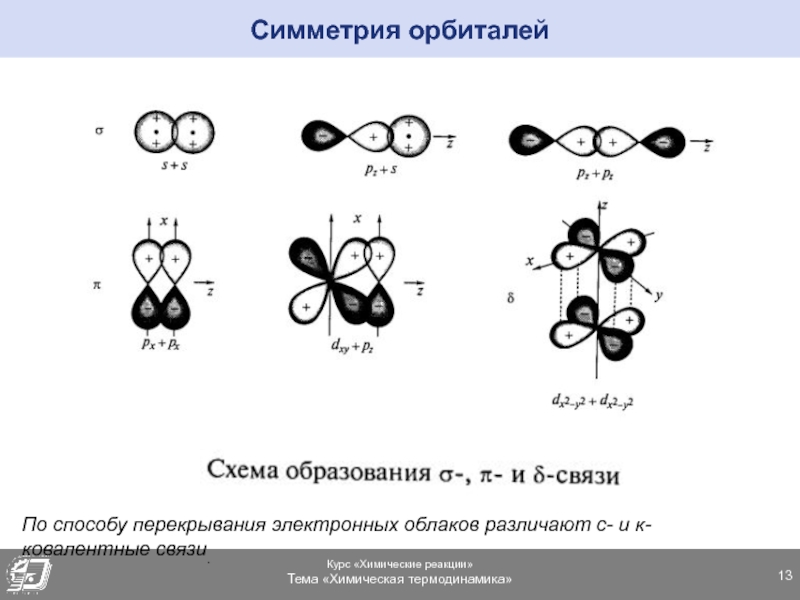
- 13. Симметрия орбиталейПо способу перекрывания электронных облаков различают с- и к-ковалентные связи.
- 14. Направленность связей Определяет геометрическое строение молекулы.Метод гибридизации
- 15. Модель гибридизация орбиталейСмешение орбиталей центрального атома по
- 16. sp2 - гибридизация BF3В 1s22s22p1В* 1s22s12p2Структура молекулы – плоская тригональная
- 17. sp3 - гибридизация Образование гибридных орбиталейС 1s22s22p2 C* 1s22s12p3
- 18. Образование σ - связей в метане Структура молекулы – тетраэдрическаяСН4sp3 – гибридизация
- 19. Слайд 19
- 20. Объемная модель молекулы метана
- 21. Влияние несвязывающей электронной парыПерекрывание валентных орбиталей в
- 22. Делокализованная -связь lC – O = 0,129 нмГеометрическая форма иона – треугольная [СO3]2-Сsp2- гибридизация
- 23. Метод ОВЭП Электронные пары, окружающие центральный
- 24. Влияние несвязывающей электронной парыУгловая форма Тригональная пирамидаТетраэдр
- 25. Пространственная конфигурация ионовтип молекулы АХ2Е3А –
- 26. Пространственная конфигурация молекул
- 27. Пространственная конфигурация молекул
- 28. Пространственная конфигурация молекул
- 29. Ионная связьЭлектростатическое притяжение между ионами, образованными путем
- 30. Металлическая связьСвязь между положительными ионами в кристаллах
- 31. Большинство металлов образует одну из следующих высокосимметричных
- 32. Типы межмолекулярных взаимодействийМежмолекулярные взаимодействия – электромагнитные взаимодействия
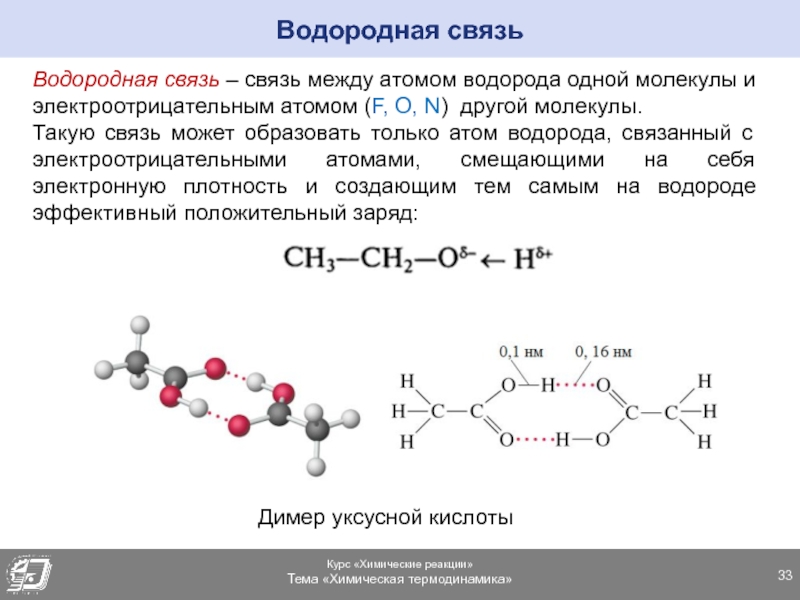
- 33. Водородная связь Димер уксусной кислотыВодородная связь –
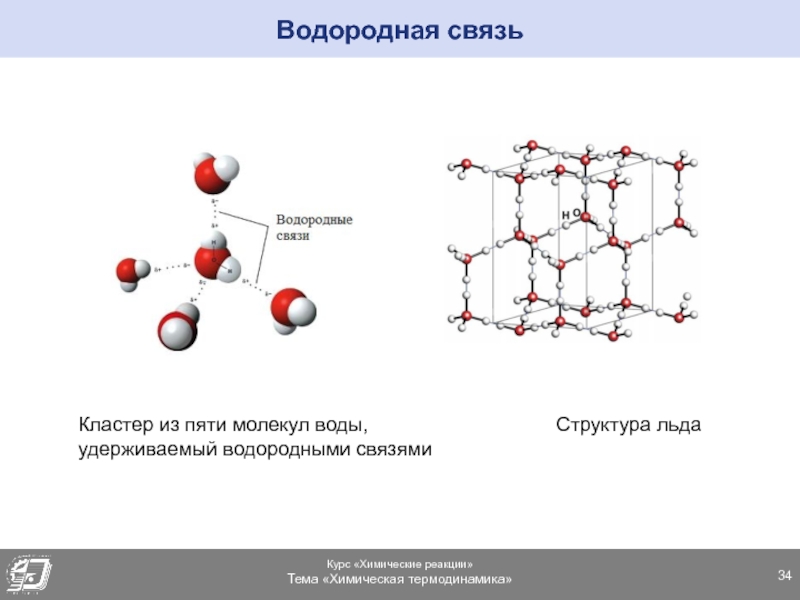
- 34. Водородная связьКластер из пяти молекул воды,
- 35. Влияние водородной связи на физико-химические свойства веществ
- 36. Выводы 1. Химическая связь в молекулах имеет
- 37. Литература 1. Неорганическая химия: В 3 т.
- 38. © ФГБОУ ВПО ИжГТУ имени М.Т. Калашникова, 2013© Семакина Надежда Владимировна, 2013СПАСИБО ЗА ВНИМАНИЕ
- 39. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Тема «Химическая связь и строение вещества»
Ижевск
2013
Кафедра «Химия и химическая технология»
Курс
«Химия»
Слайд 2План лекции
Природа химической связи
Ковалентная связь
Метод валентных связей. Гибридизация атомных
орбиталей
Метод отталкивания валентных электронных пар (ОВЭП)
Ионная связь
Металлическая связь
Типы межмолекулярных взаимодействий
Слайд 3Природа химической связи
Химическая связь имеет электростатическую природу, т.е. основана на
электростатическом взаимодействии всех ядер и электронов, принадлежащих молекуле.
Изменение энергии системы
из двух атомов водорода в зависимости от расстояния
Длина связи – расстояние между атомами в молекуле (r0), при котором система имеет наименьшую энергию (E0) .
Энергия связи (E0, кДж/моль) – энергия, соответствующая r0, характеризует прочность химической связи и реакционную способность вещества.
Атомы образуют молекулу, поскольку при сближении атомов общая энергия системы уменьшается.
Слайд 5Молекула
По ИЮПАК, это – электронейтральная
частица, состоящая из более, чем
одного
атома.
Строгое определение: на поверхности потенциальной энергии должен быть минимум, в
котором есть хотя бы одно колебательное состояние (устойчивость).Слайд 8Ковалентная связь
Метод валентных связей (МВС):
Связь образуется при перекрывании электронных орбиталей
двух атомов и объединении двух электронов – возникает двухэлектронная, двухцентровая
связь.Обменный механизм
Н Н Н2
Донорно-акцепторный
механизм
Электронная структура Льюиса
Eсв. = 436 кДж/моль
Слайд 9Аналогично по донорно-акцепторному механизму образуется связь в ионе метиламмония [CH3NH3]+:
Донорно-акцепторная
связь
Метиламин
хлорид метиламмонияСлайд 10Свойства ковалентной связи
Насыщаемость – способность атомов участвовать в образовании
ограниченного числа ковалентных связей.
В следствие насыщаемости связи молекулы имеют определенный
состав и существуют в виде дискретных частиц с определенной структурой.донор акцептор
Молекула NH3
не насыщена
NH4+
Частица насыщена
Слайд 11Свойства ковалентной связи
Поляризуемость – это мера смещения зарядов
в молекуле в электрическом поле заданной напряженности.
Схема
электрического
диполя
1D
(Дебай) = 3,33 . 10-30 Кл . мковалентная неполярная связь (Н2, N2, O2, Cl2)
ковалентная полярная связь (HCl, H2O, HF, CCl4)
ионная связь (ZnS, CaF2, NaCl)
Мера полярности связи – электрический момент диполя:
Разность электроотрицательности атомов характеризует полярность связи:
Слайд 13Симметрия орбиталей
По способу перекрывания электронных облаков различают с- и к-ковалентные
связи.
Слайд 14Направленность связей
Определяет геометрическое строение молекулы.
Метод гибридизации :
При образовании молекулы
вместо исходных атомных s,p.d- орбиталей центрального атома образуются равноценные гибридные
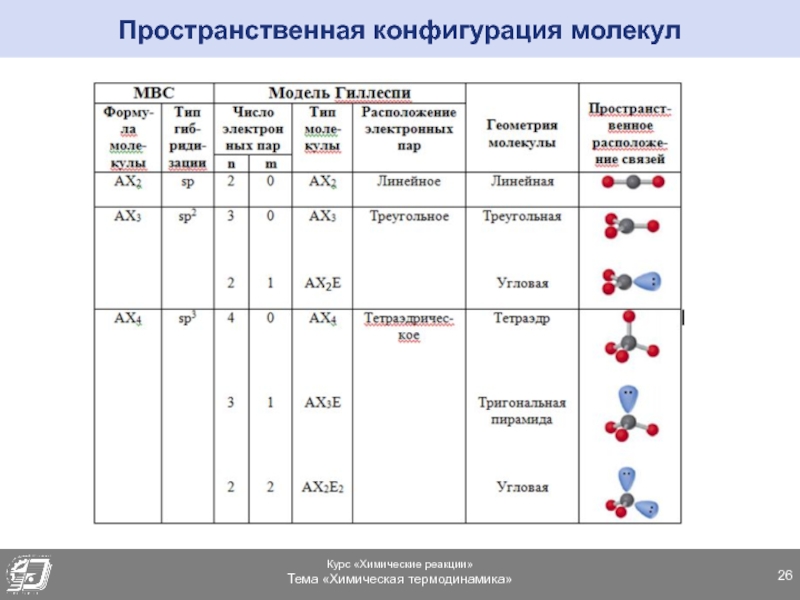
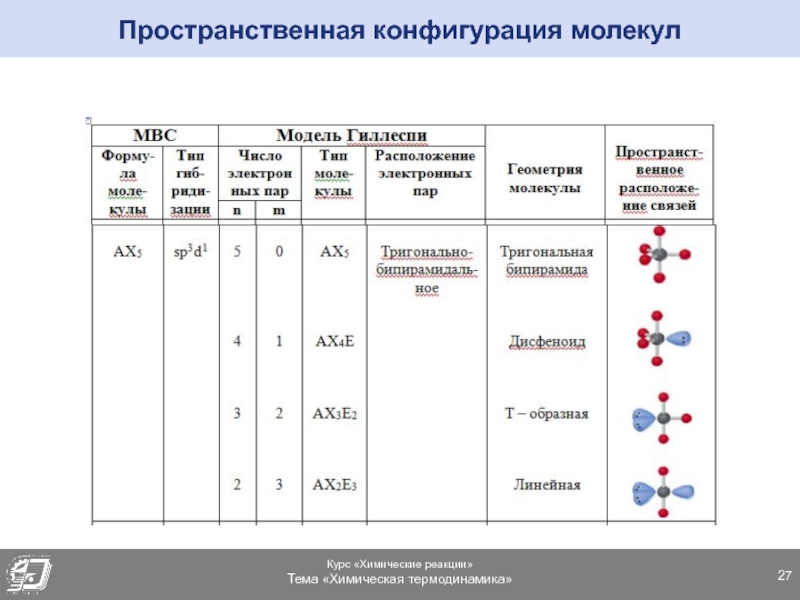
электронные облака.Метод отталкивания валентных электронных пар (ОВЭП) (модель Гиллеспи, 1957 г.):
Связь осуществляется за счет пары электронов, а геометрическое строение молекул и ионов определяется общим числом электронных пар, окружающих центральный атом.
Слайд 15Модель гибридизация орбиталей
Смешение орбиталей центрального атома по энергии и форме
BeF2
Ве
1s22s2
Ве* 1s22s12p1
F 1s22s22p5
Структура молекулы – линейная
Слайд 21Влияние несвязывающей электронной пары
Перекрывание валентных орбиталей в молекулах
С
N
O
sp3
sp3 sp3
Слайд 22Делокализованная -связь
lC – O = 0,129 нм
Геометрическая
форма иона – треугольная
[СO3]2-
С
sp2- гибридизация
Слайд 23Метод ОВЭП
Электронные пары, окружающие центральный атом, должны принимать
пространственное положение, сводящее к минимуму их взаимное отталкивание
Связывающая электронная
пара (локализованная между двумя атомами) занимает меньше места, чем несвязывающаяНаиболее сильным является отталкивание между неподеленными парами, меньше отталкивание между неподеленной и связывающей парами электронов и минимальное отталкивание – между связывающими электронными парами
Объем, занимаемый связывающей электронной парой, тем меньше, чем больше электроотрицательность атома, связанного с центральным
Слайд 24Влияние несвязывающей электронной пары
Угловая форма
Тригональная пирамида
Тетраэдр
АХ4
АХ3Е1 АХ2Е2
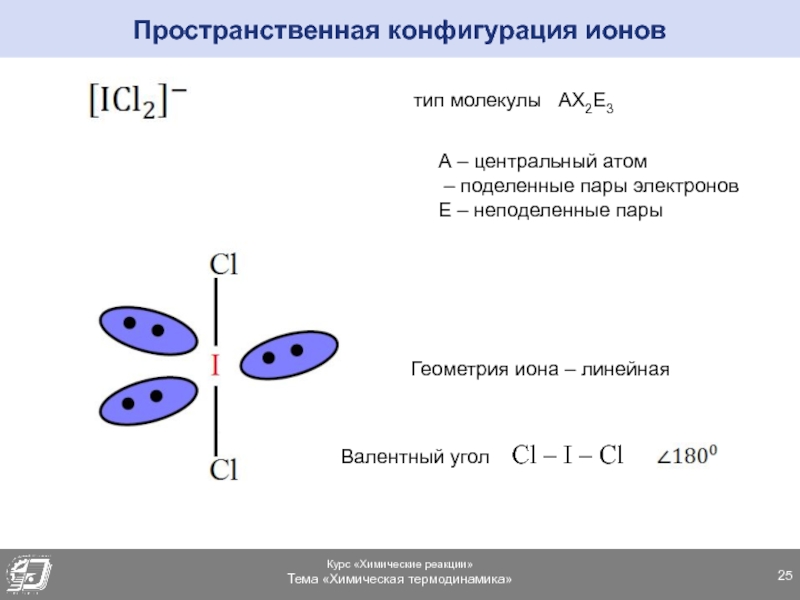
Слайд 25Пространственная конфигурация ионов
тип молекулы АХ2Е3
А – центральный атом
–
поделенные пары электронов
Е – неподеленные пары
Геометрия иона – линейная
Валентный
угол Cl – I – Cl Слайд 29Ионная связь
Электростатическое притяжение между ионами, образованными путем полного смещения электронной
пары к более электроотрицательному атому.
Ненаправленность
Ненасыщаемость
tпл(NaCl) = 8000С
tкип(NaCl) =
14540С ZnS
CaF2
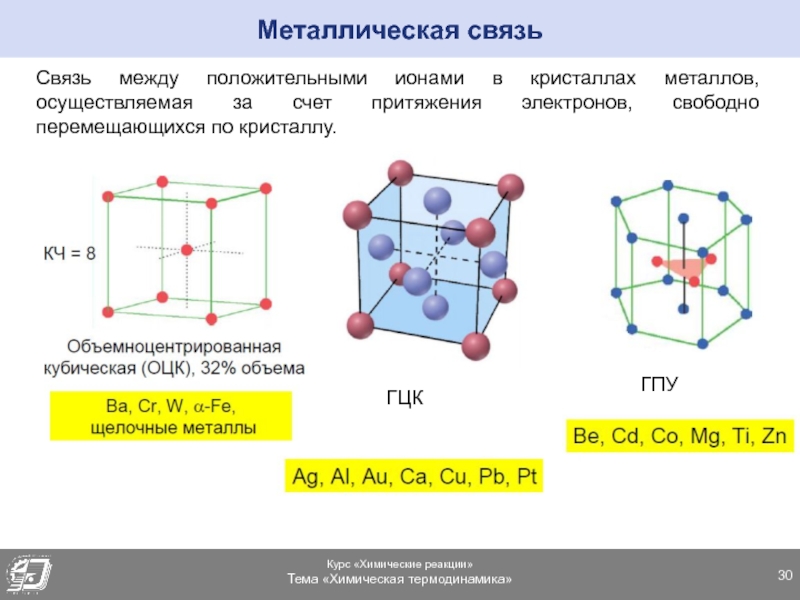
Слайд 30Металлическая связь
Связь между положительными ионами в кристаллах металлов, осуществляемая за
счет притяжения электронов, свободно перемещающихся по кристаллу.
ГЦК
ГПУ
Слайд 31Большинство металлов образует одну из следующих высокосимметричных решёток с плотной
упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную.
В кубической
объемно центрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объёма куба. Кубическую объемно центрированную решётку имеют металлы: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др.В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co и др.
В гексагональной решётке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
Характерные кристаллические решетки
Слайд 32Типы межмолекулярных взаимодействий
Межмолекулярные взаимодействия – электромагнитные взаимодействия электронов и ядер
одной молекулы с электронами и ядрами другой.
Слайд 33Водородная связь
Димер уксусной кислоты
Водородная связь – связь между атомом
водорода одной молекулы и электроотрицательным атомом (F, O, N) другой
молекулы.Такую связь может образовать только атом водорода, связанный с электроотрицательными атомами, смещающими на себя электронную плотность и создающим тем самым на водороде эффективный положительный заряд:
Слайд 34Водородная связь
Кластер из пяти молекул воды,
Структура льда
удерживаемый водородными связями
Слайд 36Выводы
1. Химическая связь в молекулах имеет электростатическую природу
2. Три
основных типа химической связи: ковалентная, ионная металлическая
3. Геометрия молекулы определяется
взаимным расположением в пространстве орбиталей атома, образующих химическую связь4. Методы описания конфигурации молекул и ионов:
Метод гибридизации
Метод отталкивания валентных электронных пар (ОВЭП)
Слайд 37Литература
1. Неорганическая химия: В 3 т. / Под ред.
Ю.Д.Третьякова. Т. 1: зико-химические основы неорганической химии: Учебник для студ.
Высш. Учеб. заведений / М.Е.Тамм, Ю.Д.Третьяков; - М.: Издательский центр «Академия», 2004. — 240 с.2. Еремин В.В. Общая и физическая лекция (курс лекций) [2007, PDF, RUS]. http://rutracker.org/forum/viewtopic.php?t=3344654
3. Ахметов Н. С. Общая и неорганическая химия.– М.: Высш. шк.; Академия. 2001. – 743 с.
4. Орбиталь: http://files.school-collection.edu.ru/dlrstore/133a5ccb-734d-9fe6-5026-ffe680109d3d/1011313A.htm
5. Гиллеспи Р., Харгиттари И. Модель отталкивания электронных пар валентной оболочки и строение молекул. – М.: Мир, 1992. – 296 с.







![Тема Химическая связь и строение вещества
Ижевск
2013
Кафедра Химия и Аналогично по донорно-акцепторному механизму образуется связь в ионе метиламмония [CH3NH3]+:Донорно-акцепторная связьМетиламин Аналогично по донорно-акцепторному механизму образуется связь в ионе метиламмония [CH3NH3]+:Донорно-акцепторная связьМетиламин](/img/thumbs/9c6f75e94ea9211f3f9e528f1debebb1-800x.jpg)











![Тема Химическая связь и строение вещества
Ижевск
2013
Кафедра Химия и Делокализованная -связь lC – O = 0,129 нмГеометрическая форма иона – треугольная [СO3]2-Сsp2- гибридизация Делокализованная -связь lC – O = 0,129 нмГеометрическая форма иона – треугольная [СO3]2-Сsp2- гибридизация](/img/thumbs/02c9c8f9ef1f4baded763e4cc24eaf86-800x.jpg)