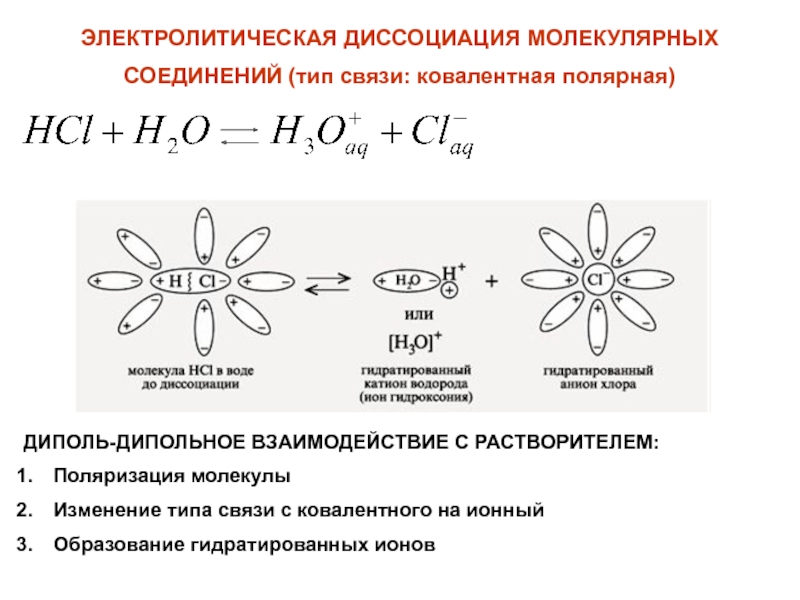
поскольку при этом возрастает энергия движения (кинетическая энергия) молекул и
уменьшается их взаимное притяжение.
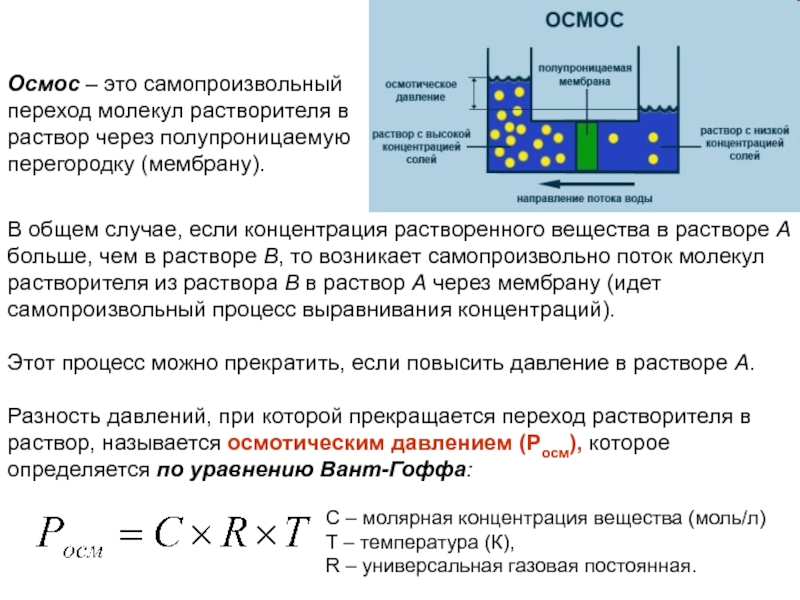
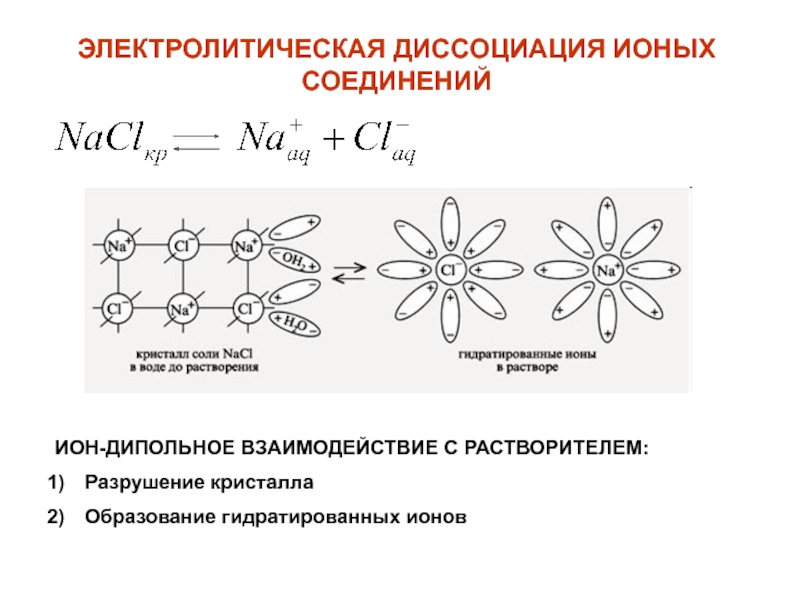
2.Изменение давления мало влияет на растворимость жидкостей и твердых веществ, так как объем при растворении меняется незначительно.
3. При повышении температуры растворимость газов снижается - кинетическая энергия молекул возрастает, они быстрее движутся и легче "вырываются" из растворителя.
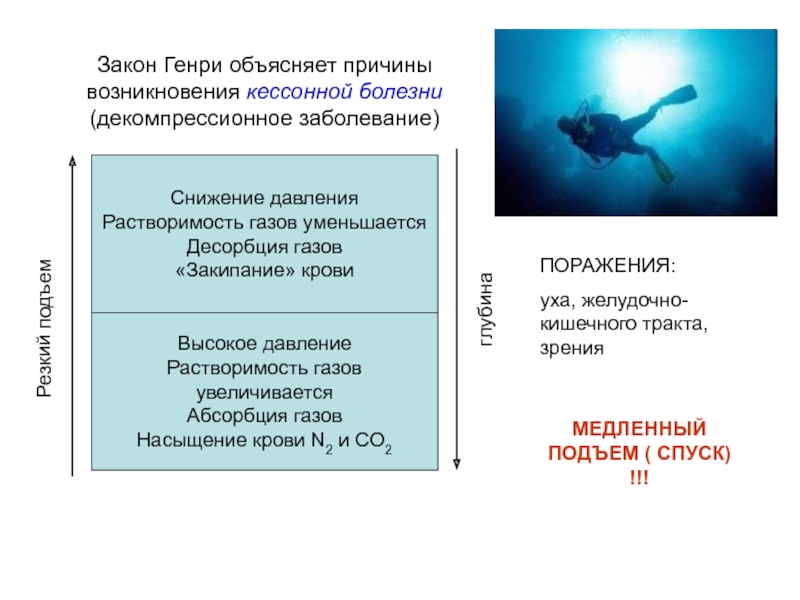
4. Давление влияет на растворимость газов. Газ лучше растворяется при увеличении давления.
Закон У.Генри ( 1803 г.): при постоянной температуре растворимость газа в жидкости прямо пропорциональна его парциальному давлению над раствором
ВЛИЯНИЕ ТЕМПЕРАТУРЫ И ДАВЛЕНИЯ НА РАСТВОРИМОСТЬ
s – массовая концентрация газа в насыщенном растворе
Кн- константа Генри (зависит от природы газа и растворителя)
р - парциальное давление газа