Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Температурная зависимость скорости химической реакции 1. Правило Вант-Гоффа
Содержание
- 1. Температурная зависимость скорости химической реакции 1. Правило Вант-Гоффа
- 2. Теория активных столкновенийВ теории активных столкновений считается,
- 3. Теория активированного комплекса (АК) или теория переходного
- 4. Поверхность потенциальной энергии для взаимодействия H2 +
- 5. Поверхность потенциальной энергии для взаимодействия H2 + F = HF + H (2D – модель) rH-HrH-F
- 6. Слайд 6
- 7. Энергетическая диаграмма реакции A + B =
- 8. Скачать презентанцию
Теория активных столкновенийВ теории активных столкновений считается, что акт превращения начальных веществ в конечные продукты совершается в момент столкновения активных молекул и протекает мгновенно. При этом молекулы рассматриваются как бесструктурные частицы.
Слайды и текст этой презентации
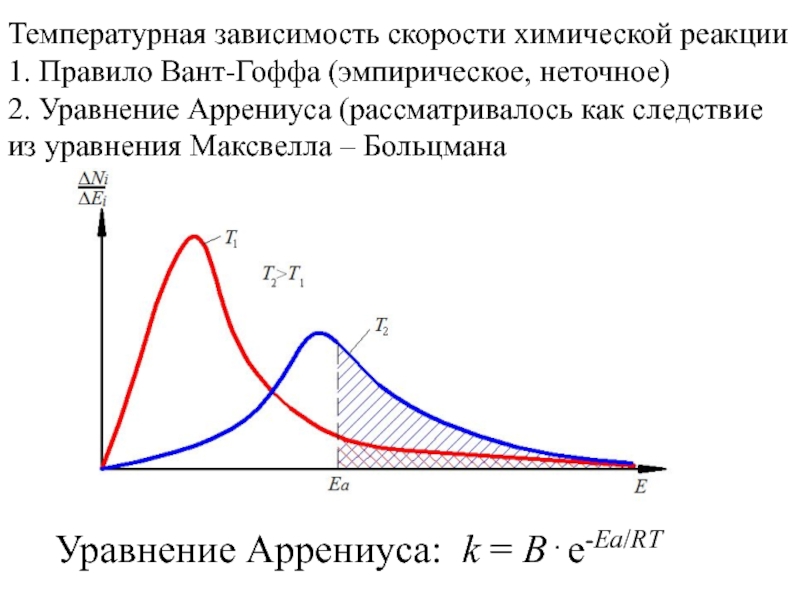
Слайд 1Температурная зависимость скорости химической реакции
1. Правило Вант-Гоффа (эмпирическое, неточное)
2. Уравнение
Аррениуса (рассматривалось как следствие из уравнения Максвелла – Больцмана
k = Be-Ea/RTСлайд 2Теория активных столкновений
В теории активных столкновений считается, что акт превращения
начальных веществ в конечные продукты совершается в момент столкновения активных
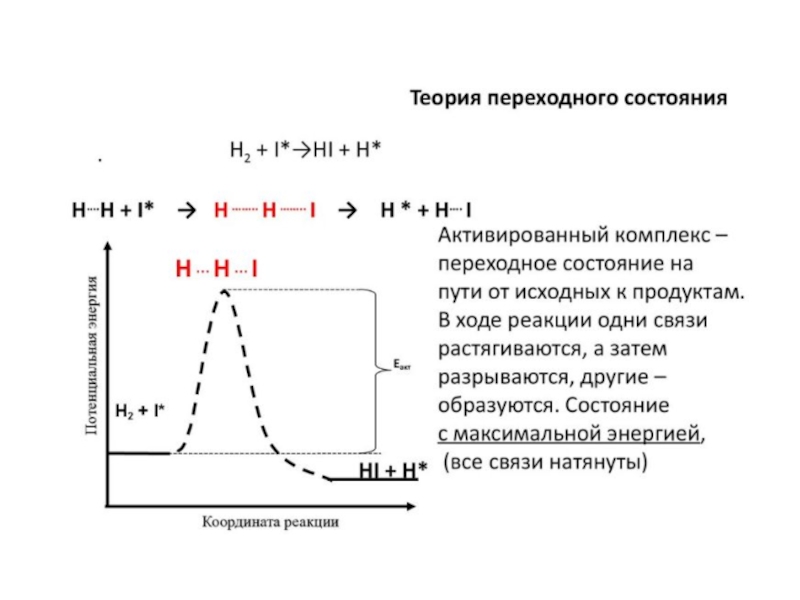
молекул и протекает мгновенно. При этом молекулы рассматриваются как бесструктурные частицы.Слайд 3Теория активированного комплекса (АК) или теория переходного состояния. Основные положения.
1.
Превращение проходит через образование АК – неустойчивую молекулу, отличающуюся по
своему строению от конечных и исходных веществ, и существующую на некотором интервале пространства. Образование АК связано с преодолением энергетического барьера, т.е. АК находится на вершине этого барьера и имеет энергию, равную активации.2. Активированный комплекс находится в равновесии с исходными веществами: A + B ↔ AB#
3. Каждый активированный комплекс переходит в продукты с равными вероятностями перехода АК в прямом и обратном направлениях. Полагают, что половина квазимолекул АК движется в направлении продуктов и половина – в сторону реагентов.
4. Скорость реакции равна скорости распада комплекса, концентрация которого мала. Теория позволяет рассчитывать константу скорости отдельной стадии, а не всего процесса, т.к. АК может быть несколько.
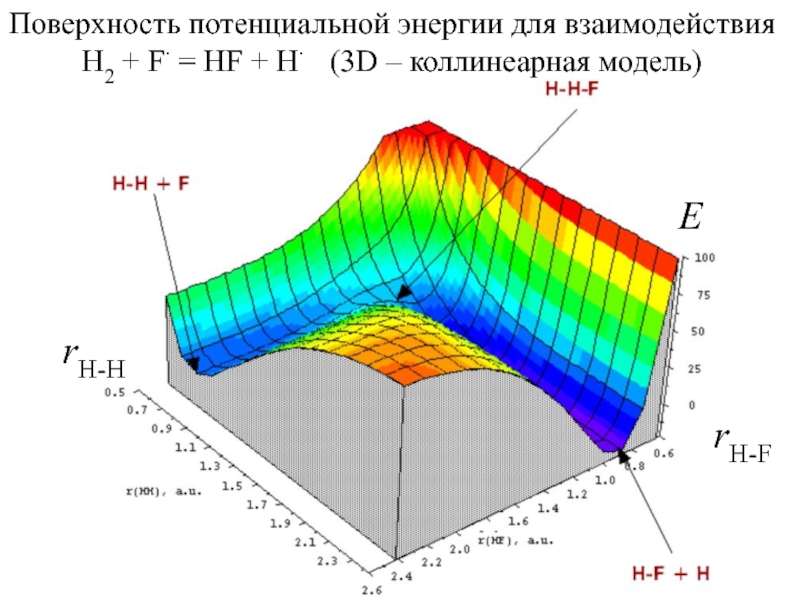
Слайд 4Поверхность потенциальной энергии для взаимодействия H2 + F = HF
+ H (3D – коллинеарная модель)
rH-H
rH-F
E
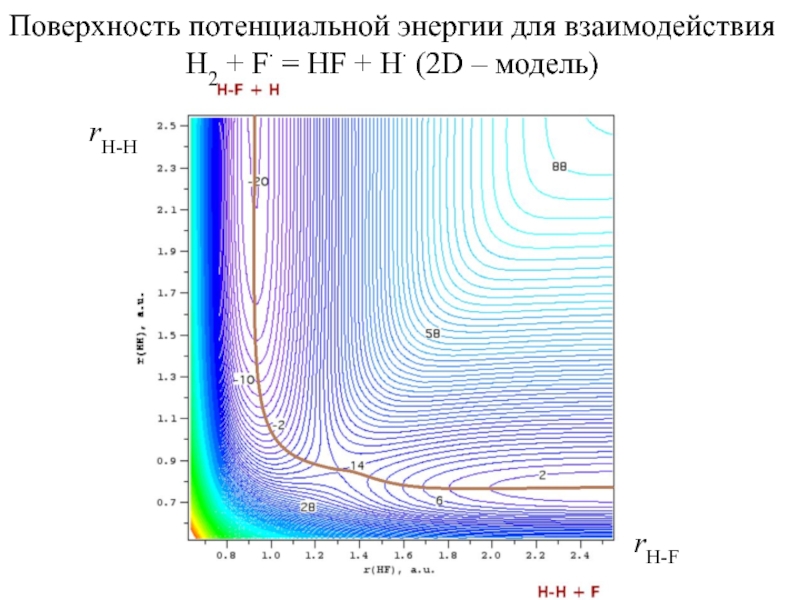
Слайд 5Поверхность потенциальной энергии для взаимодействия H2 + F = HF
+ H (2D – модель)
rH-H
rH-F
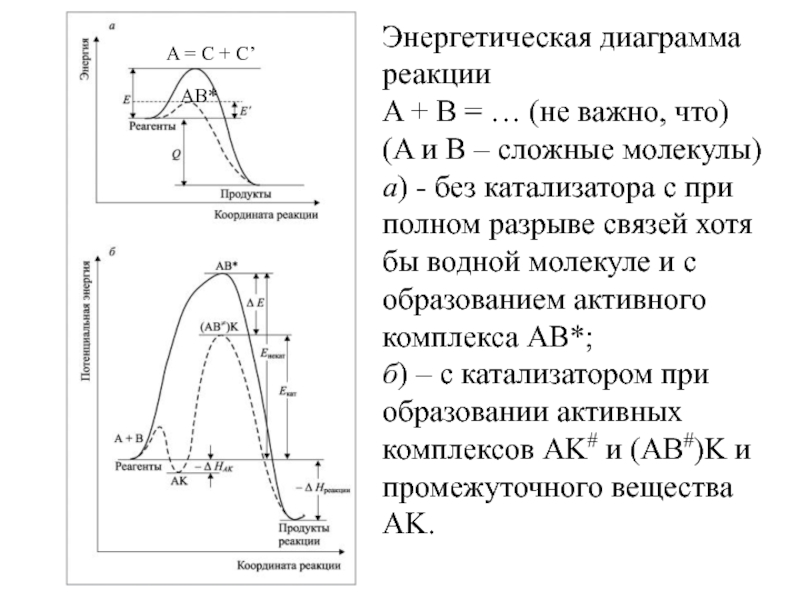
Слайд 7Энергетическая диаграмма реакции
A + B = … (не важно,
что)
(A и B – сложные молекулы)
а) - без катализатора с
при полном разрыве связей хотя бы водной молекуле и с образованием активного комплекса AB*;б) – с катализатором при образовании активных комплексов AK# и (AB#)K и промежуточного вещества AK.
AB*
A = C + C’