Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Теоретическая электрохимия, часть 1
Содержание
- 1. Теоретическая электрохимия, часть 1
- 2. Выход по токуУниверсальность законов Фарадея состоит в
- 3. При этом распределение количества электричества между реакциями
- 4. Поскольку прохождение количества электричества вызывает превращение эквивалентного
- 5. Поскольку масса выделившегося на электроде металла (при
- 6. КулонометрыКулонометры - электрохимические системы, применяемые для определения
- 7. Весовые кулонометры – медный и серебряный. Медный
- 8. Объемный газовый кулонометр Газовый кулонометр представляет собой сосуд
- 9. При электролизе водного раствора щелочи на катоде
- 10. Объем водорода:
- 11. Титрационные кулонометры – йодный и Кистяковского. В
- 12. Кулонометр Кистяковского представляет собой стеклянный сосуд, снабженный
- 13. Практическое значение законов Фарадея1. Расчет толщины покрытия
- 14. Кулонометрические методы делятся на прямые и косвенные.Прямые
- 15. Ток и плотность тока как характеристики скорости
- 16. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Теоретическая электрохимия,
часть 1
Теоретическая электрохимия
Ковязина Людмила Иосифовна,
доцент кафедры ТЭП ВятГУ,
Слайд 2Выход по току
Универсальность законов Фарадея состоит в том, что если
на электроде одновременно протекает несколько реакций, суммарное число прореагировавших эквивалентов
различных веществ соответствует числу Фарадеев пропущенного электричества.Например, при электролизе водных растворов солей никеля осаждение металла сопровождается выделением водорода:
Ni2+ + 2e Ni и H+ + e 1/2 H2.
При прохождении 1F электричества сумма выделившихся эквивалентов никеля и водорода равна 1.
Слайд 3При этом распределение количества электричества между реакциями зависит от условий
электролиза (состава электролита, плотности тока, температуры).
Доля количества электричества, пошедшая на
данную реакцию, называется выходом по току (ВТ). Выход по току выражается в долях единицы или в процентах.где qi – количество электричества, пошедшее на данную реакцию;
Q – общее количество прошедшего электричества.
(6)
Слайд 4Поскольку прохождение количества электричества вызывает превращение эквивалентного количества вещества, то
выход по току можно определить как отношение массы вещества, практически
прореагировавшего на электроде (Δmпр) к массе вещества, которая должна была вступить в электрохимическую реакцию теоретически (Δmтеор) при прохождении того же количества электричества.
Зная ВТ, можно рассчитать массу вещества, которая выделится при электролизе:
(7)
(8)
Слайд 5Поскольку масса выделившегося на электроде металла (при нанесении гальванопокрытий) может
быть рассчитана по формуле:
где: S – площадь электрода;
δ – толщина покрытия;ρ – плотность металла,
то выражение: S δ ρ = Kэ I t ВТ
позволяет рассчитать любую из входящих в него величин, если известны остальные.
Зная ВТ, можно определить парциальную плотность тока, то есть плотность тока каждой из реакции, протекающих на электроде:
iп = i . ВТ
(9)
(10)
(11)
Слайд 6Кулонометры
Кулонометры - электрохимические системы, применяемые для определения количества электричества.
Количество
электричества (Q) можно рассчитать по количеству полученного вещества, если на
электроде протекает одна реакция. Следовательно, в качестве кулонометров используют такие электролизеры, в которых выход по току равен 1 (100%).Известны три типа кулонометров: весовые, объемные и титрационные.
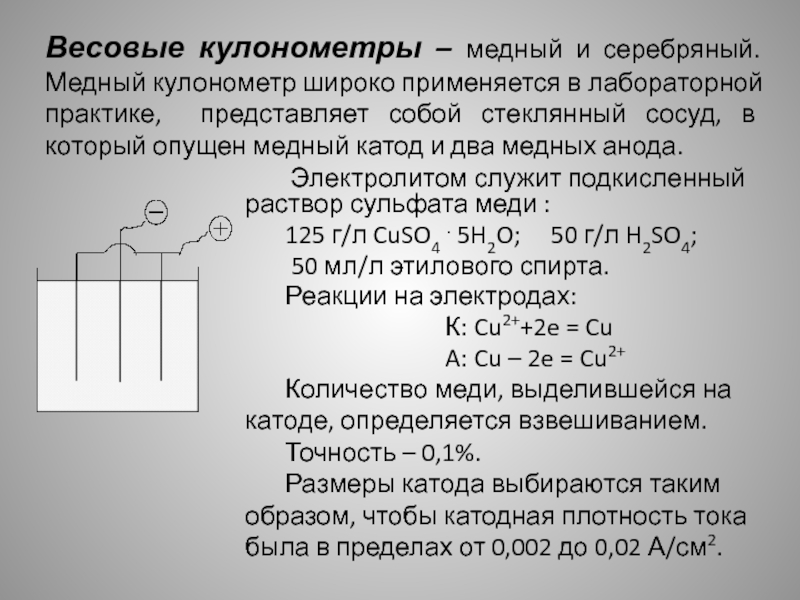
Слайд 7Весовые кулонометры – медный и серебряный. Медный кулонометр широко применяется
в лабораторной практике, представляет собой стеклянный сосуд, в который опущен
медный катод и два медных анода.
Электролитом служит подкисленный раствор сульфата меди :
125 г/л CuSO4 . 5H2O; 50 г/л H2SO4;
50 мл/л этилового спирта.
Реакции на электродах:
К: Cu2++2e = Cu
A: Cu – 2e = Cu2+
Количество меди, выделившейся на катоде, определяется взвешиванием.
Точность – 0,1%.
Размеры катода выбираются таким образом, чтобы катодная плотность тока была в пределах от 0,002 до 0,02 А/см2.
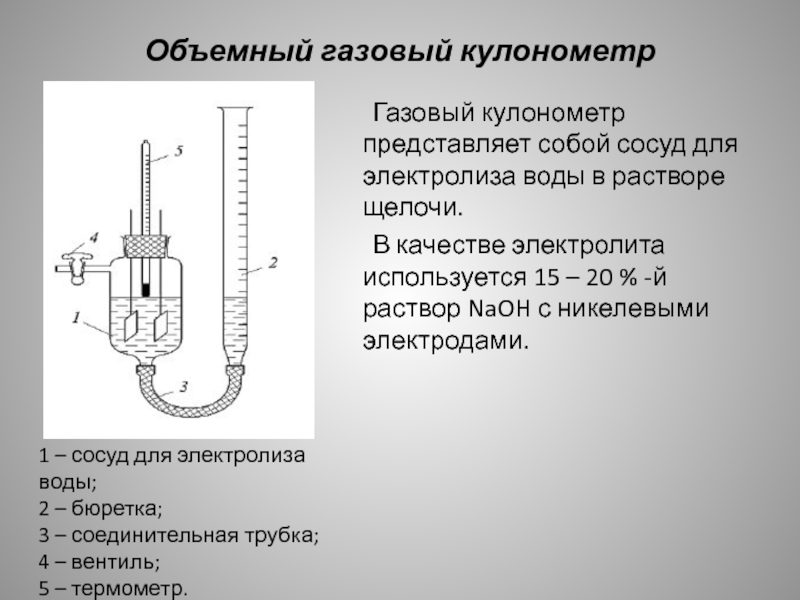
Слайд 8Объемный газовый кулонометр
Газовый кулонометр представляет собой сосуд для электролиза воды
в растворе щелочи.
В качестве электролита используется 15 –
20 % -й раствор NaOH с никелевыми электродами.1 – сосуд для электролиза воды;
2 – бюретка;
3 – соединительная трубка;
4 – вентиль;
5 – термометр.
Слайд 9При электролизе водного раствора щелочи на катоде разряжаются молекулы воды:
2H2O
+ 2e = H2 + 2OH-.
На аноде окисляются ионы гидроксила:
2OH-
- 2e = H2O + ½O2.Суммарная реакция на электродах:
H2O = H2 + ½O2.
Общее количество разложенного электролита определяют измерением объема получающегося гремучего газа.
Точность газовых кулонометров невысока (0,5 – 1 %).
Рабочая плотность тока 30 – 100 мА/см2.
Измеренный объем гремучего газа
V = (2VH2 + 1VO2)
приводят к нормальным условиям (V0), пользуясь уравнением состояния идеального газа:
P0V0/T0 = PV/T (12)
Слайд 10Объем водорода:
VH2 = ⅔ V0
(13)Число молей водорода находят, зная, что 1 моль любого газа при нормальных условиях занимает объем 22,4 л = 0,0224 м3.
n = ⅔ V0 / 0,0224. (14)
В соответствии с уравнением катодной реакции для получения 1 моль водорода надо 2 Фарадея электричества. Тогда количество электричества, прошедшего через газовый кулонометр:
Q = 2 n F (15)
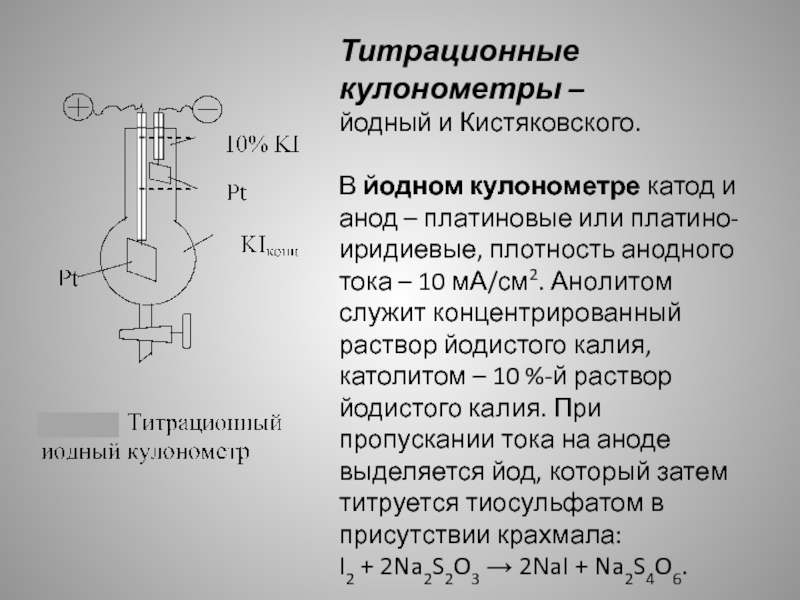
Слайд 11Титрационные
кулонометры –
йодный и Кистяковского.
В йодном кулонометре катод
и анод – платиновые или платино-иридиевые, плотность анодного тока –
10 мА/см2. Анолитом служит концентрированный раствор йодистого калия, католитом – 10 %-й раствор йодистого калия. При пропускании тока на аноде выделяется йод, который затем титруется тиосульфатом в присутствии крахмала:I2 + 2Na2S2O3 → 2NaI + Na2S4O6.
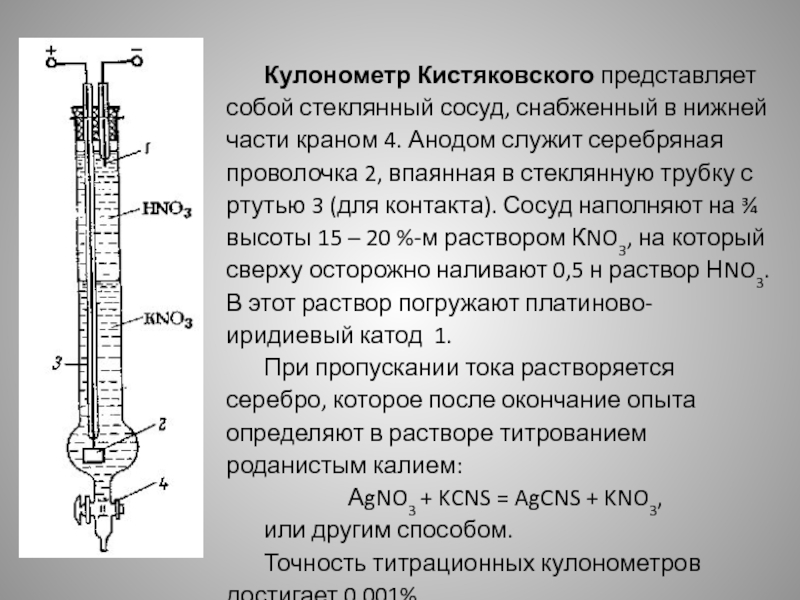
Слайд 12Кулонометр Кистяковского представляет собой стеклянный сосуд, снабженный в нижней части
краном 4. Анодом служит серебряная проволочка 2, впаянная в стеклянную
трубку с ртутью 3 (для контакта). Сосуд наполняют на ¾ высоты 15 – 20 %-м раствором КNO3, на который сверху осторожно наливают 0,5 н раствор НNO3. В этот раствор погружают платиново-иридиевый катод 1.При пропускании тока растворяется серебро, которое после окончание опыта определяют в растворе титрованием роданистым калием:
АgNO3 + KCNS = AgCNS + KNO3,
или другим способом.
Точность титрационных кулонометров достигает 0,001%.
Слайд 13Практическое значение законов Фарадея
1. Расчет толщины покрытия и времени его
нанесения
Δ m = Kэ I t ВТ Δ m = S δ ρ S δ ρ = Kэ I t ВТ
2. Определение выхода по току
3. Методы анализа, основанные на законах Фарадея
а) Электроанализ
При электроанализе проводят электролиз до полного или практически полного выделения данного вещества на электроде и определяют массу осадка.
б) Кулонометрический анализ
Кулонометрический метод анализа позволяет по числу кулонов, израсходованных при электродной реакции, определить количество вещества.
Слайд 14Кулонометрические методы делятся на прямые и косвенные.
Прямые методы те, при
которых исследуемое вещество непосредственно реагирует на электроде: окисляется или восстанавливается.
Косвенная
кулонометрия или кулонометрия с генерацией титрующего компонента – такая кулонометрия, при которой на электроде образуется (т.е. генерируется) то вещество, которое затем окисляет или восстанавливает исследуемый компонент. Например, непосредственное электрохимическое окисление тиосульфата идет с невысоким выходом по току.
2S2O32- - 2e = S4O62-
Если в исследуемый раствор тиосульфата добавить раствор йодистого калия, а затем провести электролиз при постоянном потенциале, то первичной прямой реакцией будет
2J- - 2e = J2,
а затем 2S2O32- + J2 = S4O62- + 2J-.
Точность определения 0,1-0,3% при концентрации 10-5 г-экв/л.
Слайд 15Ток и плотность тока как характеристики скорости электрохимической реакции
По закону Фарадея
Скорость электрохимического процесса пропорциональна
току. Так как электрохимическая реакция протекает на границе проводник первого рода – проводник второго рода, то при сравнении скоростей двух электрохимических реакций надо брать одинаковые площади электродов, т.е. проводить сравнение плотностей тока. Таким образом, мера скорости электрохимической реакции - плотность тока .Скорость электрохимических реакций как и скорость химических реакций определяется изменением количества вещества в единицу времени.