Слайд 1Термодинамика — наука, изучающая взаимные превращения различных видов энергии, связанные
с переходом энергии в форме теплоты и работы.
Термодинамика позволяет:
1) рассчитать
тепловые эффекты различных процессов;
2) предсказывать, возможен ли процесс;
3) указывать, в каких условиях он будет протекать;
4) рассматривать условия химических и фазовых равновесий.
Слайд 2термины и понятия.
Система — это совокупность материальных объектов, отделённых от окружающей
среды.
Окружающая среда — остальная часть пространства. Изолированная система не обменивается
с окружающей средой ни массой, ни энергией.
Закрытая с — обменивается со средой лишь энергией,
открытая c— обменивается с окружающей средой и массой, и энергией.
Гомогенная с - все её компоненты находятся в одной фазе и нет поверхностей раздела,
Гетерогенная с. , - состоит из нескольких фаз.
Фаза — часть системы с одинаковыми химическими и термодинамическими свойствами, отделённая поверхностью раздела.
Энергия — количественная мера определённого вида движения материи.
Слайд 3
Термодинамическими параметры :
экстенсивные параметры (объём, масса) и
интенсивные параметры (температура,
давление, вязкость, концентрация и т.д.).
Если система изменяет свои параметры, то
в ней происходит термодинамический процесс, если же параметры самопроизвольно не изменяются, состояние системы называется равновесным.
различают процессы,
- происходящие при постоянном объёме — изохорные, - при постоянном давлении — изобарные
- при постоянной температуре — изотермические.
Слайд 4Термодинамические функции состояния –
функции, зависящие от состояния системы, а не
от пути и способа, которым это состояние достигнуто. Это:
внутренняя
энергия (U),
энтальпия (Н),
энтропия (S) и
свободную энергия Гиббса (G).
свободную энергию Гельмгольца F
Слайд 5U – внутренняя энергия – сумма потенциальной энергии взаимодействия всех
частиц в системе и кинетической энергии их движения.
Экспериментально можно
определить только ∆U при взаимодействии с окружающей средой.
Слайд 6S – энтропия -мера неупорядоченности в системе, т. е. неоднородности
расположения и движения частиц.
Энтропия измеряется в Дж/моль∙К и рассчитывается
по уравнению Больцмана:
S=k∙lnW; k - постоянная Больцмана.
W – термодинамическая вероятность, т. е. число микросостояний, которыми может быть осуществлено данное макросостояние.
Величину S можно рассчитать
для простых, сложных веществ и химических процессов. Обычно это делается при стандартных условиях и значения S0 для простых и сложных веществ приводятся в справочниках.
Для химических реакций справедливо:
Δ S0 р-ии = ΣΔ S0i (продуктов) - ΣΔ S0i (исходных веществ).
Слайд 7
Н – энтальпия – теплосодержание системы.
Изменение энтальпии
(ΔН) – это тепловой эффект реакции при р = const.
QР
= -Δ Н.
Изменение энтальпии при стандартных условиях - Δ Но.
Для простых веществ Δ Но = 0;
Cтандартная энтальпия образования сложного вещества – это изменение энтальпии при получении 1 моль этого вещества из простых веществ (это величины табличные, единицы измерения кДж/моль).
Для определения Δ Но реакции справедливо:
Δ Н0 р-ии = Σ Δ Н0i (продуктов) - Σ Δ Н0i (исходных веществ).
Слайд 8G - энергия Гиббса – (изобарно-изотермический потенциал) –
мера устойчивости системы
при р = const, Т = const.
Она учитывает совместное
влияние энтальпийного фактора (стремление системы к минимуму энергии) и энтропийного фактора (стремление системы к беспорядку)
ее изменение -∆G° рассчитывается в кДж/моль по формуле:
ΔG° = Δ Н0 - ТΔS0 :
для простых веществ ΔG° = 0,
для индивидуальных веществ ΔG° табличные данные;
ΔG 0 р-ии = Σ ΔG 0i (прод.) - Σ ΔG 0i (исх. В-в).
Слайд 9F – энергия Гельмгольца
(изохорно - изотермический потенциал)
ΔF°=∆U°-T∆S°
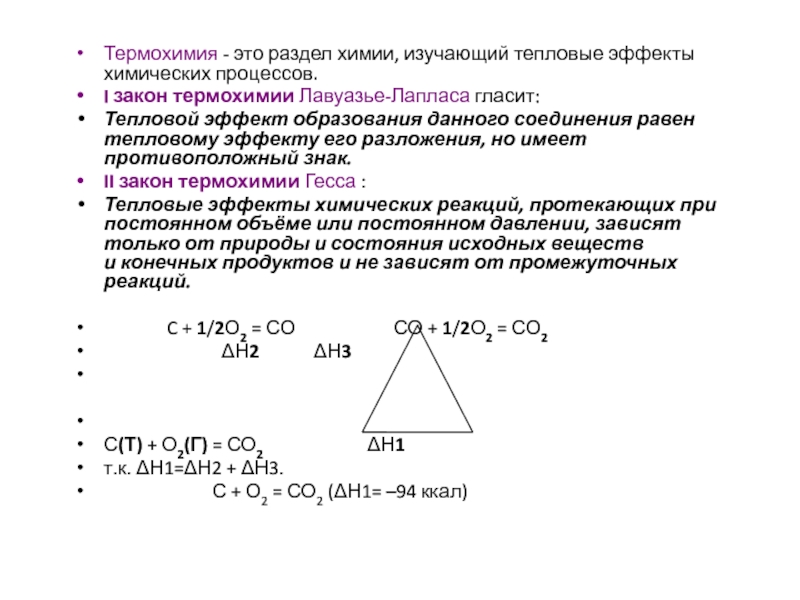
Слайд 10Термохимия - это раздел химии, изучающий тепловые эффекты химических процессов.
I
закон термохимии Лавуазье-Лапласа гласит:
Тепловой эффект образования данного соединения равен тепловому
эффекту его разложения, но имеет противоположный знак.
II закон термохимии Гесса :
Тепловые эффекты химических реакций, протекающих при постоянном объёме или постоянном давлении, зависят только от природы и состояния исходных веществ и конечных продуктов и не зависят от промежуточных реакций.
C + 1/2О2 = СО СО + 1/2О2 = СО2
Н2 Н3
С(Т) + О2(Г) = СО2 Н1
т.к. Н1=Н2 + Н3.
С + О2 = СО2 (Н1= –94 ккал)
Слайд 11Из закона Гесса вытекают 2 следствия:
1 следствие: тепловой эффект реакции
равен разности между суммой теплот образования продуктов реакции (Н˚прод.) и
суммой теплот образования исходных веществ (Н˚исх.в-в), взятых с соответствующими стехиометрическими коэффициентами.
Математическое выражение этого следствия:
Н˚ = Н˚прод. – Н˚исх.в-в
2 следствие: тепловой эффект реакции равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции, взятых с учётом стехиометрических коэффициентов.
Слайд 12Первый закон термодинамики является следствием закона сохранения энергии: разные формы
энергии переходят друг в друга в строго эквивалентных количествах.
В зависимости
от типа системы закон имеет различные формулировки.
Для изолированных систем: внутренняя энергия т.с. постоянна (∆U=0).
Для закрытых систем: сообщаемая системе теплота расходуется на увеличение внутренней энергии и совершение работы против внешних сил: т. е. Q=∆U+A=∆U+P∆V.
В изохорном процессе (V= const) A=0, тогда QV =∆U (тепло расходуется только на изменение внутренней энергии).
В изобарном процессе (р=const).
Qp= ∆U+P∆V = (U2-U1) + (РU2-РU1) = U2 - U1 + PV2-PV1 = (U2+PV2) - (U1+ PV1) = = H2 - H1 = ∆H ; QР=∆H, т.е
тепло расходуется только на изменение энтальпии, причем если тепло поглощается (-Q) энтальпия увеличивается:
т.е Q=-∆H.
В открытых биологических системах теплота отдаётся во внешнюю среду, а работа совершается за счёт убыли внутренней энергии:
Q=∆U-A
Слайд 13 Второй закон термодинамики определяет направленность и пределы протекания процессов
Самопроизвольным является процесс, который совершается без затраты работы извне.
В
изолированных системах самопроизвольно могут совершаться только такие необратимые процессы, при которых энтропия системы растет (∆S>0).
Для других систем в изобарно-изотермических условиях самопроизвольно могут протекать только такие процессы, в результате которых ∆G<0.
Реакции, для которых ∆G<0 называются экзергонические, ∆G>0 – эндергонические.
В организме человека протекают и эндергонические реакции, но обязательным условием этого является их сопряжение с экзергоническими реакциями. Это возможно если обе реакции имеют какое-либо общее промежуточное соединение.
Слайд 14Химическое равновесие.
С точки зрения обратимости химические реакции бывают:
необратимые - идут
в одном направлении до полного израсходования одного из реагирующих веществ.
обратимые
– одновременно могут протекать две взаимно противоположные реакции.
Обратимые реакции заканчиваются наступлением химического равновесия, когда Vпр = Vобр и G→min (значит ∆G→0); концентрации называются равновесными и сохраняются неизменными.
Особенности состояния химического равновесия:
оно динамическое; прямая и обратная реакции не прекращаются, а протекают с равными скоростями.
равновесие подвижно, т.е. при изменении внешних условий происходит смещение равновесия (ускорение одной из реакций) и наступление нового равновесия при других равновесных концентрациях в соответствии с принципом Ле-Шателье:
если на систему, находящуюся в состоянии химического равновесия подействовать изменением внешних факторов (P,C,T), то в системе усилится тот процесс, который препятствует этому воздействию.
Слайд 15Для гомогенной реакции: аА + вВ ↔ сС + dD
константа равновесия имеет вид:
Kp=[C]c∙[D]d / [A]a∙[B]b;
Кр зависит от природы веществ
и температуры (для экзотермического процесса при понижении температуры Кр увеличивается; для эндотермического – уменьшается) и не зависит от концентраций. По величине Кр можно судить о направлении и глубине процесса в данных условиях.
lgКр=-ΔG0 / 2,3RT
Если Кр>1 равновесие смещено вправо (ΔG0р-ции<0).
Если Кр<1 равновесие смещено влево (ΔG0>0)
Если Кр=1 система находится в состоянии равновесия (ΔG0=0).
Слайд 16Применение законов термодинамики к живым системам
Теплота, выделяющаяся из организма, равна
теплоте, найденной путём подсчёта по окислению веществ,
т.е. I закон
применим к жизненным процессам.
Долгое время считалось, что II закон термодинамики неприменим к живым системам. Необходимо учитывать:
Биологические системы обмениваются со средой энергией и массой.
Процессы в живых организмах в конечном счёте необратимы.
Живые системы не находятся в равновесном состоянии.
Все биологические системы гетерогенны, многофазны.
В живом организме (открытая система) вместо термодинамического равновесия наступает стационарное состояние, которое характеризуется не равенством прямого и обратного процессов, а постоянством скорости химических изменений и отводом метаболитов.
Слайд 17Стационарное состояние и равновесие отличаются тем, что энтропия закрытой системы
при равновесии достигает максимума, а в открытой системе при стационарном
состоянии энтропия находится на постоянном, но отличающемся от максимума уровне.
При равновесии изменения свободной энергии не происходит, а в стационарном состоянии свободная энергия изменяется непрерывно, но с постоянной скоростью.
При стационарном состоянии скорость реакции в одном направлении закономерно больше, чем в другом, и разность скоростей постоянна во времени.
Живые системы избегают смертного приговора второго закона термодинамики благодаря тому, что они непрерывно обмениваются с окружающей средой как энергией, так и веществом.
Слайд 18…….
В 1946-1960 гг. И.Пригожин При отклонении системы от стационарного состояния
в ней наступают внутренние изменения, которые будут стремиться приблизить систему
к стационарному состоянию.
dS=dSl +dSi
dSl 0 внутри организма
dSi 0 изменение при связи с внешней средой
/dSl/ / dSi /
2 формулировка з-на: Стационарное состояние ЖО соответсвет минимальный прирост энтропии: dS→ min
Слайд 19Кислоты — жёсткие: H+, Li+, Na+, K+, Mn2+, Cr3+, Fe3+,
Co3+, Mg2+, Ca2+;
мягкие: Cu+, Ag+, Au+, Pt2+, Pt4+, Hg2+, Cd2+.
Основания
— жёсткие: H2O, OH–, NH3, RNH2, Cl–, PO43–, SO42–;
мягкие: SCN–, R1S–, R2S, H–, S2O3 2–, SH.
правило:
Устойчивые комплексы образуются между жёсткой кислотой и жёстким основанием или между мягкой кислотой и мягким основанием.













![Термодинамика — наука, изучающая взаимные превращения различных видов энергии, Для гомогенной реакции: аА + вВ ↔ сС + dD константа Для гомогенной реакции: аА + вВ ↔ сС + dD константа равновесия имеет вид:Kp=[C]c∙[D]d / [A]a∙[B]b;Кр зависит](/img/thumbs/7e43ad10d9ff0f18cb20df686d7c48bf-800x.jpg)























