Слайд 2 Наибольшим КПД при заданных температурах нагревателя T1 и холодильника T2
обладает тепловой двигатель, где рабочее тело расширяется и сжимается по
циклу Карно график которого состоит из двух изотерм и двух адиабат.
Теплоёмкости в адиабатическом и изотермическом процессах не зависят от рабочего тела, поэтому их рассмотрение позволяет выявить ряд общих закономерностей
Слайд 4Николя́ Леона́р Сади́ Карно́ (Nicolas Léonard Sadi Carnot; 1796 - 1832) — французский
физик и математик. В 1824 г. вышла первая и единственная
работа Сади Карно — «Размышления о движущей силе огня и о машинах, способных развивать эту силу».
В ней был произведен анализ существующих в то время паровых машин, и были выведены условия, при которых КПД достигает максимального значения (в паровых машинах того времени КПД не превышал 2 %). Помимо этого там же были введены основные понятия термодинамики: идеальная тепловая машина, идеальный цикл, обратимость и необратимость термодинамических процессов.
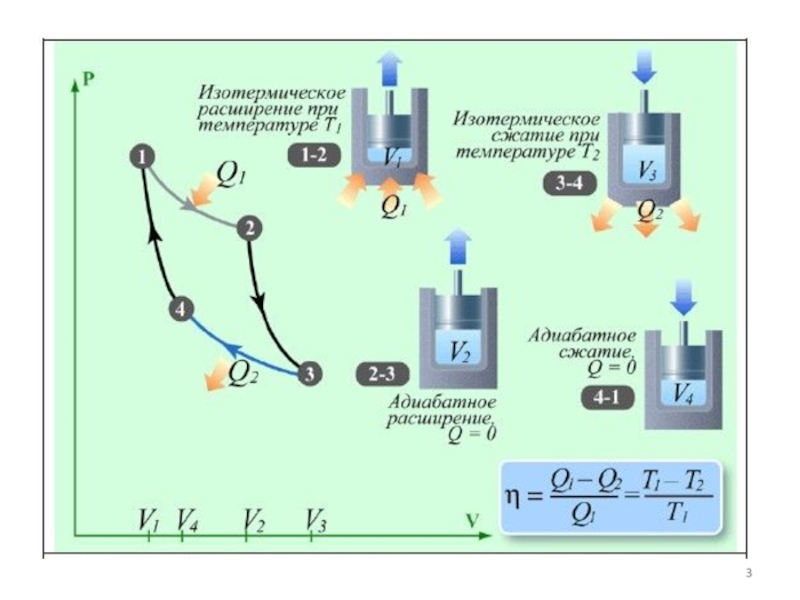
Слайд 5Любая тепловая машина работает по принципу кругового (циклического) процесса, т.е.
возвращается в исходное состояние.
Полезная работа равна разности работ расширения и
сжатия, т.е. равна площади, ограниченной замкнутой кривой.
Обязательными частями тепловой машины являются нагреватель (источник энергии), холодильник и рабочее тело (газ, пар).
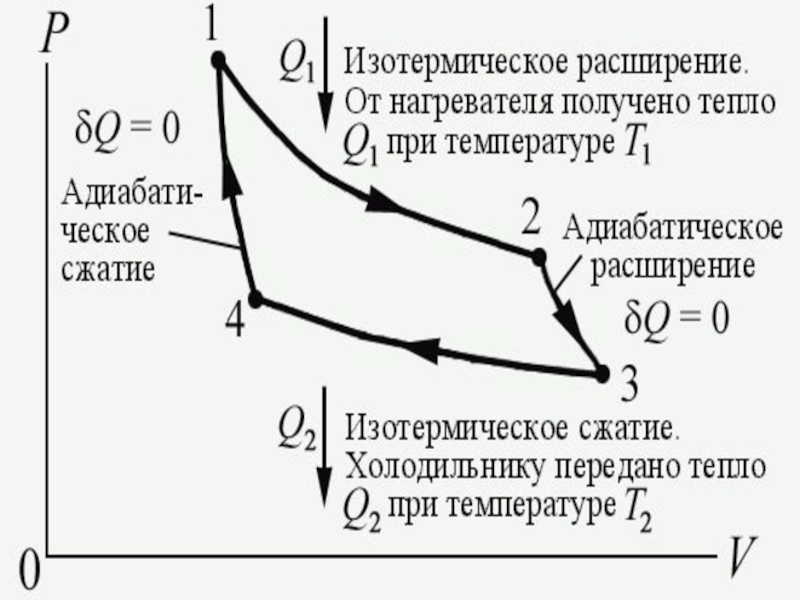
Слайд 6Цикл Карно
Первая теорема Карно: Коэффициент полезного действия тепловой машины, работающей
по циклу Карно, зависит только от температур нагревателя и холодильника
и не зависит от устройства машины и типа рабочего тела
Слайд 7Для повышения КПД надо повышать температуру нагревателя и понижать температуру
холодильника
=(Q1-Q2)/Q1=(T1-T2)/T1 Q1/T1=Q2/T2
Величина Q/T называется приведённой теплотой
Слайд 8Вторая теорема Карно: КПД любого цикла не может быть больше,
чем КПД цикла Карно - =1-Т2/Т1, где под Т1 понимается
максимальная, а под Т2 минимальная температура
Слайд 9На всех стадиях кругового процесса - цикла Карно - нигде
не допускается соприкосновенность тел с разной температурой, т.е. нет необратимых
процессов теплопроводности. Весь цикл проводится обратимо (бесконечно медленно).
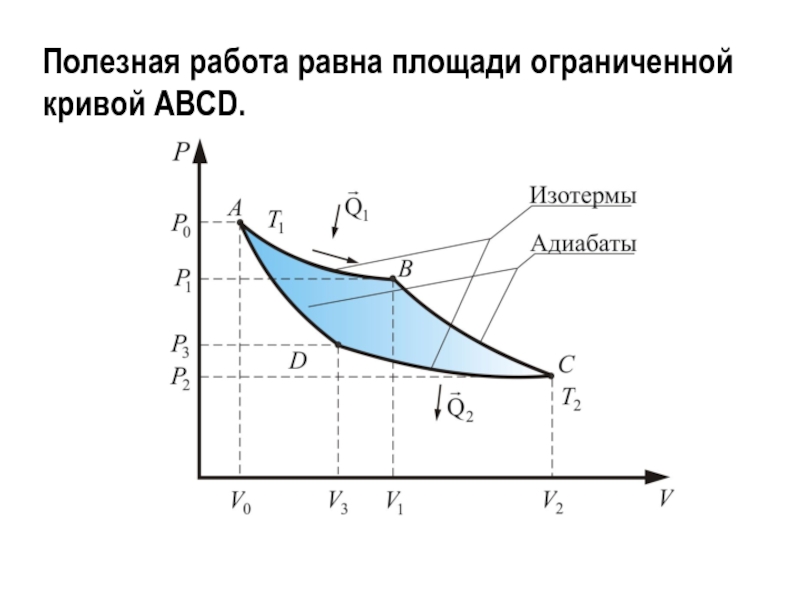
Слайд 10Полезная работа равна площади ограниченной кривой ABCD.
Слайд 11А = А1 + А2 + А3 + А4
Работа совершаемая
газом больше работы внешних сил
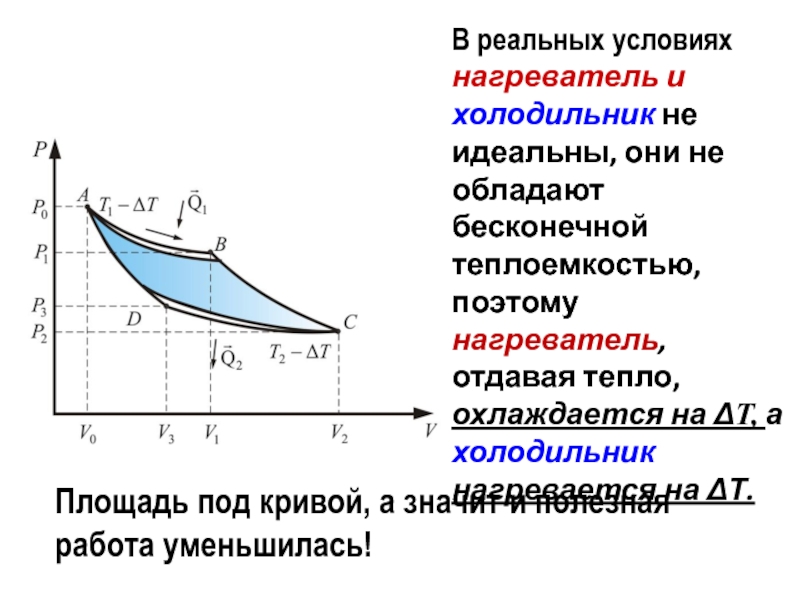
Слайд 12В реальных условиях нагреватель и холодильник не идеальны, они не
обладают бесконечной теплоемкостью, поэтому нагреватель, отдавая тепло, охлаждается на ΔT,
а холодильник нагревается на ΔТ.
Площадь под кривой, а значит и полезная работа уменьшилась!
Слайд 13 Для обратимого цикла Карно
Для необратимого цикла
Всегда
– этот вывод справедлив независимо от причин необратимости цикла Карно.
Слайд 14 Холодильная машина, работает по обратному циклу Карно.
Если проводить цикл в
обратном направлении, тепло будет забираться у холодильника и передаваться нагревателю
(за счет работы внешних сил).
Слайд 15В этом цикле работа, совершаемая над газом – отрицательна, т.е.
Если рабочее тело совершает обратный цикл, то при этом можно переносить энергию в форме тепла от холодного тела к горячему за счет совершения внешними силами работы.
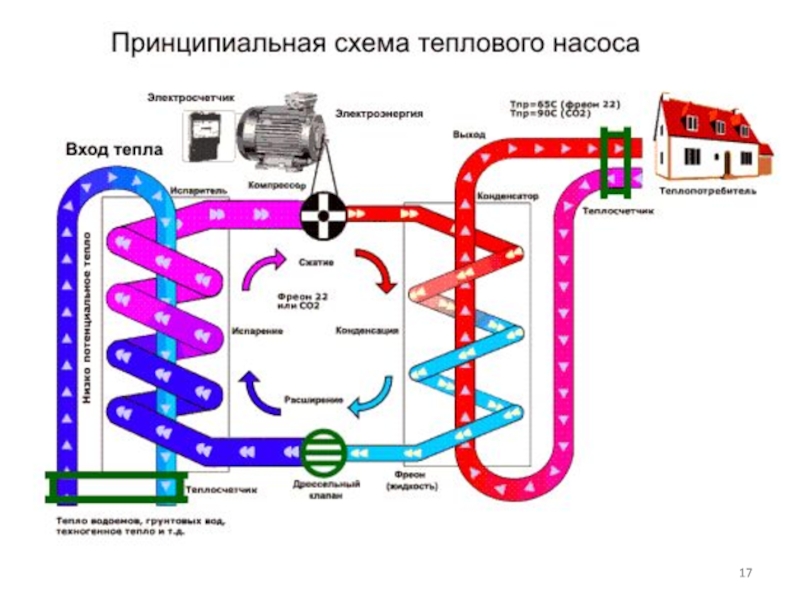
Слайд 18 В основу работы «Теплового насоса» взят ЦИКЛ КАРНО (по такому
же принципу работает холодильник у Вас дома).
Тепловой насос имеет
два теплообменника: горячий (совмещен с контуром отопления и ГВС), и холодный (совмещен с внешним контуром).
В них происходит следующее:
Слайд 19а) фреон (хладоагент в холодильнике и «Тепловом насосе»), циркулирующий в «Тепловом
насосе», под действием компрессора сжимается, и его температура повышается до
температур, в десятки раз превышающие начальную (в холодильнике – решетка радиатор, расположена, в основном, в задней части) – температуру в свободном состоянии. В сжатом состоянии фреон попадает в первый теплообменник и передает тепло контуру отопления и ГВС.
Слайд 20б) пройдя через теплообменник и передав часть теплоты нагревающему контуру отопления,
фреон встречает на своем пути препятствие – дроссельный вентиль (распылитель). Именно он не
позволяет фреону беспрепятственно двигаться и благодаря ему нагнетается высокое давление и повышается температура рабочей среды «Теплового насоса».
Слайд 21в) проходя через дроссель, фреон распыляется и, попадая в испаритель – зону пониженного давления, приобретает
отрицательные температуры.
г) в таком состоянии фреон попадает во второй теплообменник и передает внешнему
контуру отрицательные температуры, а он, в свою очередь, передает их окружающей среде (воде, воздуху или земле).
д) совершив второй теплообмен, фреон вновь попадает в компрессор – начало нового цикла.
Слайд 22Из рассмотренного цикла Карно видно, что равны между собой отношения
теплот к температурам, при которых они были получены или отданы
в изотермическом процессе:
Слайд 23 Отношение теплоты Q в изотермическом процессе к
температуре, при которой происходила передача теплоты, называется приведенной теплотой
:
Слайд 24Для подсчета приведенной теплоты в произвольном процессе необходимо разбить этот
процесс на бесконечно малые участки, где Т можно считать константой.
Приведенная теплота на таком участке будет равна :
Суммируя приведенную теплоту на всех участках процесса, получим:
Слайд 25Для процесса, происходящего по замкнутому циклу
Из равенства нулю интеграла,
взятого по замкнутому контуру,
следует, что подынтегральное выражение
- есть полный дифференциал некоторой функции, которая определяется только состоянием системы и не зависит от пути, каким система пришла в это состояние.
Слайд 26Это позволяет ввести новую функцию состояния S:
Функция состояния, полный дифференциал
которой равен , называется
энтропией.
Слайд 27Энтропия S – это отношение полученной или отданной теплоты к
температуре, при которой происходил этот процесс.
Понятие энтропии было впервые введено
Рудольфом Клаузиусом. Для обратимых процессов изменение энтропии:
- это выражение называется равенство Клаузиуса.
Слайд 28 Энтропия системы является функцией ее состояния, определенная с точностью
до произвольной постоянной. Если система совершает равновесный переход из состояния
1 в состояние 2, то изменение энтропии:
Физический смысл имеет лишь разность энтропий.
Исходя из этого, найдем изменения энтропии в процессах идеального газа.
Слайд 29Изменение энтропии S12 идеального газа при переходе его из состояния
1 в состояние 2 не зависит от вида перехода 1
2.
Слайд 30Рассмотрим фазовый переход «твердое тело – жидкость»
Коэффициент пропорциональности λ есть
константа, зависящая только от вещества системы и называемая удельной теплотой
плавления.
Слайд 31Изменение энтропии в процессе этого фазового перехода можно найти просто,
если считать процесс равновесным.
Это вполне допустимое приближение, если считать, что
разность температур между системой и тем объектом, который поставляет системе тепло, не слишком велика, намного меньше температуры плавления. Тогда:
Слайд 32Так как температура системы в данном фазовом переходе не меняется
и равна температуре плавления, то подынтегральное выражение это величина, которая
в ходе процесса не меняется, поэтому она от массы m вещества не зависит. Тогда:
Слайд 33Из этой формулы следует, что при плавлении энтропия возрастает, а
при кристаллизации уменьшается.
Физический смысл этого результата достаточно ясен:
фазовая область молекулы в твердом теле гораздо меньше, чем в жидкости, так как в твердом теле каждой молекуле доступна только малая область пространства между соседними узлами кристаллической решетки, а в жидкости молекулы занимают всю область пространства.
Слайд 34Поэтому при равной температуре энтропия твердого тела меньше энтропии жидкости.
Это
означает, что твердое тело представляет собой более упорядоченную, и менее
хаотичную систему, поэтому и энтропия его меньше, чем у жидкости.
Слайд 35Рассмотрим фазовый переход «жидкость – газ»
знак плюс относится к испарению,
а знак минус – к конденсации.
Коэффициент пропорциональности r в этом
выражении, есть константа, зависящая от вещества системы, называемая удельной теплотой испарения.
Слайд 36Изменение энтропии в этом процессе можно найти, считая процесс равновесным.
Это вполне допустимое приближение, при условии, что разность температур между
системой и «поставщиком» тепла невелика, т.е. намного меньше температуры кипения.
Тогда изменение энтропии:
Слайд 37Из формулы
следует, что при испарении энтропия возрастает, а при
конденсации уменьшается.
При равных температурах фазовая область молекул газа значительно больше
фазовой области молекул жидкости.
Газ, по сравнению с жидкостью, гораздо менее упорядоченная, более хаотичная система и энтропия газа больше энтропии жидкости.
Слайд 38При любом необратимом процессе в замкнутой системе энтропия возрастает (dS
> 0) или
Это неравенство Клаузиуса.
Таким образом, для произвольного процесса,
где,
знак равенства – для обратимого процесса; знак больше для необратимого.
Слайд 39 Тогда для замкнутой системы
– математическая запись второго начала термодинамики.
Энтропия замкнутой системы при любых происходивших в ней процессах не может убывать (или увеличивается или остается неизменной).
Слайд 40Первое и второе начала термодинамики в объединенной форме имеют вид:
Слайд 41Свободная энергия есть та работа, которую могло бы совершить тело
в обратимом изотермическом процессе или, свободная энергия –
есть максимальная возможная работа, которую может совершить система, обладая каким-то запасом внутренней энергии.
Слайд 42При любом необратимом процессе энтропия увеличивается до того, пока не
прекратятся какие-либо процессы. Это произойдет, при достижении замкнутой системы равновесного
состояния, т.е. когда все параметры состояния системы (Р, Т) во всех точках системы станут одинаковыми. Вывести систему из этого равновесного состояния можно только затратив энергию извне.
Слайд 43 Макросостояние – это состояние вещества, характеризуемое его термодинамическими параметрами.
Состояние системы, характеризуемое состоянием каждой входящей в
систему молекулы, называют микросостоянием.
Так как молекулы движутся хаотически, то имеется много микросостояний, соответствующих одному макросостоянию.
Обозначим W число микросостояний соответствующее данному макросостоянию (как правило W >> 1).
Слайд 44Термодинамической вероятностью макросостояния W называется число микросостояний, осуществляющих данное
макросостояние
Термодинамическая вероятность W максимальна, когда система находится в
равновесном состоянии.
Слайд 45Больцман предложил, что
где k – коэффициент Больцмана.
С этой точки зрения энтропия выступает, как мера беспорядочности, хаотичности состояния.
Связь между S и W позволяет несколько иначе сформулировать второе начало термодинамики:
наиболее вероятным изменением энтропии является ее возрастание.
Энтропия системы – максимальна, при достижении замкнутой системой равновесного состояния.
Слайд 46Третье начало термодинамики или закон Нернста:
изменение энтропии S стремится к
нулю при любых обратимых изотермических процессах, совершаемых между двумя равновесными
состояниями при температурах, приближающихся к абсолютному нулю
(S → 0 при Т → 0).
Объяснение теоремы Нернста можно дать только на основании квантово-механических представлений.
Вальтер Фридрих
Герман (1864 – 1941) –
немецкий физик и физико- химик, один из основоположников
физической химии. Работы в
области термодинамики, физики низких температур, физической химии. Высказал утверждение, что энтропия химически однородного твердого или жидкого тела при абсолютном нуле равна нулю (теорема Нернста). Предсказал эффект «вырождения» газа.
Слайд 48Следствием Третьего начала является то что, невозможно охладить тело до
абсолютного нуля (принцип недостижимости абсолютного нуля температуры).