Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Термодинамиканың бірінші бастамасы
Содержание
- 1. Термодинамиканың бірінші бастамасы
- 2. Жүйенің барлық параметрлері,сыртқы жағдайлар өзгермей қалган кезде
- 3. Слайд 3
- 4. Энергияның сақталу заңы бойынша жүйенің істейтін
- 5. Күй функциялары. Термодинамикалық
- 6. Қоршаған ортаға қатысты BD
- 7. Слайд 7
- 8. Дененің температурасын бір кельвинге өзгерту үшін,оған берілетін
- 9. Слайд 9
- 10. Cp және CV жылу сыйымдылықтары арасындағы байланыс
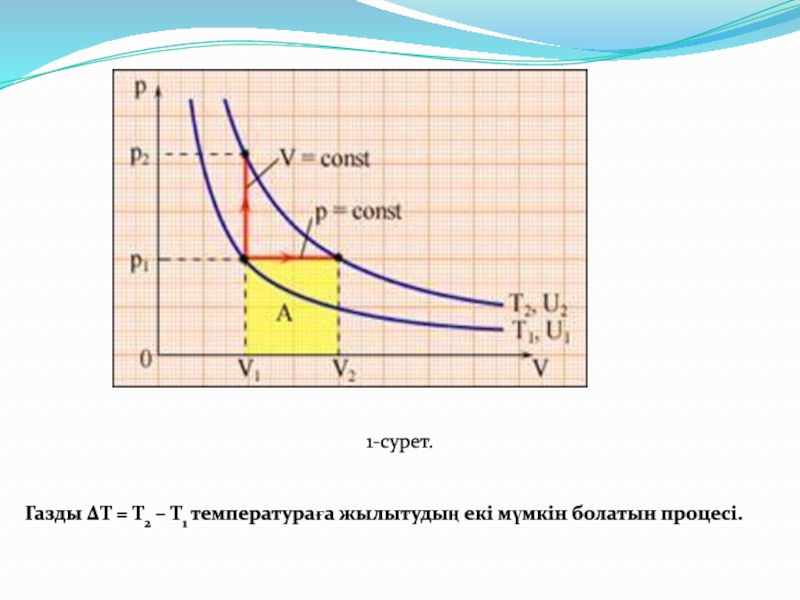
- 11. 1-сурет. Газды ΔT = T2 – T1 температураға жылытудың екі мүмкін болатын процесі.
- 12. Термодинамиканың бiрiншi заңын изопроцестерге қолдану Изохоралық процесс.
- 13. Изотермалық процесс. Изотермалық процесс кезiнде газдың температурасы
- 14. Изобаралық процесс. Изобаралық процесс кезiндегi
- 15. Адиабаталық процессҚоршаған ортамен жылу
- 16. Күн көзiнiң әсерiнен жылыған ауа, жоғары көтерiледi
- 17. Пуассон теңдеуі немесе адиабаталық процестегі идеал газ күйінің теңдеуі
- 18. Политропты процесс дегеніміз, жылуды қалай болса солай
- 19. Слайд 19
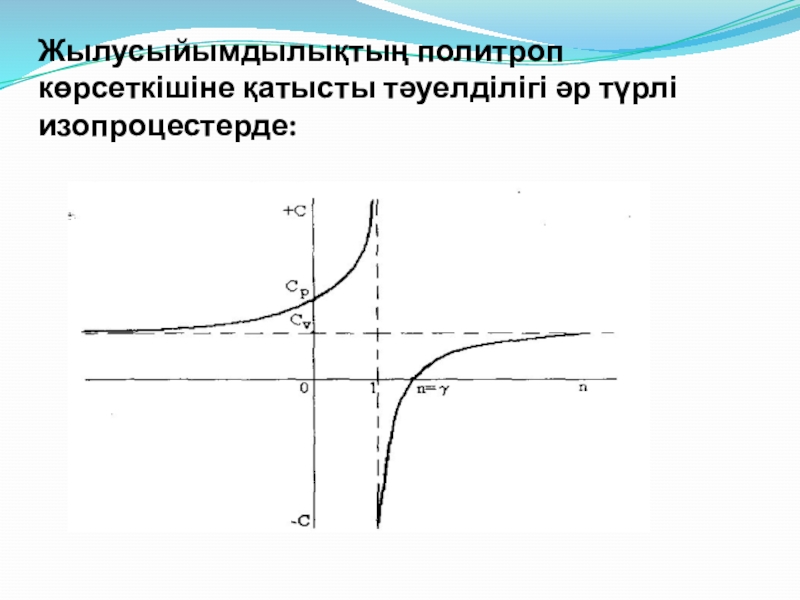
- 20. Жылусыйымдылықтың политроп көрсеткішіне қатысты тәуелділігі әр түрлі изопроцестерде:
- 21. Изобарлық газдың қызуы немесе сууына,оған берілген немесе
- 22. Қысым тұрақты болғанда газдың жылусыйымдылығын эптальпия арқылы анықтауға болат:
- 23. Рахмет!
- 24. Скачать презентанцию
Жүйенің барлық параметрлері,сыртқы жағдайлар өзгермей қалган кезде уақыт бойынша тұрақты болатын,белгілі мәндерін сақтайтын күйін термодинамикалық тепе-теңдік күйі деп атайды.
Слайды и текст этой презентации
Слайд 2Жүйенің барлық параметрлері,сыртқы жағдайлар өзгермей қалган кезде уақыт бойынша тұрақты
болатын,белгілі мәндерін сақтайтын күйін термодинамикалық тепе-теңдік күйі деп атайды.
Слайд 3
Жоспар:
1.Термодинамикалық тепе-теңдік және термодинамиканың
1-бастамасы.2.Күй функциялары.
3.Газдың жылусыйымдылығы.
4,Жылусыйымдылығының кванттық теориясы жөніндегі түсініктер.
5.Термодинамиканың 1-бастамасын изопроцесстерге қолдану.
6.Адиабаталық процесс.
7.Энтальпия жылулық функция.
Слайд 4
Энергияның сақталу заңы бойынша жүйенің істейтін жұмысы,оған берілген жылу мөлшері
мен ішкі энергиясының өзгеруінің айырымына тең долады:
dA=dQ-dUбұл теңдеу механикалық және жылулық энергияларына қатысты энергияның сақталу заңы.
Осы сақталу заңы термодинамиканың бірінші заңы немесе бастамасы деп аталады.
Теомодинамиканың бірінші бастамасы.
Слайд 5 Күй функциялары.
Термодинамикалық жүйенің күйін тәкелсіз
макрасксптық параметрлер жиынтығы,яғнитемпература,қысым,тығыздық,масса,химиялық құрамы және т.б. олар заттың өлшенетін қасиеттерін
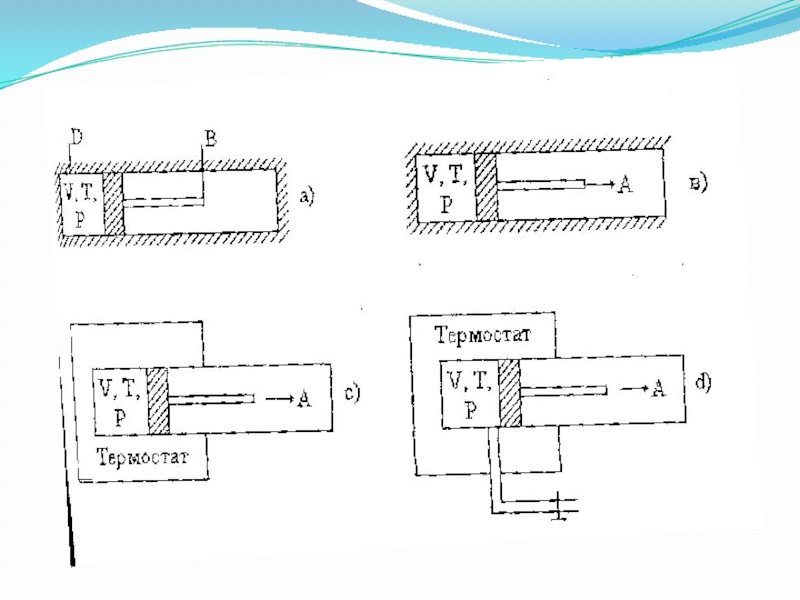
сипаттайды,күй функциялары немесе күй параметрлері деп аталады.Слайд 6 Қоршаған ортаға қатысты BD жүйе зат және
энергия үш түрлі тәсілмен алмасуы мүмкін:
a)жүйе оқшауланған,ешқандай зат және энергия
алмасу болмайды.b)оқшауланған жуйедегі адибаталық процесс,зат және энергия алмасусыз өтеді.
c)жабық жүйе,затпен алмасусыз,бірақ энергия алмасып отырады.
d)ашық жүйе,зат және энергия алмасады.
Слайд 8Дененің температурасын бір кельвинге өзгерту үшін,оған берілетін немесе одан алынатын
жылу мөлшерін жылусыйымдылық д.а.
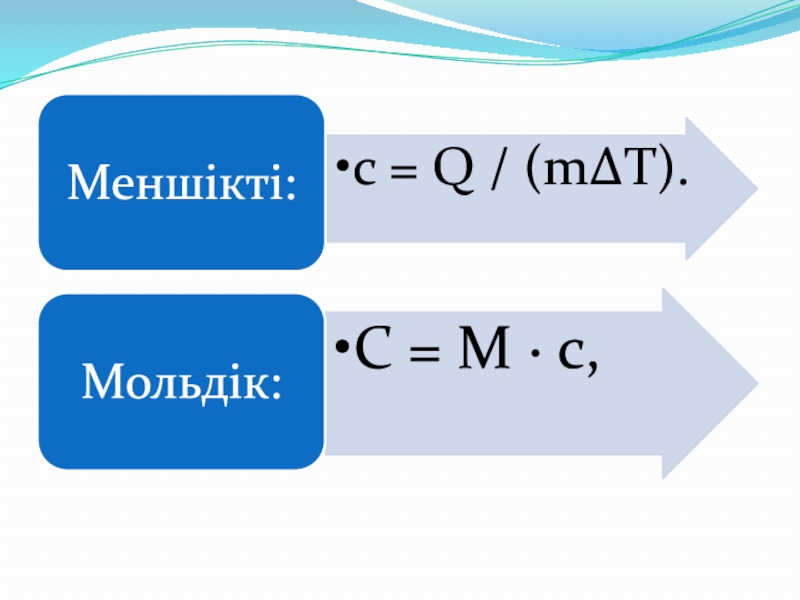
Меншікті
Мольдік
Заттың бірлік массасына қатысты
с (Дж/кг*К)Заттың бір моліне қатысты
С (Дж/моль*К)
Слайд 10Cp және CV жылу сыйымдылықтары арасындағы байланыс (Майер формуласы):
Cp = CV + R.
Cp жылу сыйымдылығы CV жылу сыйымдылығынан әрқашан көбірек болады (1-сурет).
Слайд 12Термодинамиканың бiрiншi заңын изопроцестерге қолдану
Изохоралық процесс.
Бұл процесте газ
көлемi өзгермейдi: V = const. Газдың iшкi энергиясының өзгерiсi оған
берiлген жылу мөлшерiне тең: ΔU = Q. Егер газ қыздырылса , онда Q > 0 және ΔU > 0 – iшкi энергия ұлғаяды. Газды суытқан кезде: Q < 0 және ΔU < 0, оның iшкi энергиясы азаяды.Слайд 13Изотермалық процесс.
Изотермалық процесс кезiнде газдың температурасы тұрақты болады (Т
= const) және оның iшкi энергиясы өзгермейдi. Газға берiлген барлық
жылу мөлшерi пайдалы жұмыс атқаруға жұмсалады: Q = А′. Газ белгiлi жылу мөлшерiн (Q > 0) алған кезде, ол оң жұмыс атқарады (А′ > 0). Керiсiнше, егер газ қоршаған ортаға жылу берсе, онда оның атқарған жұмысы терiс болып саналады.Слайд 14Изобаралық процесс.
Изобаралық процесс кезiндегi газға берiлген жылу
мөлшерi оның iшкi энергиясының бiрге өзгеруiне және қысым тұрақты болған
кездей P = const жұмысты атқаруға шығындалады.Слайд 15 Адиабаталық процесс
Қоршаған ортамен жылу алмасуы болмайтын жағдайда
өтетiн жүйедегi изопроцесс адиабаталық процесс деп аталады. Адиабаталық процесс кезiнде
Q = 0 және жүйенiң iшкi энергиясының өзгеруi жұмыс атқару арқылы ғана жүредi: ΔU= А. ΔU= А теңдiгi белгiлi қорытынды жасауға мүмкiндiк бередi. Егер жүйеде оң жұмыс жасалса, мысалы газ сығылатын болса, онда оның iшкi энергиясы ұлғаяды және температурасы өседi. Керiсiнше , газ ұлғайған кезде, ол өзi оң жұмыс атқарады (Аұ > 0). Оның iшкi энергиясы азаяды да, газ суиды.Слайд 16Күн көзiнiң әсерiнен жылыған ауа, жоғары көтерiледi де, биiктiкке көтерiлген
сайын қысымның азаюына байланысты тез арада ұлғайып-таралады. Бұл ауаның ұлғайып-таралуы
оның салқындауына әкелiп соғады. Осының нәтижесiнде су булары конденсацияланады да, бұлттар пайда боладыСлайд 18Политропты процесс дегеніміз, жылуды қалай болса солай жеткізу немесе алып
кету (dqа≠0) процессін айтады.
Газ күйінің өзгеру процесін политроптық деп атайды,егер
оның С жылусыйымдылығы тұрақты жәнеdQ/dT тең болса:C=dQ/dT
Слайд 19
Pνn = const
Осы идеал газдың қысымы мен көлемін байланыстыратын
формула политроптық процестегі газ күйінің теңдеуі немесе политроп теңдеуі деп аталады.Слайд 21Изобарлық газдың қызуы немесе сууына,оған берілген немесе одан алынған жылу
Осы I шамасы энтальпия немесе жылулық функция деп аталады.