Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Тканевой обмен аминокислот
Содержание
- 1. Тканевой обмен аминокислот
- 2. Содержание лекции1.Основные реакции обмена аминокислот-реакции по радикалу-реакции
- 3. Слайд 3
- 4. Слайд 4
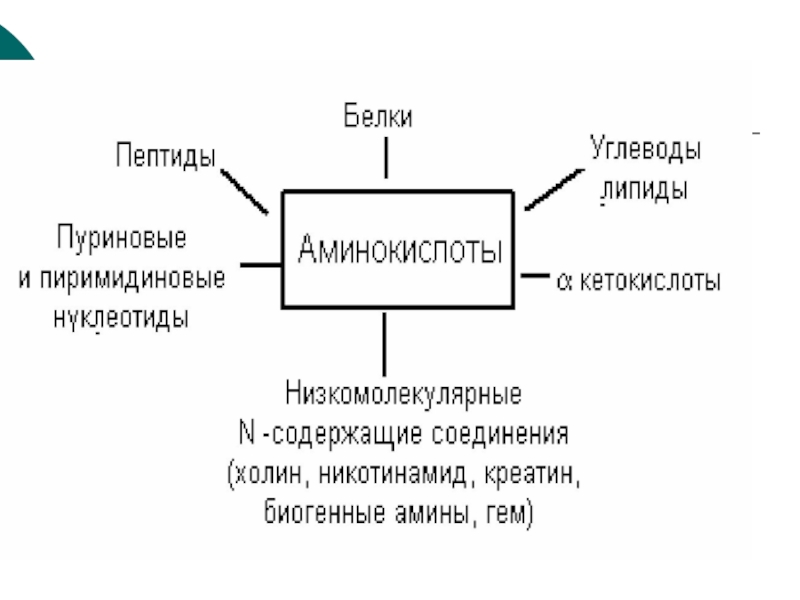
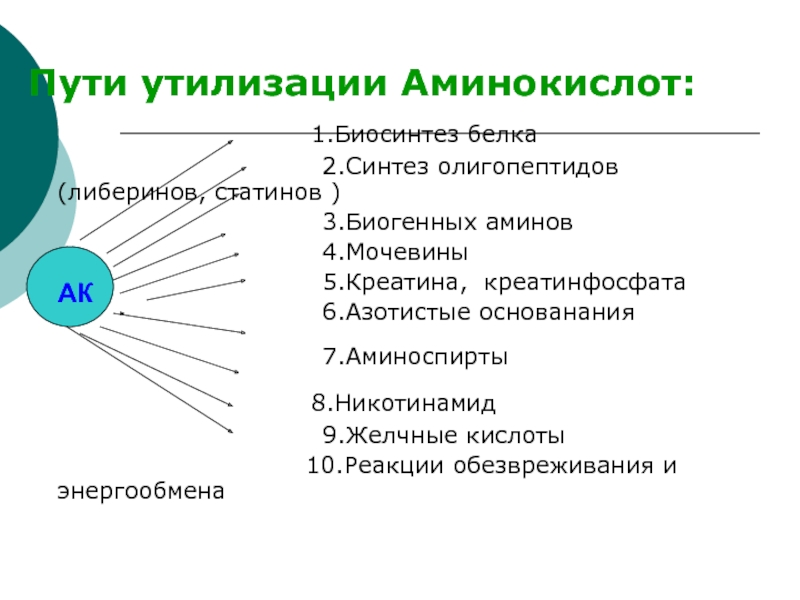
- 5. Пути утилизации Аминокислот:
- 6. Кроме индивидуальных путей обмена, известен
- 7. Слайд 7
- 8. Слайд 8
- 9. Трансаминирование аминокислот окислительное дезаминирование- прямое
- 10. Первая стадия яв-ся ферментативной с
- 11. ГЛУ+NAD+---?иминоглут кислота + НОН-? ---?α-
- 12. ГДГ- состоит из 6 субъединиц
- 13. Все остальные аминокислоты могут окисляться
- 14. Слайд 14
- 15. Это главный путь удаления азота
- 16. Исключением являются аминокислоты с разветвленным
- 17. Непрямое окислительное дезаминирование. Почти все природные
- 18. Любая а/к α-
- 19. Поскольку обе эти реакции –
- 20. Т.о. можно сказать, что путь синтеза
- 21. Слайд 21
- 22. Слайд 22
- 23. Существует еще один механизм
- 24. Слайд 24
- 25. ГДГ выполняет следующие функции:1.Осуществляет связь обмена а/к
- 26. Слайд 26
- 27. Трансаминирование-это главный путь удаления азота
- 28. Слайд 28
- 29. Исключением являются аминокислоты с разветвленным
- 30. Клиническое значение определения активности трансаминаз
- 31. В сыворотке крови здоровых людей активность
- 32. Наибольшая активность АлАТ приходится на
- 33. Определение активностиАсАТ используется для ранней
- 34. Токсичность аммиака и пути его обезвреживания1.Аммиак в
- 35. 3.Аммиак изменяет соотношение ионов натрия и калия
- 36. Пути обезвреживания аммиака В плазме крови
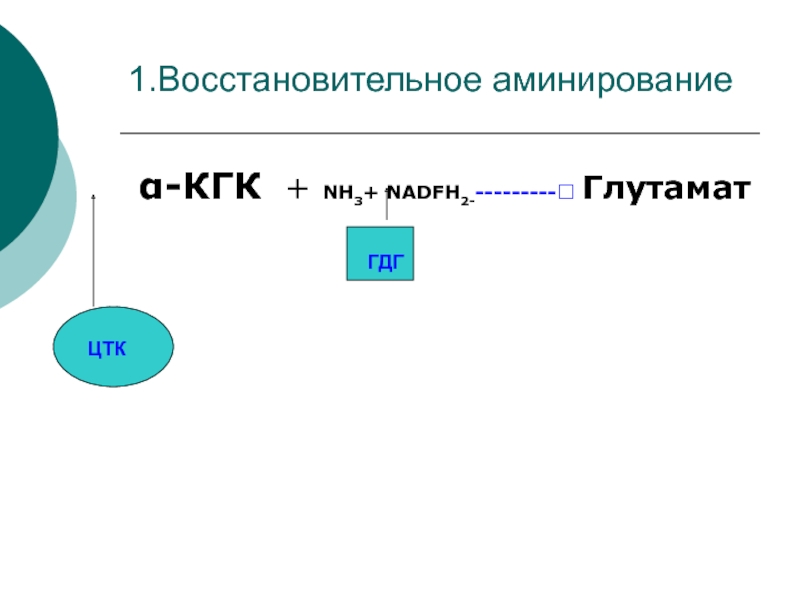
- 37. 1.Восстановительное аминирование α-КГК + NH3+ NADFH2----------? ГлутаматЦТКГДГ
- 38. Слайд 38
- 39. 2.Образование амидов дикарбоновых
- 40. Слайд 40
- 41. 3. Основная масса ГЛН и АСН захватывается
- 42. Кроме того при ацидозе происходит
- 43. 4. Амидирование свободных карбоксильных групп белков (амидированные формы белков устойчивы к протеазам)
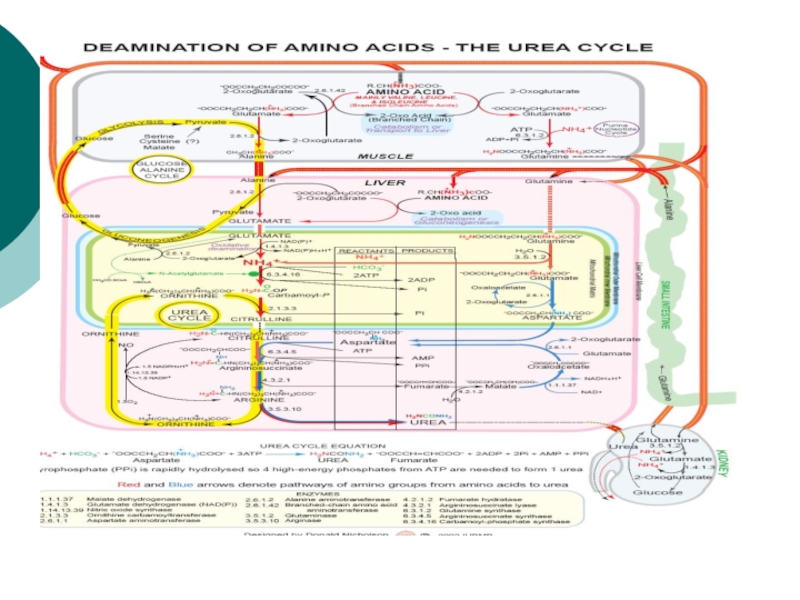
- 44. Биосинтез мочевиныЭто основной механизм обезвреживания аммиака. 90%
- 45. Орнитиновый цикл синтеза мочевины (ОЦСМ) протекает в
- 46. Это еще один путь детоксикации
- 47. Слайд 47
- 48. Слайд 48
- 49. Мочевина- природный антиоксидант, радиопротектор,который взаимодействует
- 50. Энергетическая стоимость ЦСМ ЦСМ
- 51. 2- когда синтез-ся карбомоилфосфат (
- 52. Слайд 52
- 53. Слайд 53
- 54. Биологическая роль ЦСММеханизм детоксикации аммиакаМеханизм регуляции КЩС(
- 55. Слайд 55
- 56. Врожденные дефекты ЦСМ Врожденные дефекты ферментов
- 57. Слайд 57
- 58. Слайд 58
- 59. Слайд 59
- 60. Регуляция ЦСМ Краткосрочная: на уровень 1-го
- 61. Слайд 61
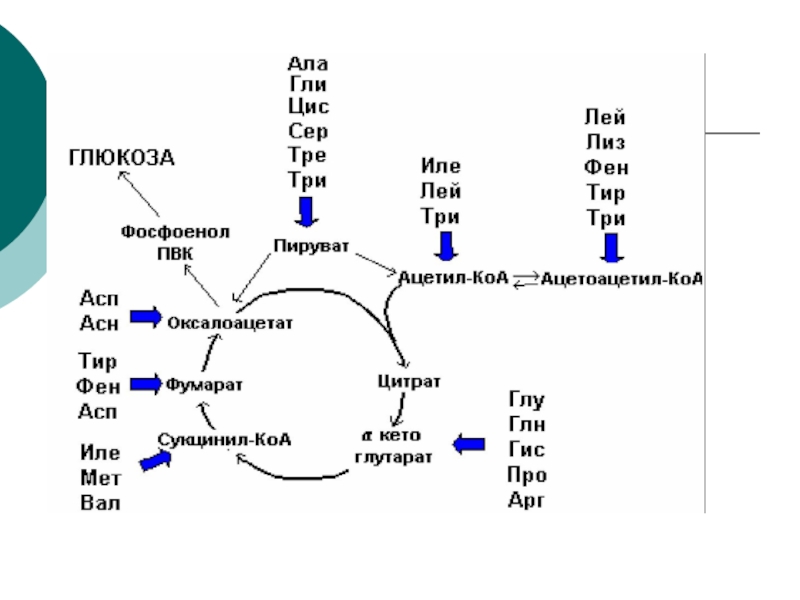
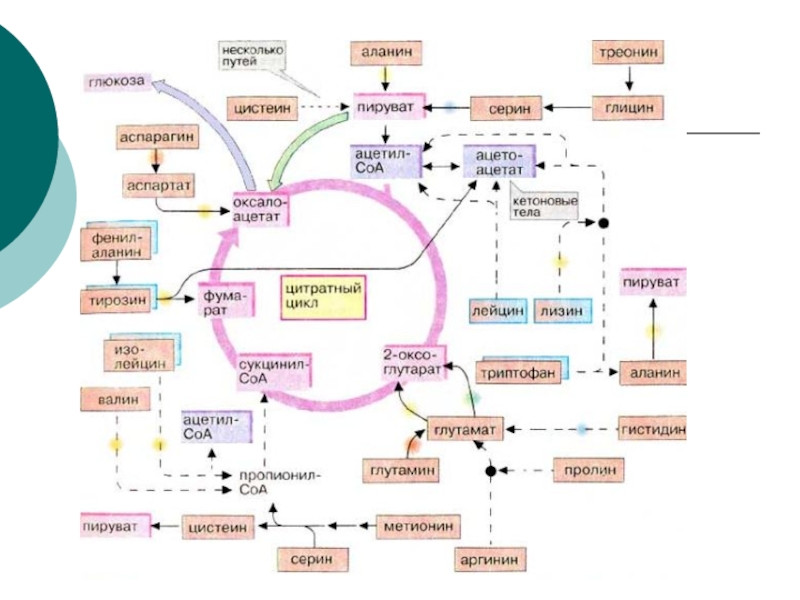
- 62. Пути вступления аминокислот в ЦТКВ процессе детоксикации
- 63. Но в экстремальных ситуациях (диабет,
- 64. Дальше, после истощения запасов
- 65. После истощения запасов липидов наступает терминальная
- 66. Слайд 66
- 67. Слайд 67
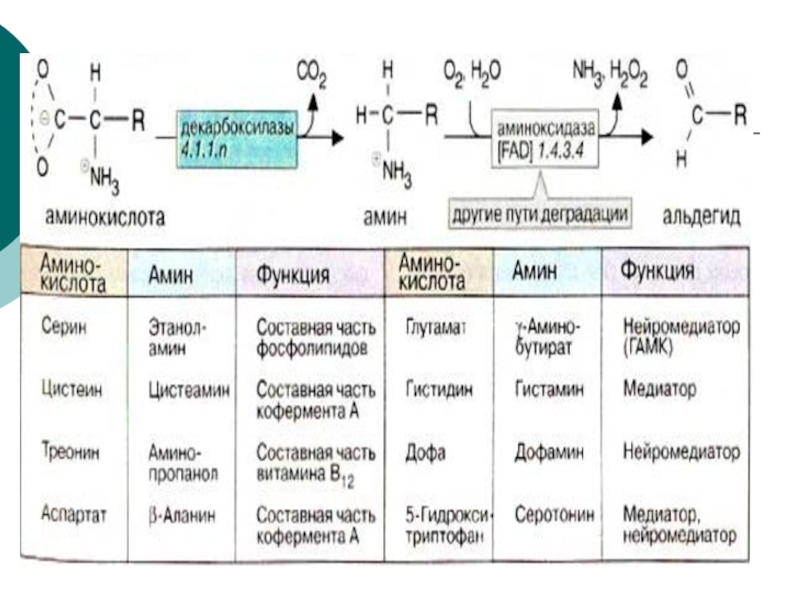
- 68. Реакции декарбоксилирования аминокислот лежат в основе образования
- 69. и психических заболеваний оказывают влияние
- 70. Слайд 70
- 71. Слайд 71
- 72. Слайд 72
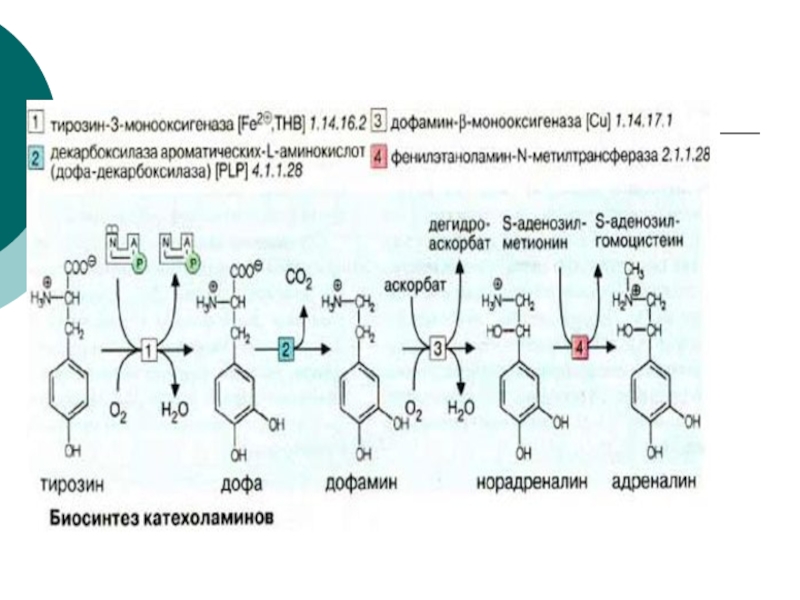
- 73. Норадреналин - основной нейромедиатор симпатических
- 74. Обмен катехоламинов происходит
- 75. Нарушения метаболизма дофамина служат причиной
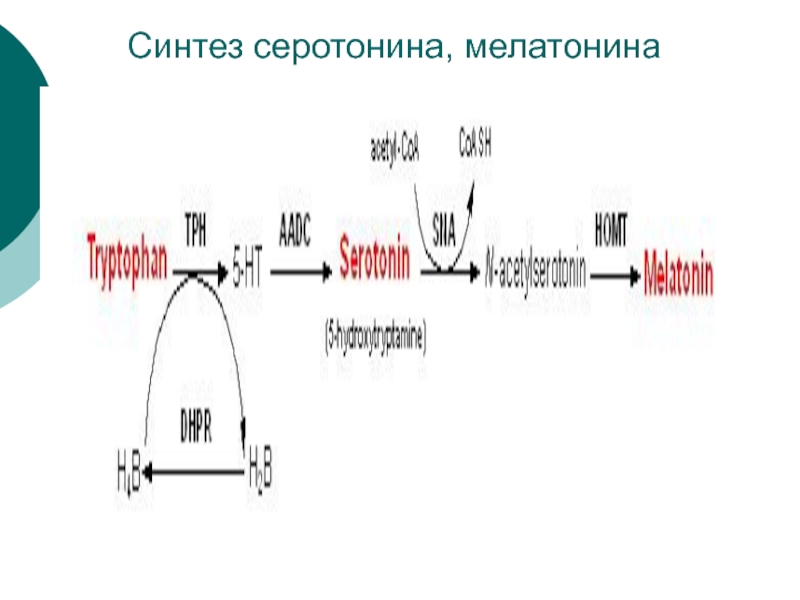
- 76. Из триптофана через промежуточный 5-гидрокситриптофан образуется серотонин, соединение с широким спектром действием
- 77. Синтез серотонина, мелатонина
- 78. Серотонин присутствует в самых
- 79. После высвобождения из серотонинергических
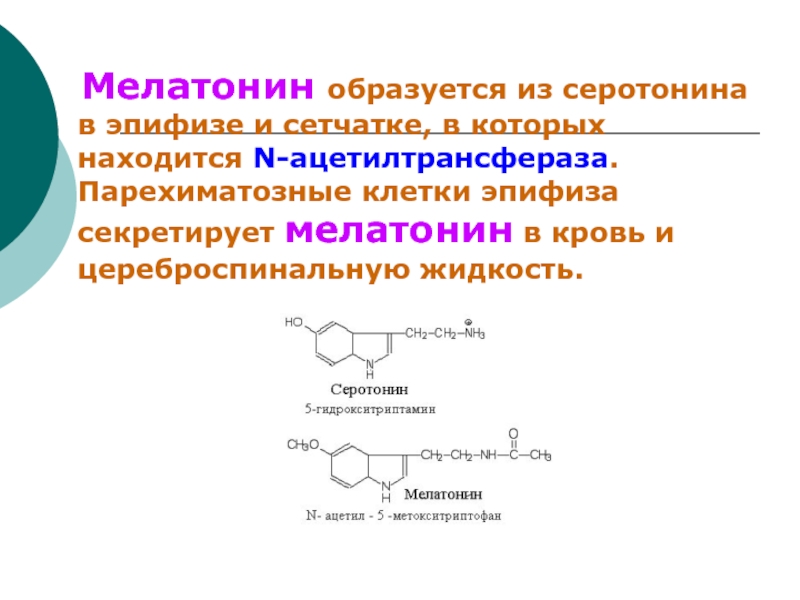
- 80. Мелатонин образуется из серотонина в
- 81. Синтез и секреция мелатонина увеличиваются
- 82. Эти суточные колебания синтеза мелатонина
- 83. Слайд 83
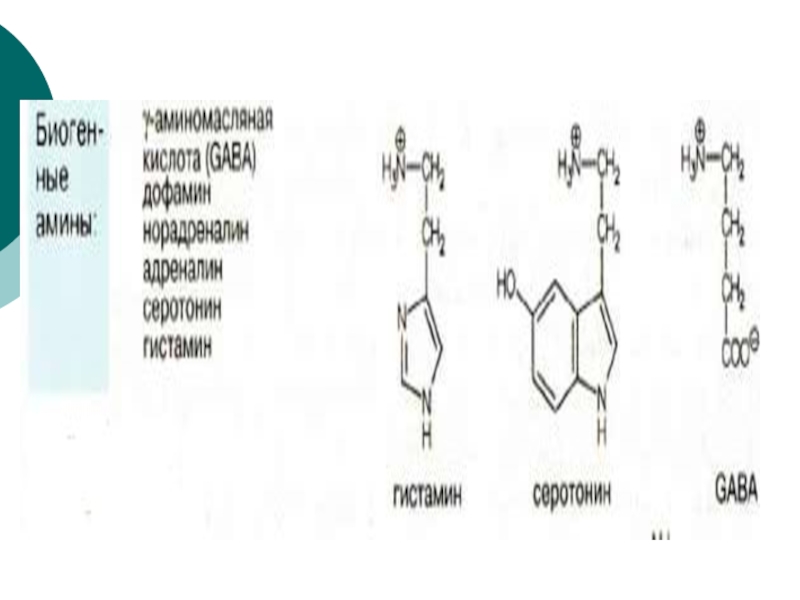
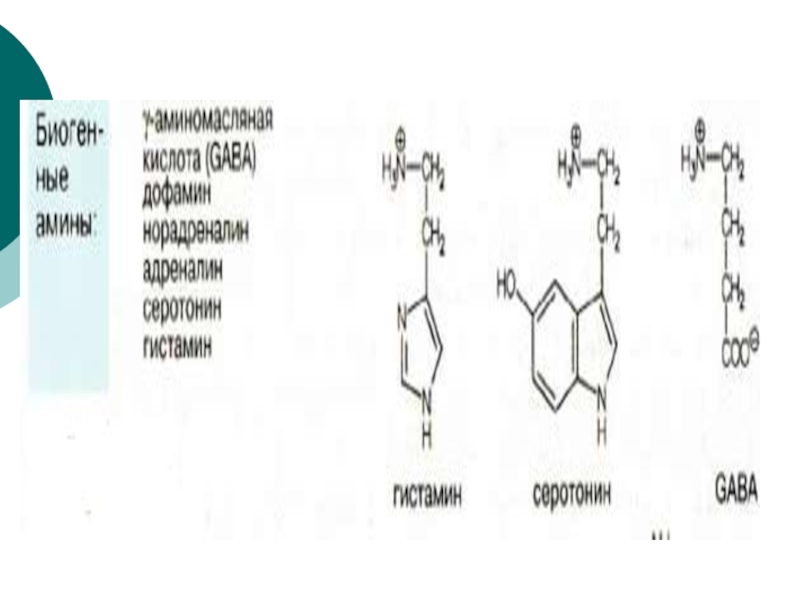
- 84. Гистамин образуется путем декарбоксилирования гистидина.
- 85. Эту реакцию катализирует декарбоксилаза ароматических
- 86. Декарбоксилаза in vitro и in
- 87. На первом этапе амин окисляется
- 88. Слайд 88
- 89. Ингибиторы МАО находят применение при лечении гипертонической болезни, депрессивных состояний и т.д.
- 90. Подобно другим биогенным аминам, гистамин
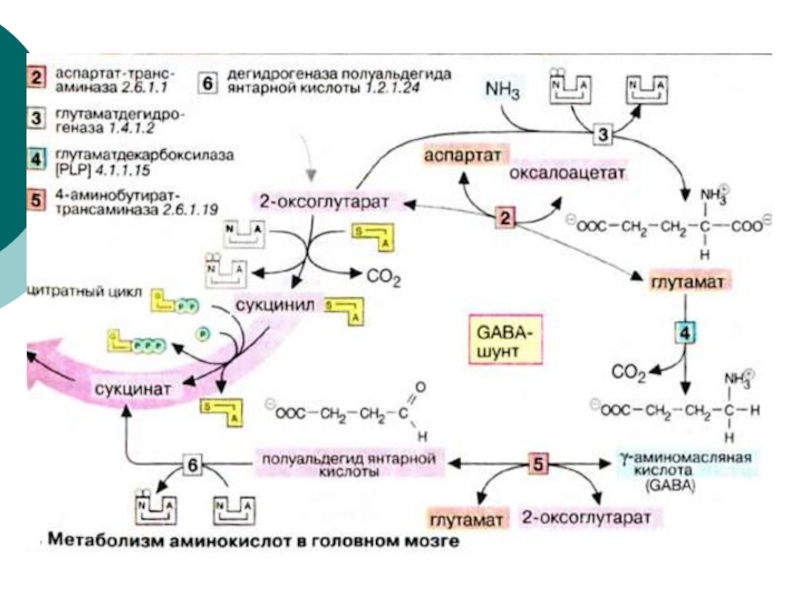
- 91. В головном мозге концентрация аминокислот
- 92. В тканях мозга интенсивно протекают
- 93. g аминомасляная кислота образуется путем декарбоксилирования L-глутамата. Эта реакция катализируется пиридоксальфосфат-зависимым ферментом L-глутамат-декарбоксилазой.
- 94. Она локализована главным образом в
- 95. В особенности важной для нормального
- 96. Биосинтез и деградацию глутамата можно
- 97. Слайд 97
- 98. ГАМК-шунт характерен для клеток центральной нервной
- 99. Декарбоксилирование L- глутамата -
- 100. Катаболизм g-аминобутирата начинается с потери
- 101. ГАМК оказывает тормозящий эффект
- 102. Глутамат, ГАМК, выполняют в нейронах
- 103. Эти аминокислоты образуются в
- 104. Многие моноамины и катехоламины инактивируются
- 105. Слайд 105
- 106. Скачать презентанцию
Содержание лекции1.Основные реакции обмена аминокислот-реакции по радикалу-реакции на карбоксильную группу-реакции на аминогруппу2.Аммиак, пути его образования,токсичность3.Пути детоксикации аммиака4.Пути вступления аминокислот в ЦТК
Слайды и текст этой презентации
Слайд 2Содержание лекции
1.Основные реакции обмена аминокислот
-реакции по радикалу
-реакции на карбоксильную группу
-реакции
на аминогруппу
ЦТКСлайд 5Пути утилизации Аминокислот:
1.Биосинтез белка
2.Синтез олигопептидов (либеринов, статинов )3.Биогенных аминов
4.Мочевины
5.Креатина, креатинфосфата
6.Азотистые основанания
7.Аминоспирты
8.Никотинамид
9.Желчные кислоты
10.Реакции обезвреживания и энергообмена
АК
Слайд 6 Кроме индивидуальных путей обмена, известен ряд превращений, общий
почти для всех аминокислот. Это реакции:
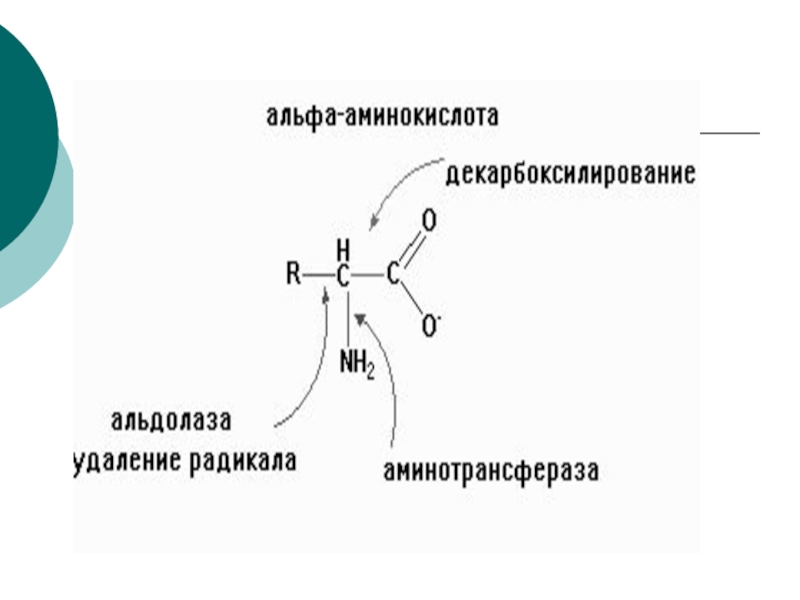
1.по радикалу (R)- реакции
гидроксилирования ( про----> o-про)разрыва радикала( образование Vit PP и ТРП);
2.Реакции на --СООН группу- декарбоксилирование( образование биогенных аминов, ГИС? гистамин)
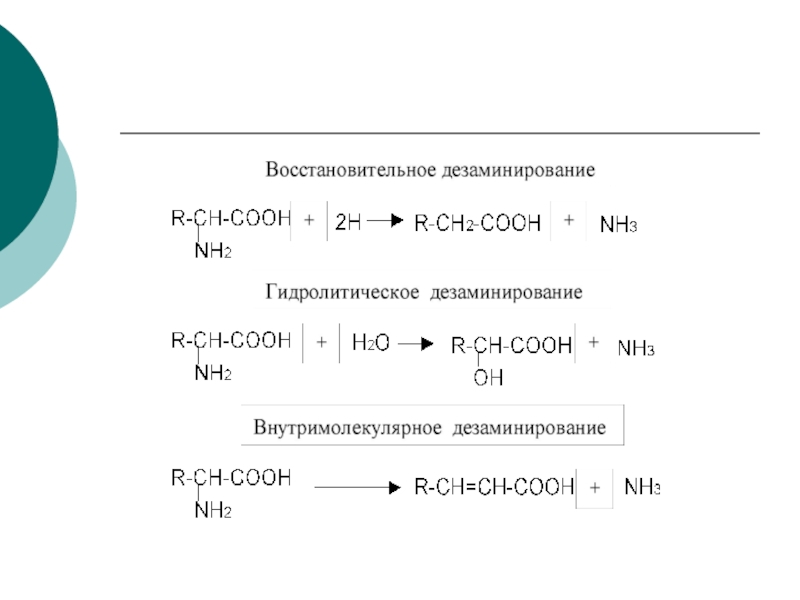
3. Реакции на группу NH2- дезаминирование 4х типов:
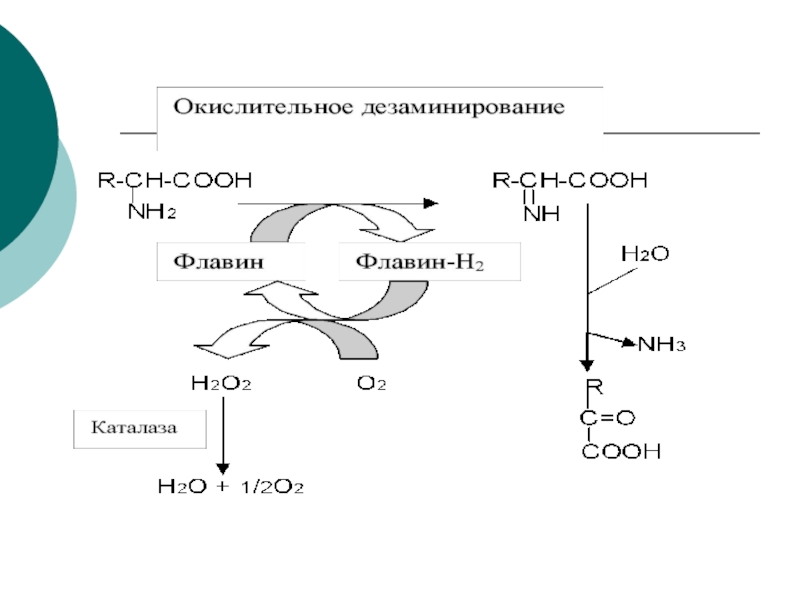
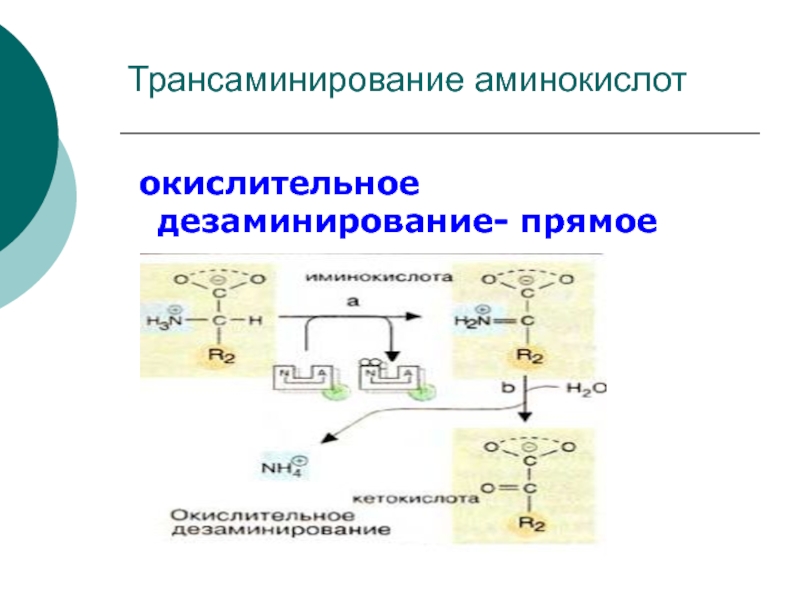
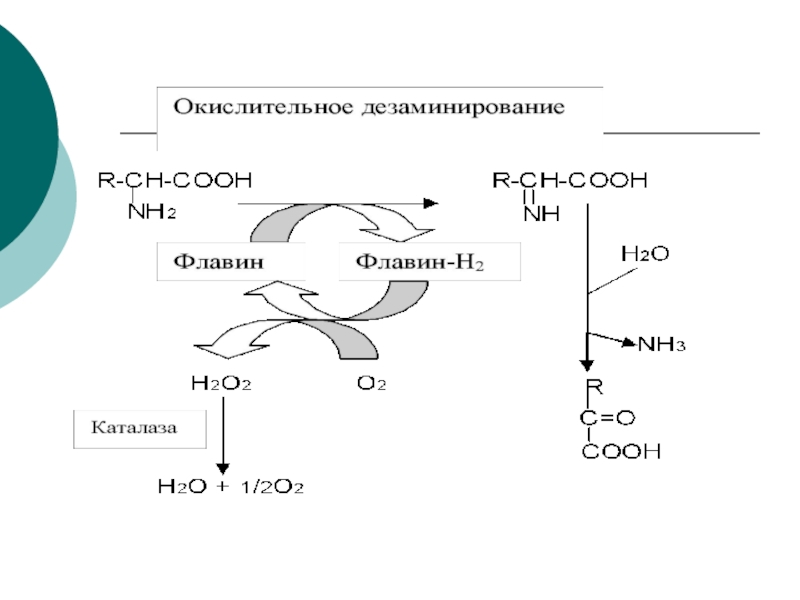
Слайд 10 Первая стадия яв-ся ферментативной с образованием промежуточного продукта-
иминокислоты, которая спонтанно, без участия фермента, распадается на аммиак и
α- кетокислоту.Этот тип реакций наиболее распространен в тканях
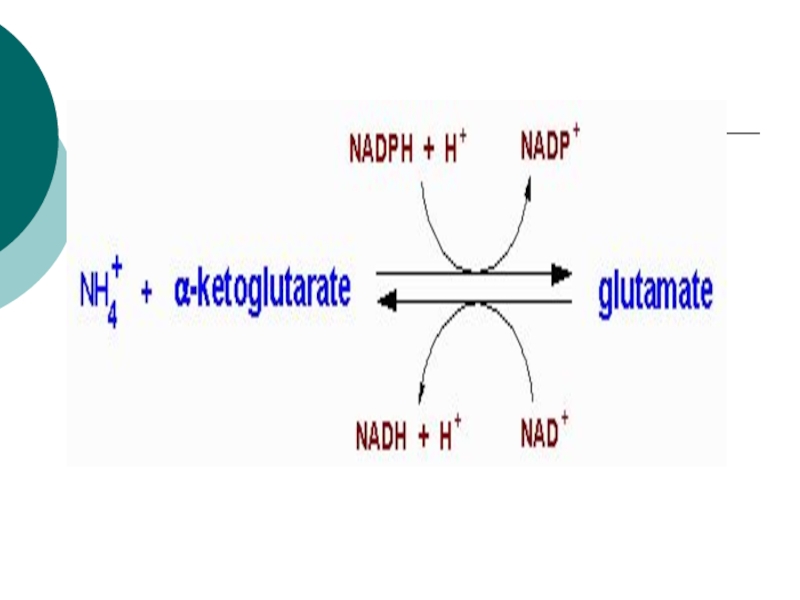
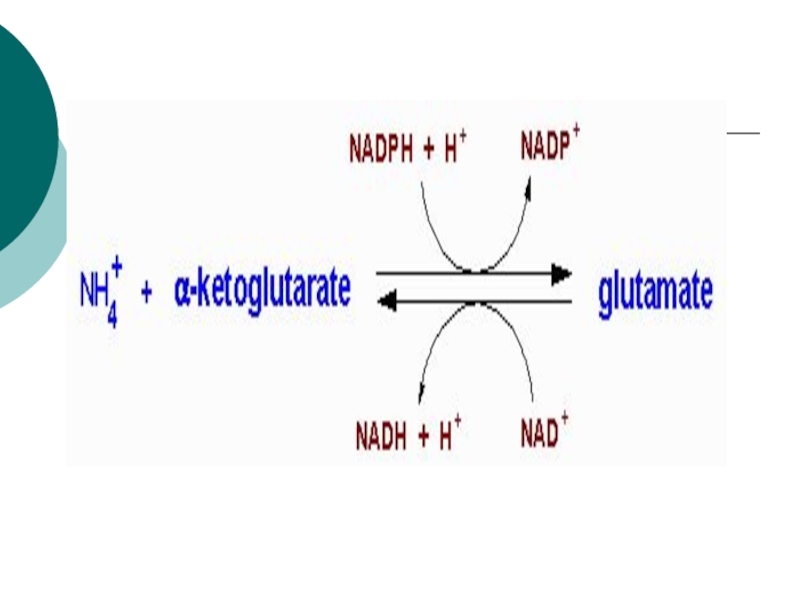
Слайд 11ГЛУ+NAD+---?иминоглут кислота + НОН-?
---?α- кетоглутарат+NADH+H+ + NH3
Первая стадия катализируется ГДГ (анаэробный фермент). Вторая стадия проходит
спонтанно. Реакция- обратима!
Слайд 12 ГДГ- состоит из 6 субъединиц и проявляет свою
активность только в мультимерной форме. При диссоциации ГДГ на субъединицы,
в присутствии NADH2, ГТФ, стероидных гормонов), она теряет свою Глутаматдегидрогеназную функцию, но приобретает способность дезаминировать другие аминокислоты (аланин). ГДГ- регуляторный, аллостерический фермент.Слайд 13 Все остальные аминокислоты могут окисляться и дезаминироваться только
непрямым путем ( т.е. через дополнительную стадию трансаминирования).
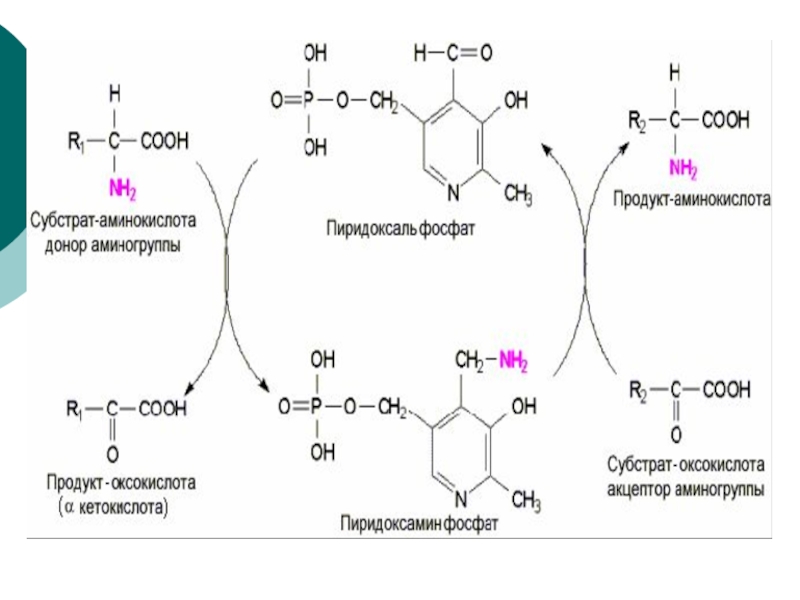
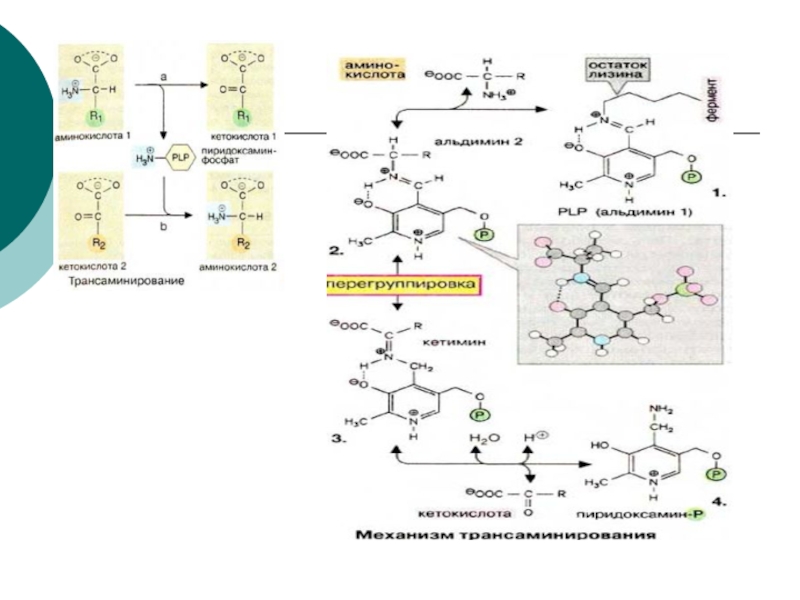
Коферментом
трансаминаз является фосфорилированная форма Vit В6- пиридоксальфосфат, который в процессе реакции обратимо превращается в пиридоксальаминфосфатСлайд 15 Это главный путь удаления азота у аминокислот. Выделены
трансаминазы, катализирующие переаминирование большинства аминокислот. После поступления пищевых аминокислот из
воротной вены, например, значительная часть их в печени подвергается переаминированию.Слайд 16 Исключением являются аминокислоты с разветвленным углеводородным радикалом, для
которых в печени нет соответствующих трансаминаз, о чем говорит более
высокая концентрация таких аминокислот в крови, оттекающей от печени по сравнению с концентрацией в крови воротной вены.Слайд 17 Непрямое окислительное дезаминирование.
Почти все природные а/к сначала реагируют
с α-КГК в реакции трансаминирования с образованием ГЛУ и соответствующей
кетокислоты, а образовавшаяся ГЛУ затем подвергается прямому окислительному дезаминированию под действием ГДГ.Т.е. все а/к подвергаются дезаминированию непрямым путем, только через стадию образования ГЛУ
Слайд 19 Поскольку обе эти реакции – и трансаминирование, и
прямое дезаминирование- обратимы, то создаются условия для синтеза новой заменимой
а/к, если в организме есть соответствующие кетокислоты. Организм человека не наделен способностью синтезировать углеводные скелеты( т.е. α-кетокислоты) незаменимых а/к. Этой способностью обладают растения.Слайд 20 Т.о. можно сказать, что путь синтеза заменимых а/к в
организме- это непрямое окислительное дезаминирование, которое запущеное в обратном направлении.
Этот путь называется трансаминированием.Слайд 23
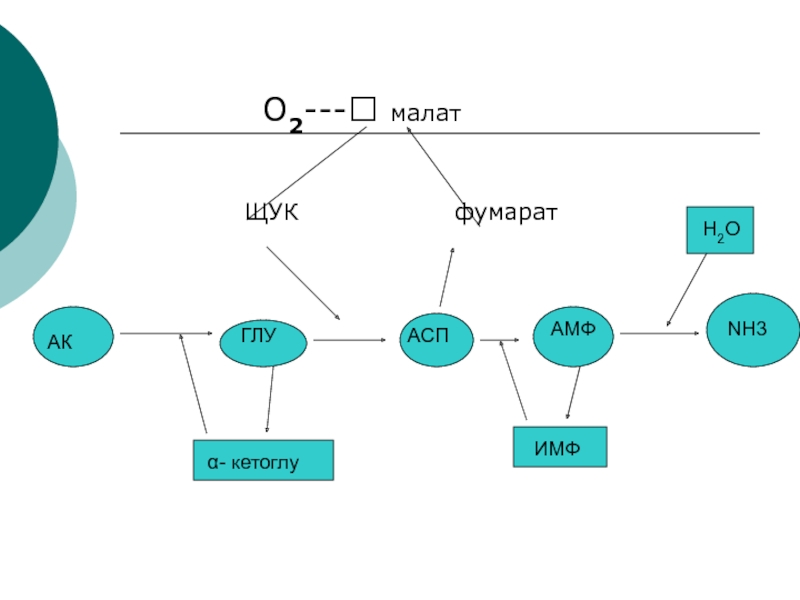
Существует еще один механизм непрямого дезаминирования
α- а/к, при которм ГЛУ, АСП, и АМФ выполняют роль
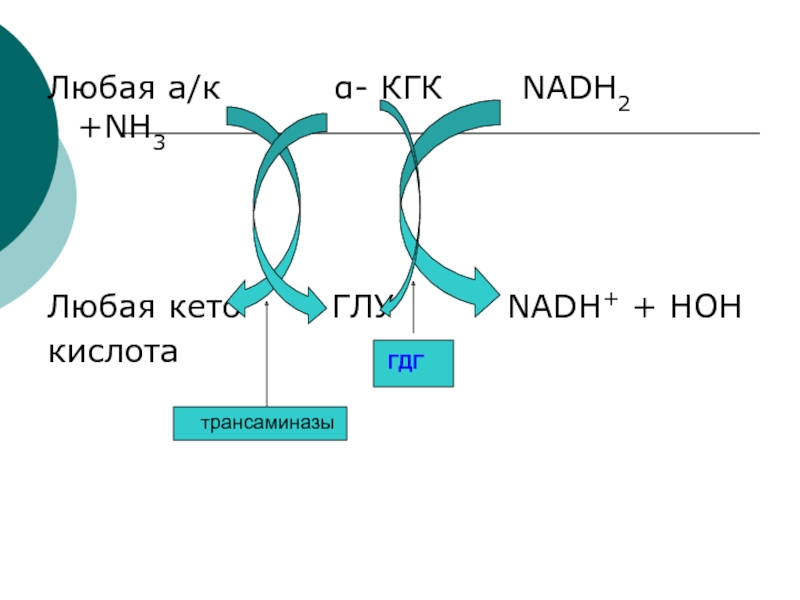
системы переноса NН2- группы:Слайд 25ГДГ выполняет следующие функции:
1.Осуществляет связь обмена а/к с ЦТК через
α-кетоГЛУ
2.Обеспечивает связывание аммиака
3.Обеспечивает синтез всех заменимых аминокислот
4.Обеспечивает перекачку протонов с
NADH на NADFH ( пластическая функция при синтезе а/к)Слайд 27 Трансаминирование-это главный путь удаления азота у аминокислот. Выделены
трансаминазы, катализирующие переаминирование большинства аминокислот. После поступления пищевых аминокислот из
воротной вены, например, значительная часть их в печени подвергается переаминированию.Слайд 29 Исключением являются аминокислоты с разветвленным углеводородным радикалом, для
которых в печени нет соответствующих трансаминаз, о чем говорит более
высокая концентрация таких аминокислот в крови, оттекающей от печени по сравнению с концентрацией в крови воротной вены.Слайд 30
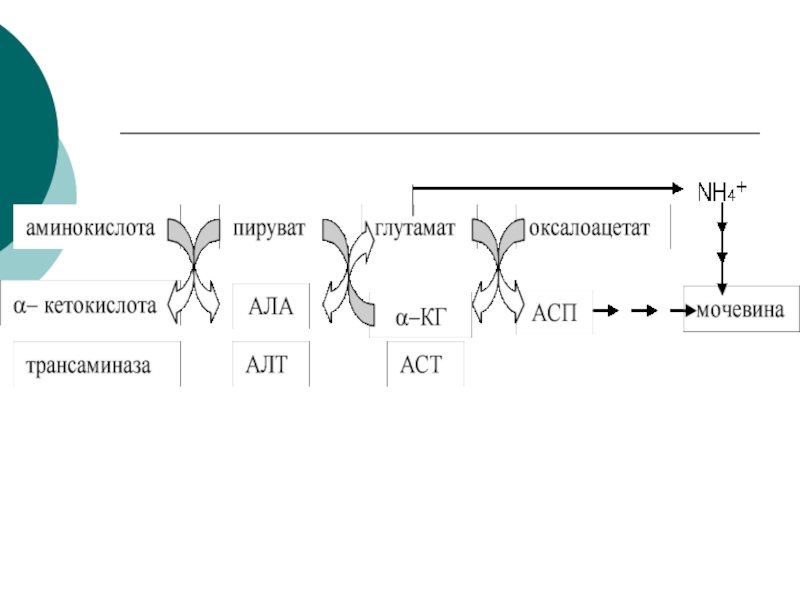
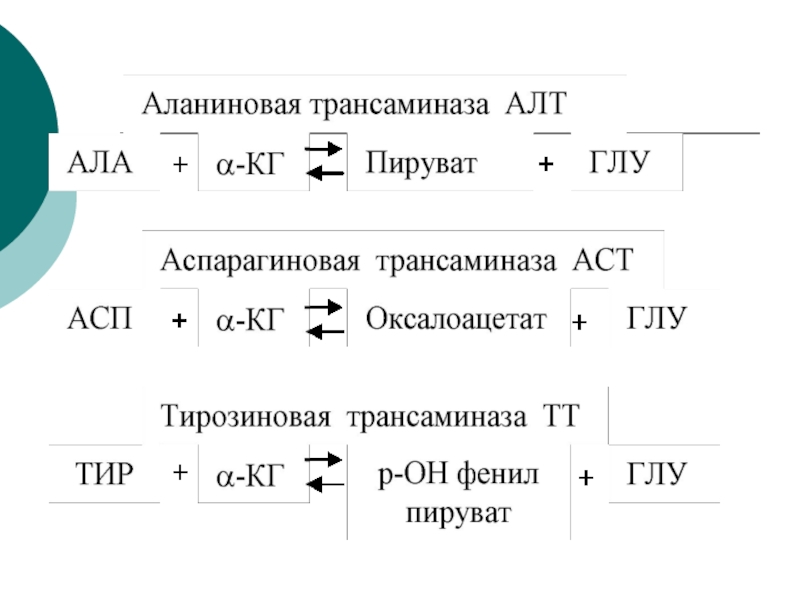
Клиническое значение определения активности трансаминаз
Для клинических целей наибольшее значение
имеют 2 трансаминазы- АсАТ и АлАТ
АсАТАСП + α-КГК ЩУК+ ГЛУ
АлАТ
АЛА + α-КГК ПВК + ГЛУ
Слайд 31 В сыворотке крови здоровых людей активность этих трансаминаз в
среднем составляет-15-20 Е., по сравнению с десятками и сотнями тысяч
единиц во внутренних органах и тканях. Поэтому органические поражения при остых и хронических заболеваниях сопровождаются деструкцией клеток, и выходу АсАТ и АлАТ из очага поражения в кровь.Слайд 32 Наибольшая активность АлАТ приходится на печень, а АсАТ
на миокард. Поэтому определение активности АсАТ в сыворотке крови используется
для ранней диагностики болезней Боткина, а также для ее безжелтушных форм. Высокая активность фермента поддерживается 10-15 дней, затем постепенно снижается.Слайд 33 Определение активностиАсАТ используется для ранней диагностики ИМ. Причем
увеличение активности наблюдается через 24-36 час. И снижается на 3-7
сутки, при благоприятном исходе.Для дифференциальной диагностики гепатита и ИМ используется коэффициент де Ритиса:
К= АсАТ/ АсАТ = 1.5-2 ( в норме)
Если К>2 – ИМ. Если К < 0.6 ----болезнь Боткина
Слайд 34Токсичность аммиака и пути его обезвреживания
1.Аммиак в тканях протонирован
( NH4+), т.е он связывает Н+, и тем самым изменяект
КЩБ( кислотно- щелочной баланс).2.Аммиак вступает в реакции «насильственного» аминирования α- кетокислот, извлекает из ЦТК важнейшие субстраты и вызывает тем самым низкоэнергетический сдвиг, т.е. состояние близкое к гипоксическому
Слайд 353.Аммиак изменяет соотношение ионов натрия и калия т.к. близок к
ним по физико- химическим свойствам: следовательно нарушается водно- электролитный баланс.
4.Аммиак
обладает нейротоксичностью- изменяет мембранный потенциал нейронов, способен ингибировать биосинтез белка( аминирует белки)Слайд 36Пути обезвреживания аммиака
В плазме крови содержится 25-40 мМ/л
аммиака. При накоплении последнего возникает тремор, нечленораздельная речь, иногда смерть.
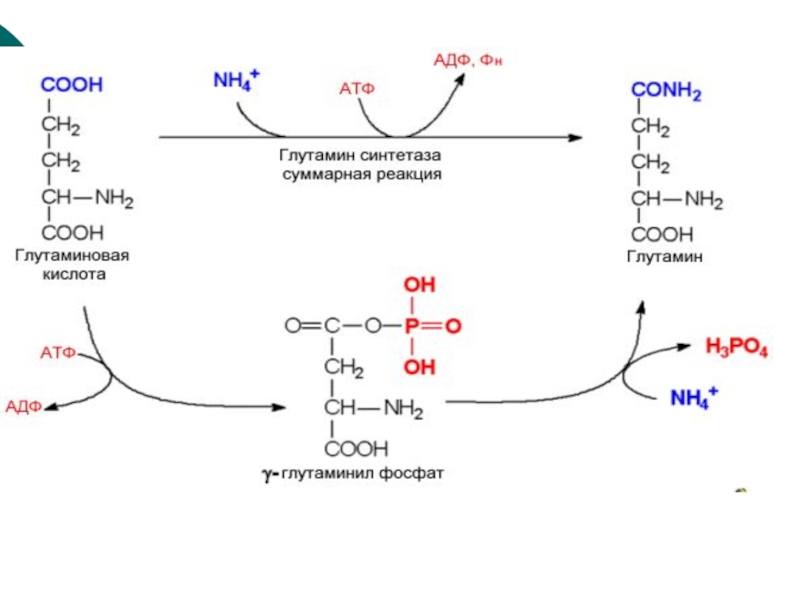
Аммиак- этиологический фактор почечной недостаточностиСлайд 39 2.Образование амидов дикарбоновых
кислот
Т.к.
ГЛН и АСН выделяются с мочой, то они являются транспортной
формой аммиака.ГЛН --? АЛА--? по воротной вене в печень, где аминогруппа идет на синтез мочевины, а углеродные скелеты на ГНГ. Это глюкозо-аланиновый цикл между печенью и мышцами ( цикл Кори)
Слайд 413. Основная масса ГЛН и АСН захватывается почками, где под
действием глутаминазы от них отщепляется аммиак.. Далее он реагирует с
Н+ и дает ион аммония, который экскретируется с мочой. При ацидозе экскреция катиона аммония с мочой увеличивается,т.к. ацидоз активирует глутаминазу и она активно отщепляет аммиак от ГЛН, который в свою очередь активно захватывает протоны и тем самым ликвидирует ацидоз.Слайд 42 Кроме того при ацидозе происходит потеря Na+ и
K+ с мочой. Это приводит к снижению осмотического давления и
обезвоживанию тканей. Но этот процесс не развивается благодаря образованию NH4+ , который обладает близкими физико- хим. cвойствами с Na+ и K+,замещая их он предотвращает нарушение водно- электролитного баланса. Это аммониогенезСлайд 43
4. Амидирование свободных карбоксильных групп белков (амидированные
формы белков устойчивы к протеазам)
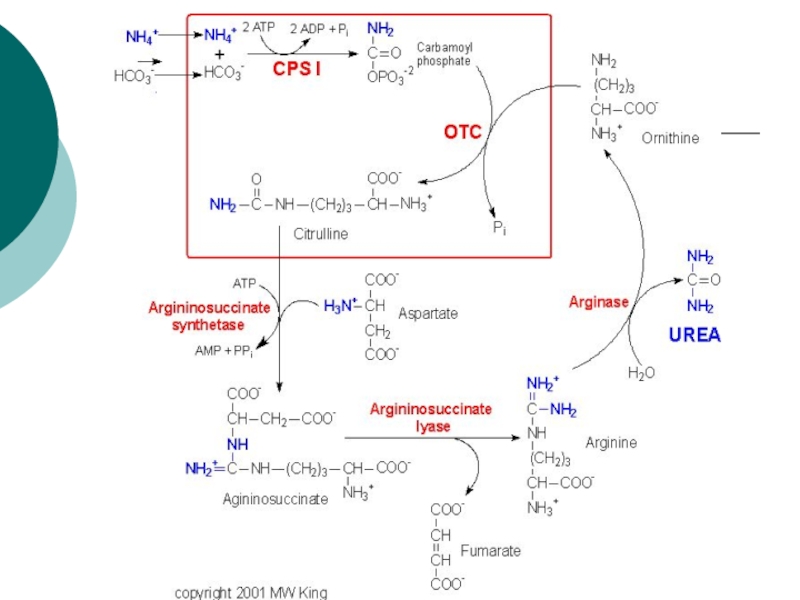
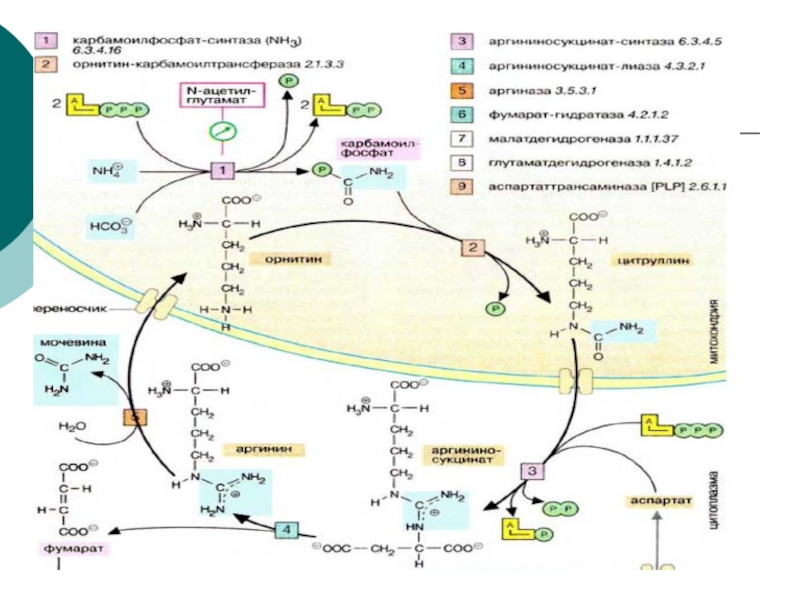
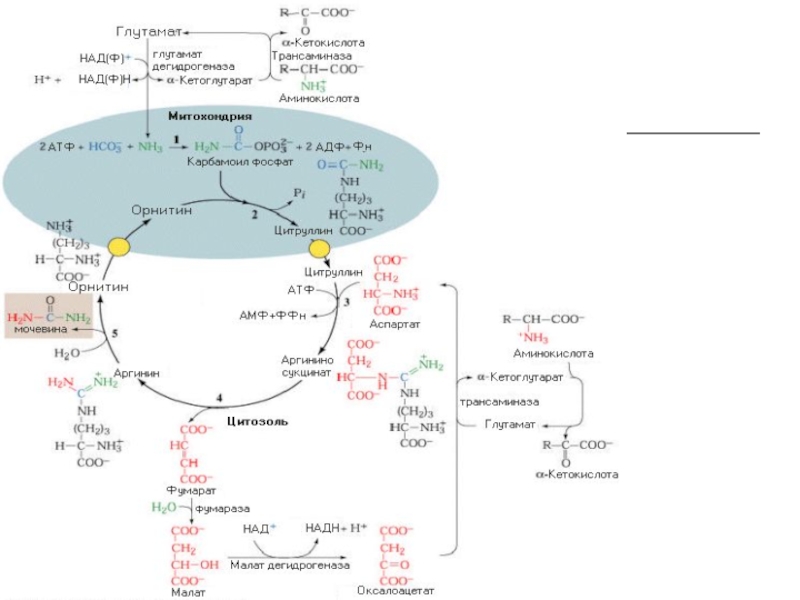
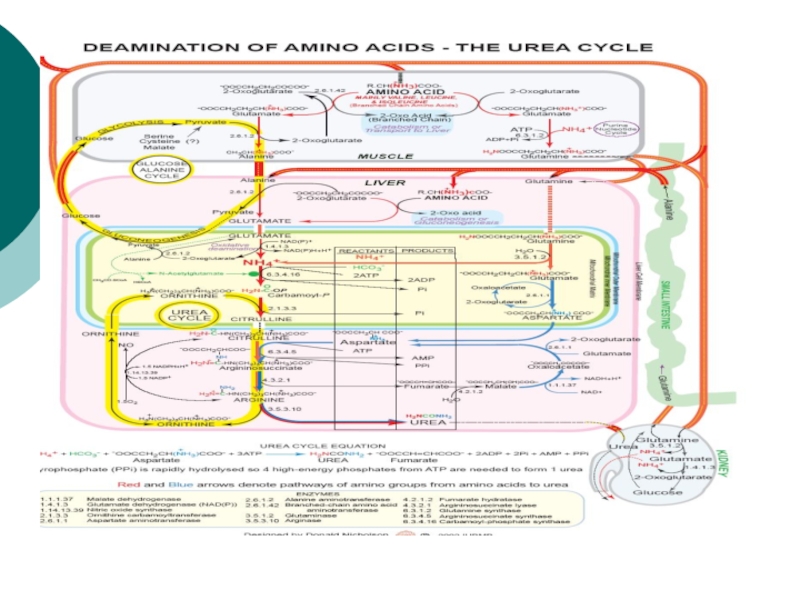
Слайд 44Биосинтез мочевины
Это основной механизм обезвреживания аммиака. 90% азота организма выводится
в виде мочевины (М)., причем ее количество зависит от количества,
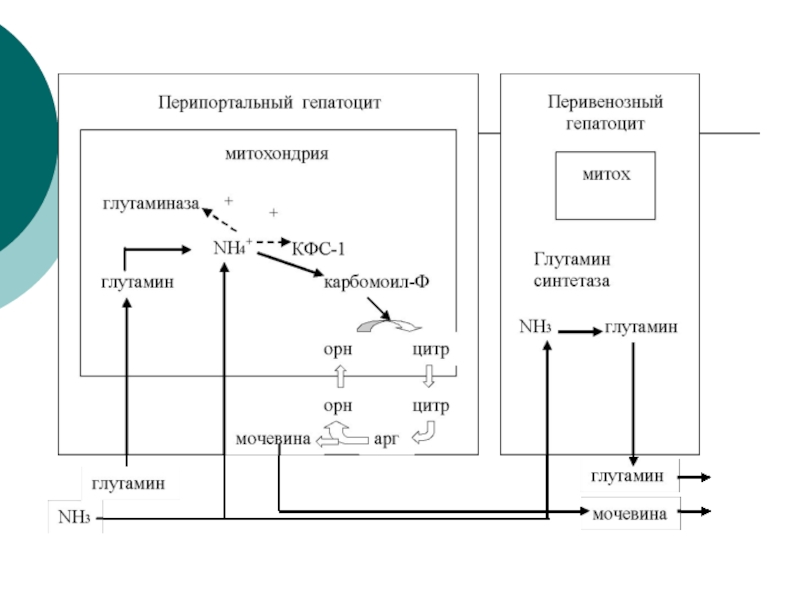
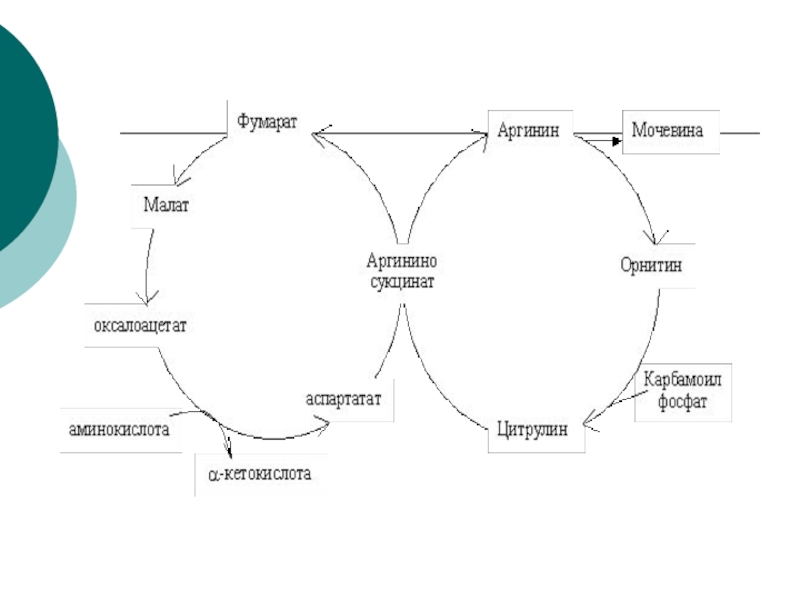
потребляемого белка.. В норме суточное выделение- 25-30г.Слайд 45Орнитиновый цикл синтеза мочевины (ОЦСМ) протекает в гепатоцитах,т.к. них наиболее
высокая активность ферментов азотного обмена.
Первая р-ция катализируется КФС-1. Существует еще
и КФС-2, которая катализирует такую же р-цию в синтезе пиримидинов. Слайд 46 Это еще один путь детоксикации аммиака- синтез пиримидиновых
оснований. Первая и вторая р-ции ЦСМ протекают в МХ. –образуется
цитруллин, затем он выходит в цитоплазму и дальше реакции идут в цитоплазме.Слайд 49 Мочевина- природный антиоксидант, радиопротектор,который взаимодействует с Fe+2, и
останавливает перекисные процессы. Мочевина изменяет структуру воды, как акцептор а/к
защищает мембраны клеток, блокирует протеолиз и тем самым удлиняет жизнь белков.Слайд 50 Энергетическая стоимость ЦСМ
ЦСМ « стоит» 3
молекулы АТФ:
2 АТФ на стадии синтеза карбомоилфосфата и 1
атом на стадии синтеза аргининсукцината.Но фактически в процессе используются 4 макроэргических связи АТФ.
Слайд 512- когда синтез-ся карбомоилфосфат
( АТФ—АДФ- 1 макроэр.
связь)
АТФ—АДФ- 1 макроэр. связь
И 2
при синтезе аргининосукцината (АТФ—АДФ—АМФ) – это еще 2 макроэрга.Слайд 54Биологическая роль ЦСМ
Механизм детоксикации аммиака
Механизм регуляции КЩС( т.к. поставляет СО2.
ЦСМ
поставляет орнитин
Имея митохондриальную локализацию, ЦСМ регулирует потоки а/к по различным
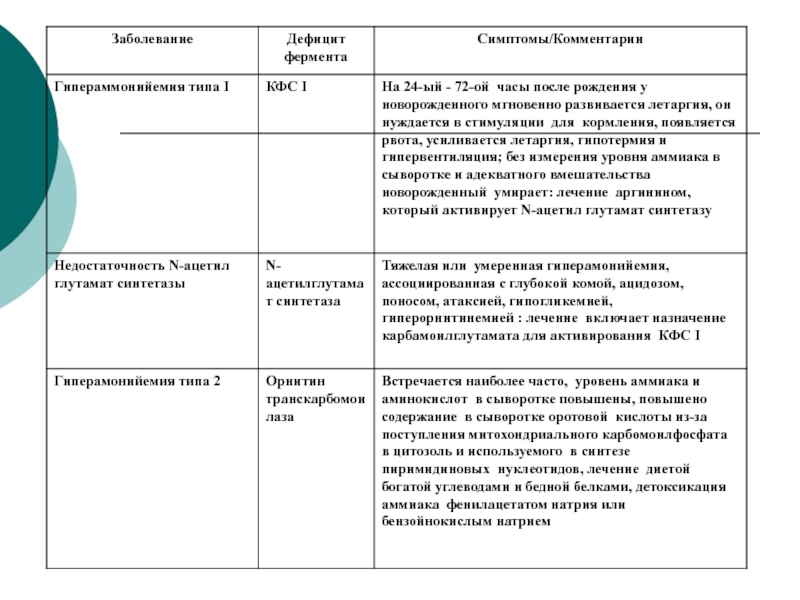
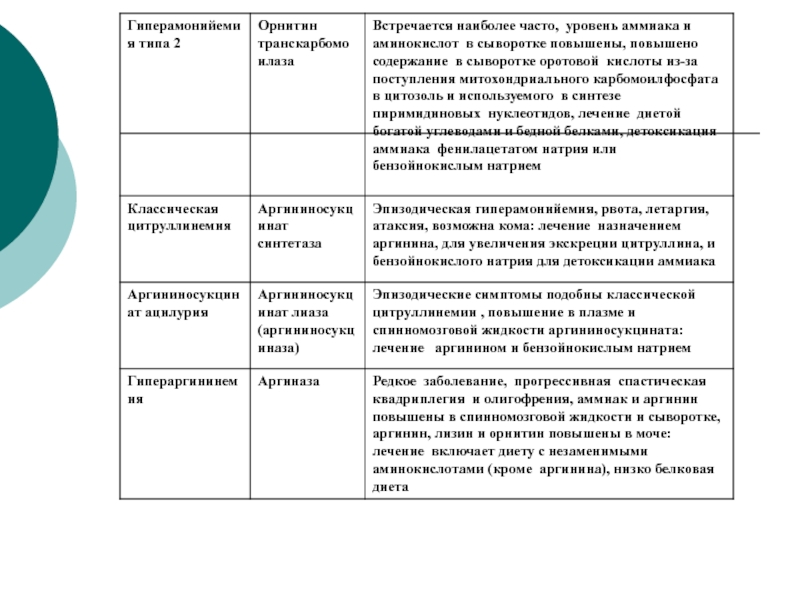
направлениям --- ГНГ, биосинтез белка, липогенез.Слайд 56Врожденные дефекты ЦСМ
Врожденные дефекты ферментов с 1 по
5. Чем ближе ферментный блок к аммиаку, тем тяжелее клиническая
картина.При недостаточности 1 и 2 ферментов- ярко выраженная гипераммнионемия с летальным исходом.
При недостаточности 3- фермента- повышено содержание цитруллина- цитрулинемия.
При недостаточности 4- ф- аргининоянтарная ацидурия.