Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Транспортная РНК (тРНК)
Содержание
- 1. Транспортная РНК (тРНК)
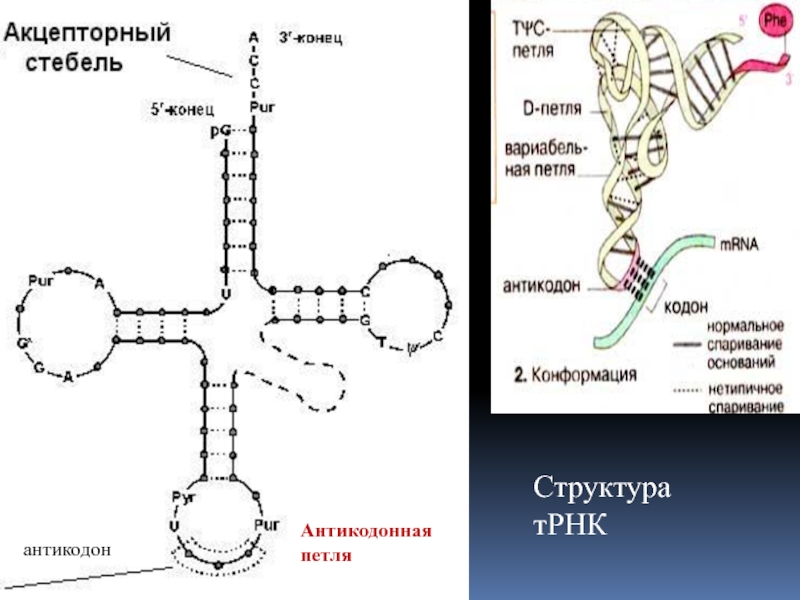
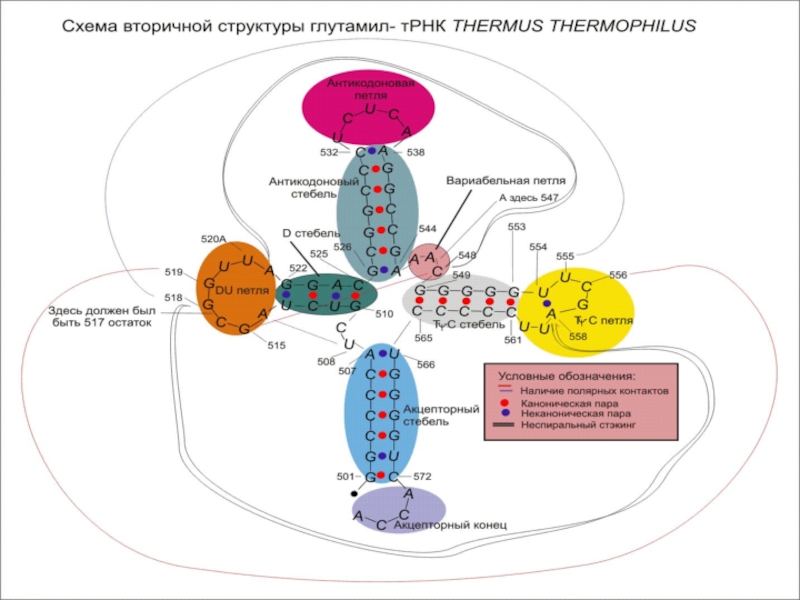
- 2. Структура тРНКАнтикодонная петляантикодон
- 3. Слайд 3
- 4. ФЕРМЕНТЫ АМИНОАЦИЛ-тРНК-СИНТЕТАЗЫ распознают тРНК и подходящую ей аминокислоту; присоединяют к 3΄-концу тРНК соответствующую аминокислоту.
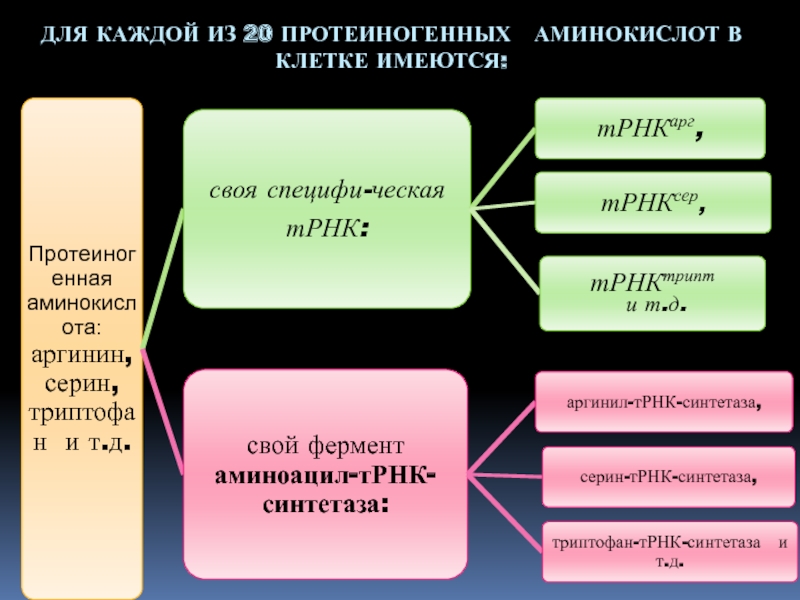
- 5. ДЛЯ КАЖДОЙ ИЗ 20 ПРОТЕИНОГЕННЫХ АМИНОКИСЛОТ В КЛЕТКЕ ИМЕЮТСЯ:
- 6. РИБОСОМНАЯ РНК (рРНК)
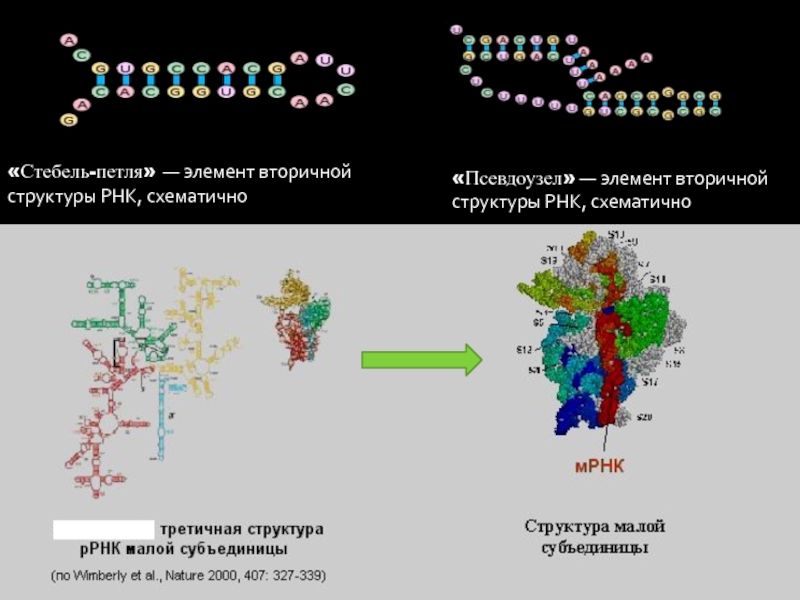
- 7. РИБОСОМНАЯ РНК. «Стебель-петля» — элемент вторичной структуры РНК, схематично«Псевдоузел» — элемент вторичной структуры РНК, схематично
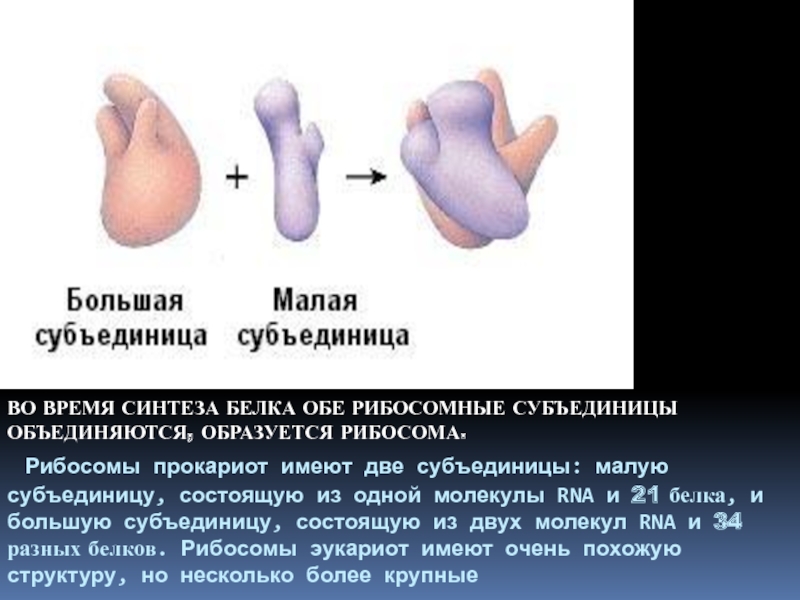
- 8. ВО ВРЕМЯ СИНТЕЗА БЕЛКА ОБЕ РИБОСОМНЫЕ СУБЪЕДИНИЦЫ
- 9. Структура и роль белка
- 10. БЕЛКИ —природные высокомолекулярные полимеры, состоящие
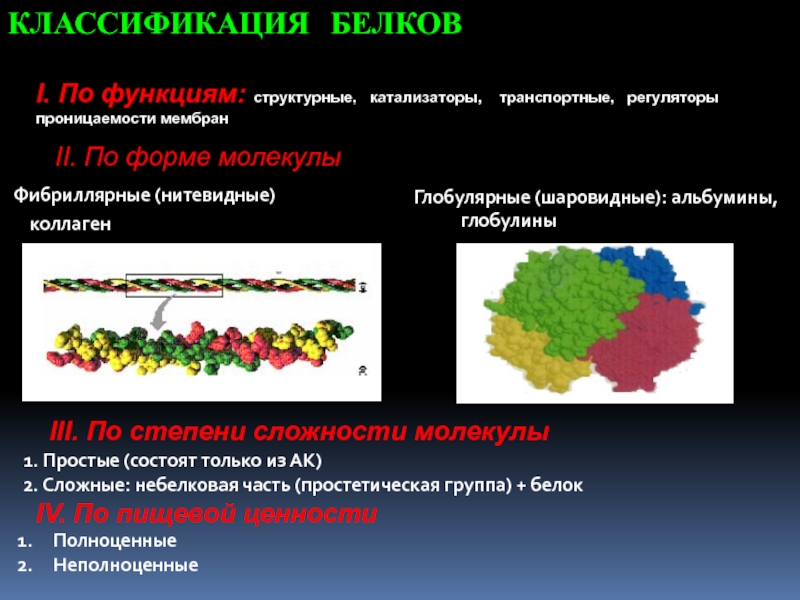
- 11. II. По форме молекулыФибриллярные (нитевидные) коллагенГлобулярные
- 12. ОСНОВНАЯ СТРУКТУРНАЯ ЕДИНИЦА БЕЛКОВ
- 13. ПРОТЕИНОГЕННЫЕ АМИНОКИСЛОТЫ И ИХ ОБОЗНАЧЕНИЯ
- 14. Полярные, незаряженные R-группы L-серин; L-цистеин; L-глутамин;L-треонин; L-метионин; L-аспарагинОтрицательно заряженные R-группыL-глутаминовая
- 15. Слайд 15
- 16. ЗАМЕНИМЫЕ АМИНОКИСЛОТЫ (ДЛЯ ЧЕЛОЕКА)
- 17. ПОЛУЗАМЕНИМЫЕ АМИНОКИСЛОТЫ (ДЛЯ ЧЕЛОВЕКА)
- 18. НЕЗАМЕНИМЫЕ АМИНОКИСЛОТЫ (ДЛЯ ЧЕЛОВЕКА)
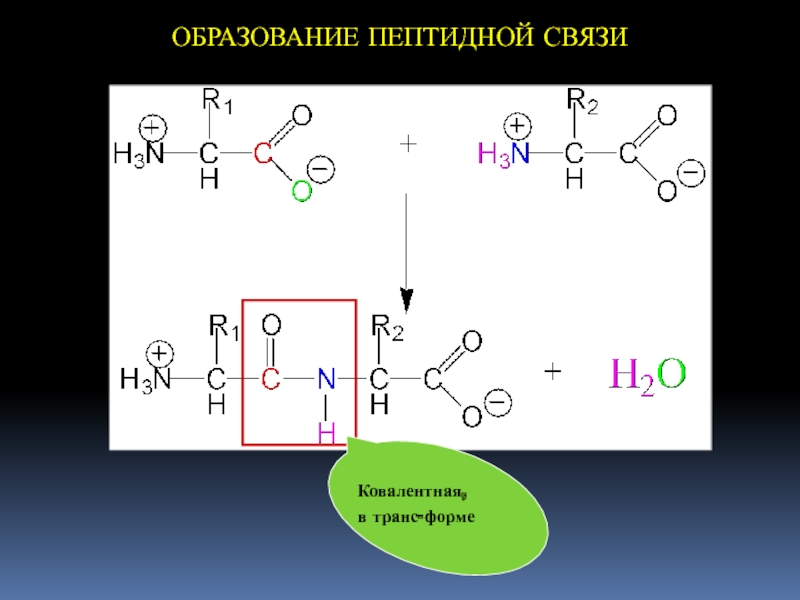
- 19. ОБРАЗОВАНИЕ ПЕПТИДНОЙ СВЯЗИКовалентная, в транс-форме
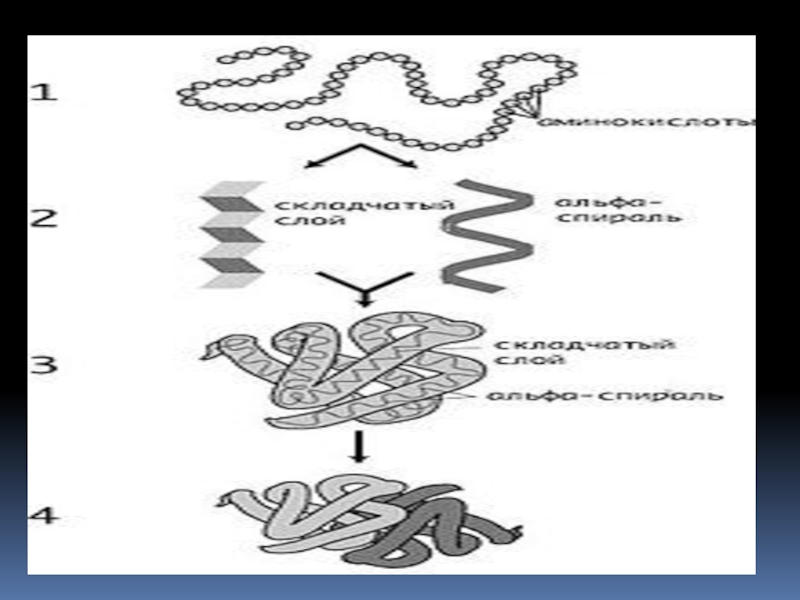
- 20. СТРУКТУРА БЕЛКА
- 21. Первичная структура белка — это
- 22. ВТОРИЧНАЯ СТРУКТУРА БЕЛКА – это локальная конформация
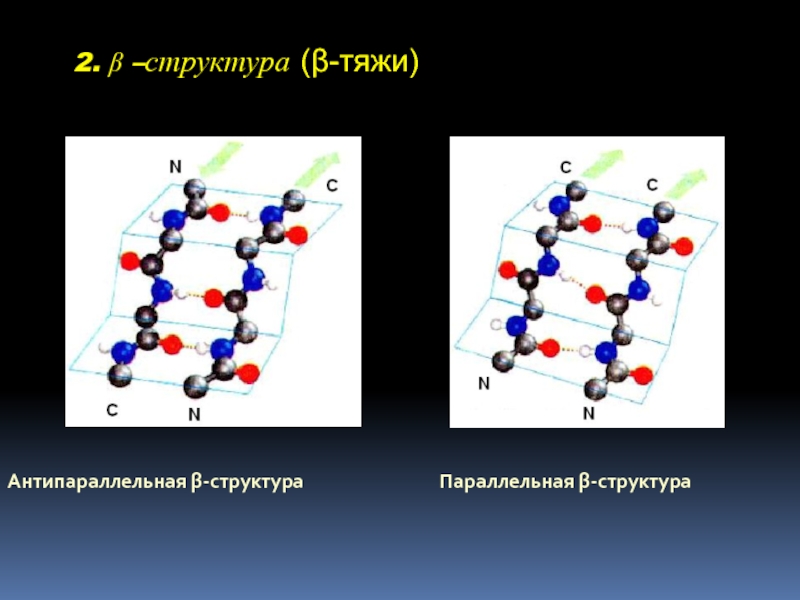
- 23. 2. β –структура (β-тяжи) Антипараллельная β-структура Параллельная β-структура
- 24. ТРЕТИЧНАЯ СТРУКТУРА (нативная) – расположение в пространстве
- 25. Фибриллярные (нитевидные) Глобулярные (шаровидные)два общих типа третичной структуры белков:тройная α-спираль (коллаген)β-складчатые структуры (прионы)альбумины, глобулины
- 26. ЧЕТВЕРТИЧНАЯ СТРУКТУРА – объединение нескольких полипептидных цепей,
- 27. ПРЕИМУЩЕСТВА белков с четвертичной структуройЭкономия генетического материала
- 28. Слайд 28
- 29. СИНТЕЗ БЕЛКА В КЛЕТКАХ РАЗЛИЧНЫХ ОРГАНИЗМОВСинтез белка
- 30. ГЕНЕТИЧЕСКИЙ КОД (ПО мРНК) НИРЕНБЕРГ М.
- 31. 1. У прокариот кодон AUG должен находиться
- 32. ТРАНСЛЯЦИЯ. ЭТАПЫ (БИОСИНТЕЗ БЕЛКА)
- 33. 1 этап. Инициация трансляции1. Активация инициаторной аминокислоты
- 34. 1 этап. продолжение2. Аминоациладенилат (метионинаденилат) соединяется с
- 35. 3. Перенос Мet-тРНК на малую рибосомную субъединицу.
- 36. Инициаторный комплекс. Рибосома
- 37. 2 ЭТАП. ЭЛОНГАЦИЯ (БИОСИНТЕЗ ПОЛИПЕПТИДНОЙ ЦЕПИ)Элонгация осуществляется
- 38. ЭЛОНГАЦИЯ
- 39. По мере синтеза белка последовательность кодонов mRNA
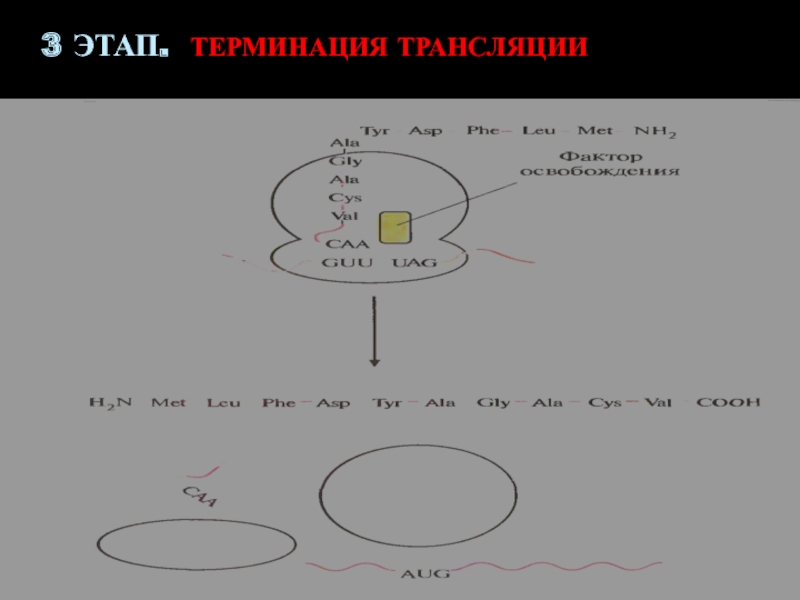
- 40. 3 ЭТАП. ТЕРМИНАЦИЯ ТРАНСЛЯЦИИстоп-кодоны (триплеты UAA, UAG
- 41. 3 ЭТАП. ТЕРМИНАЦИЯ ТРАНСЛЯЦИИ
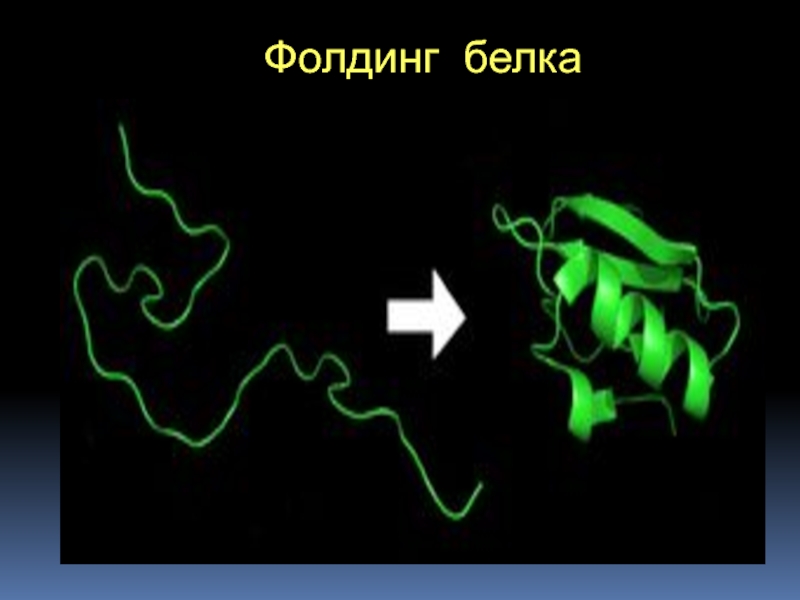
- 42. Фолдинг белка
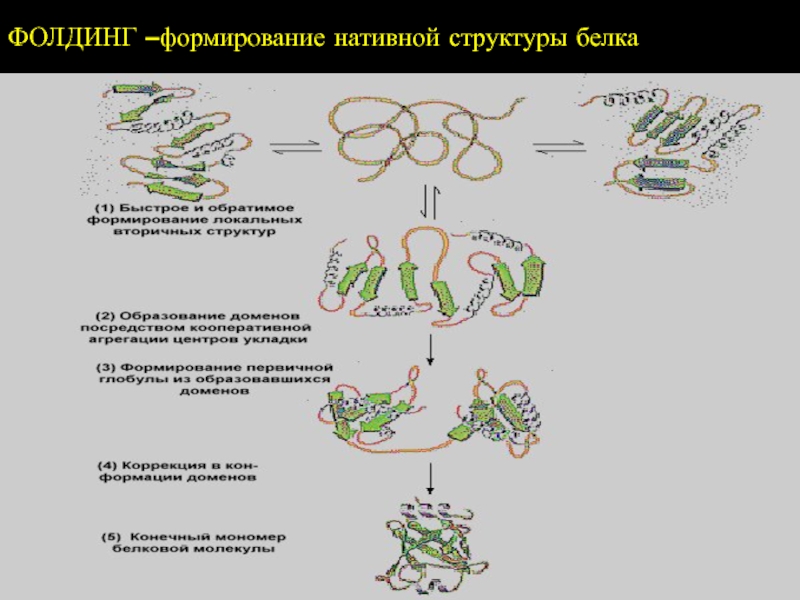
- 43. ФОЛДИНГ –формирование нативной структуры белка
- 44. Вся информация о третичной структуре белка (не
- 45. Скачать презентанцию
Слайды и текст этой презентации
Слайд 4ФЕРМЕНТЫ
АМИНОАЦИЛ-тРНК-СИНТЕТАЗЫ
распознают тРНК и подходящую ей аминокислоту;
присоединяют к
3΄-концу тРНК соответствующую аминокислоту.
Слайд 7РИБОСОМНАЯ РНК.
«Стебель-петля» — элемент вторичной структуры РНК, схематично
«Псевдоузел» — элемент вторичной
структуры РНК, схематично
Слайд 8ВО ВРЕМЯ СИНТЕЗА БЕЛКА ОБЕ РИБОСОМНЫЕ СУБЪЕДИНИЦЫ ОБЪЕДИНЯЮТСЯ, ОБРАЗУЕТСЯ РИБОСОМА.
Рибосомы прокариот имеют две субъединицы: малую субъединицу, состоящую из одной
молекулы RNA и 21 белка, и большую субъединицу, состоящую из двух молекул RNA и 34 разных белков. Рибосомы эукариот имеют очень похожую структуру, но несколько более крупныеСлайд 10 БЕЛКИ —природные высокомолекулярные полимеры, состоящие из аминокислотных остатков,
соединенных пептидной связью.
Белки являются главной составной частью живых организмов и
молекулярной основой процессов жизнедеятельностиУсловно:
2 — 10 амкт — олигопептиды
<80 амкт — полипептиды
>80 амкт — белки
Слайд 11II. По форме молекулы
Фибриллярные (нитевидные)
коллаген
Глобулярные (шаровидные): альбумины, глобулины
КЛАССИФИКАЦИЯ
БЕЛКОВ
I. По функциям: структурные, катализаторы, транспортные, регуляторы
проницаемости мембран III. По степени сложности молекулы
1. Простые (состоят только из АК)
2. Сложные: небелковая часть (простетическая группа) + белок
IV. По пищевой ценности
Полноценные
Неполноценные
Слайд 14
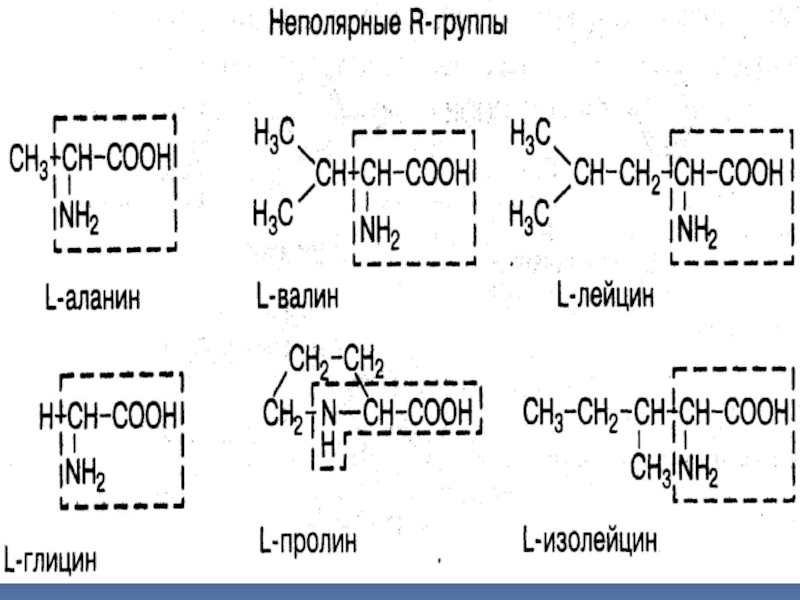
Полярные, незаряженные R-группы
L-серин; L-цистеин; L-глутамин;
L-треонин; L-метионин; L-аспарагин
Отрицательно заряженные R-группы
L-глутаминовая к-та; L-аспарагиновая к-та
Положительно заряженные
R-группы
L-лизин; L-гистидин, L-аргинин
Ароматические R-группы
L-фенилаланин; L—тирозин; L-триптофан
КЛАССИФИКАЦИЯ АМИНОКИСЛОТ ПО ХАРАКТЕРУ R-ГРУППЫ
Слайд 21
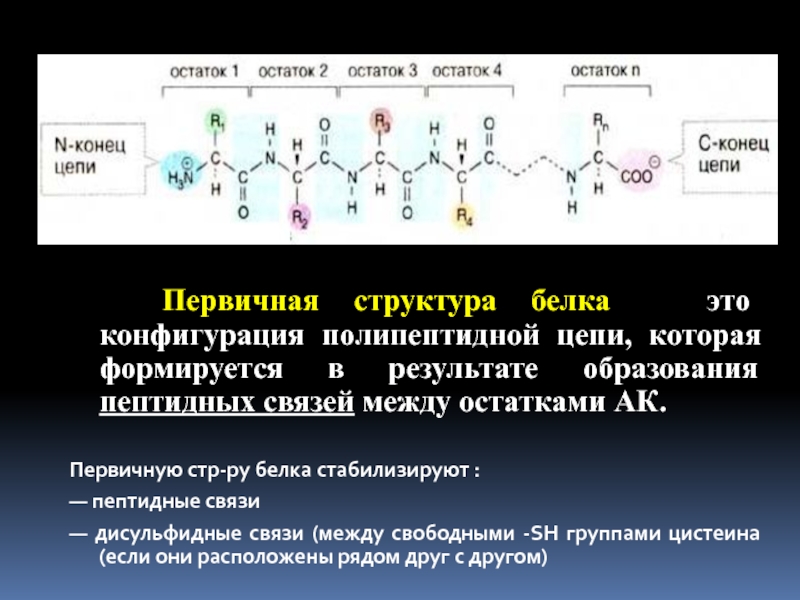
Первичная структура белка — это конфигурация полипептидной цепи,
которая формируется в результате образования пептидных связей между остатками АК.
Первичную
стр-ру белка стабилизируют :— пептидные связи
— дисульфидные связи (между свободными -SH группами цистеина (если они расположены рядом друг с другом)
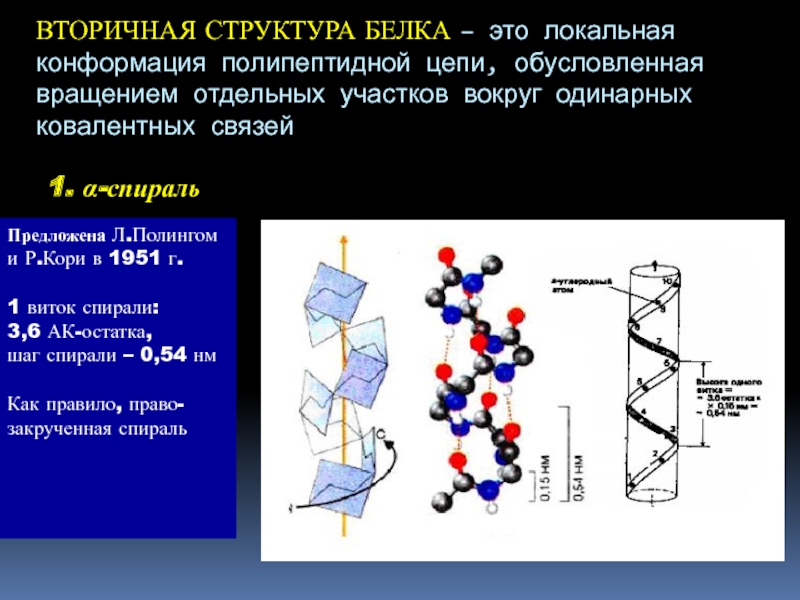
Слайд 22ВТОРИЧНАЯ СТРУКТУРА БЕЛКА – это локальная конформация полипептидной цепи, обусловленная
вращением отдельных участков вокруг одинарных ковалентных связей
1. α-спираль
Предложена Л.Полингом и
Р.Кори в 1951 г. 1 виток спирали:
3,6 АК-остатка,
шаг спирали – 0,54 нм
Как правило, право-
закрученная спираль
Слайд 24ТРЕТИЧНАЯ СТРУКТУРА (нативная) – расположение в пространстве всей полипептидной цепи,
отдельные участки которой имеют локальную конформацию, т.е. сохраняют α-спиральную или
β-структурную форму.СТАБИЛИЗИРУЕТСЯ взаимодействиями между боковыми радикалами аминокислотных остатков разных участков полипептидной цепи
- Гидрофобные – определяющие взаимодействия
- Ионные
- Электростатические
- Дисульфидные
Водородные
Третичная структура обеспечивает проявление белком функциональной активности.
Фибриллярные белки. Глобулярные белки
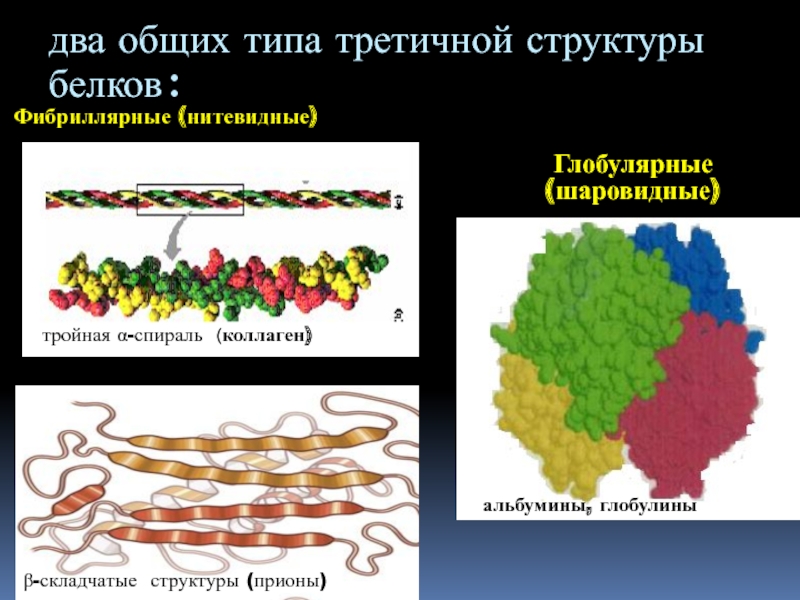
Слайд 25Фибриллярные (нитевидные)
Глобулярные (шаровидные)
два общих типа третичной структуры белков:
тройная
α-спираль (коллаген)
β-складчатые структуры (прионы)
альбумины, глобулины
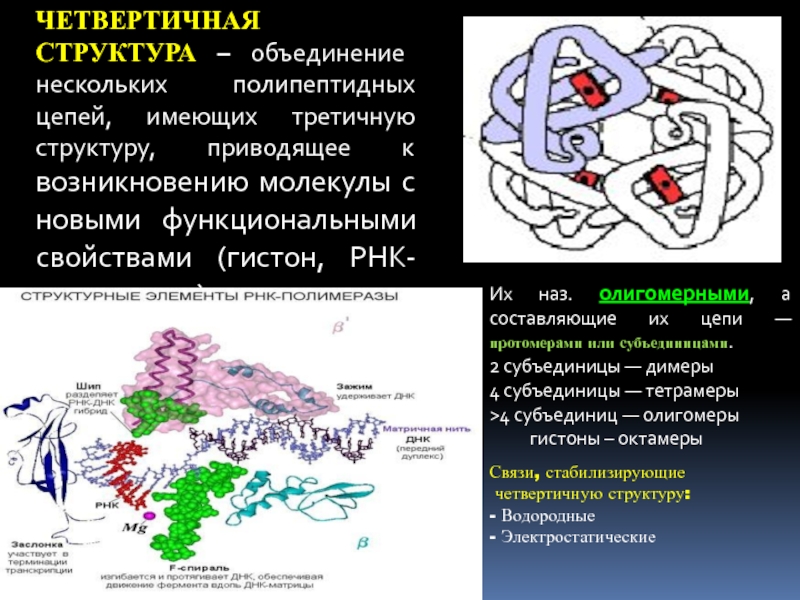
Слайд 26ЧЕТВЕРТИЧНАЯ СТРУКТУРА – объединение нескольких полипептидных цепей, имеющих третичную структуру,
приводящее к возникновению молекулы с новыми функциональными свойствами (гистон, РНК-полимераза)
Их
наз. олигомерными, а составляющие их цепи — протомерами или субъединицами.2 субъединицы — димеры
4 субъединицы — тетрамеры
>4 субъединиц — олигомеры
гистоны – октамеры
Связи, стабилизирующие
четвертичную структуру:
- Водородные
- Электростатические
Слайд 27ПРЕИМУЩЕСТВА белков с четвертичной структурой
Экономия генетического материала
2. Уменьшение числа
ошибок при синтезе белка
3. Качественное разнообразие белков. Кооперативный эффект субъединиц.
Слайд 29СИНТЕЗ БЕЛКА В КЛЕТКАХ РАЗЛИЧНЫХ ОРГАНИЗМОВ
Синтез белка сводится не к
переписыванию информации, а к переходу от одной системы информации (нуклеотидная
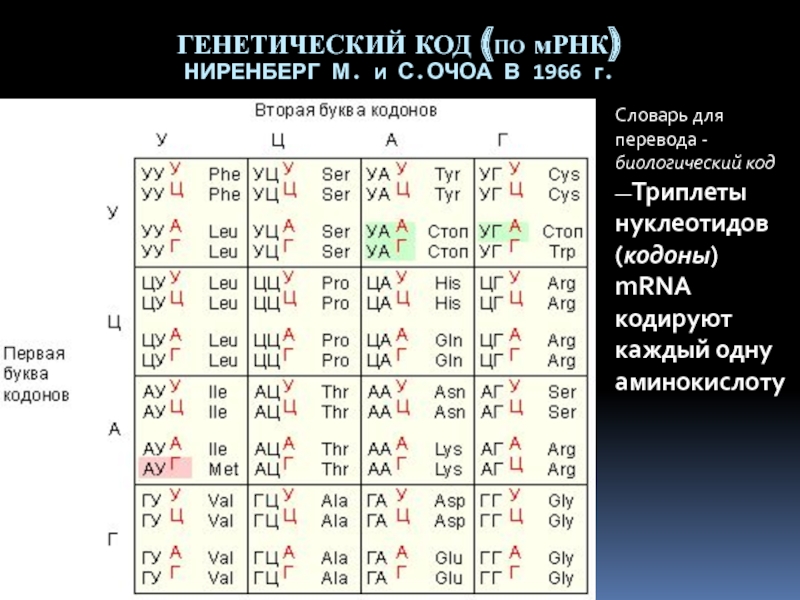
последовательность — четырехбуквенный язык) к другой (аминокислотная последовательность — двадцатибуквенный язык). Это объясняет, почему третий матричный синтез называют трансляцией..Слайд 30ГЕНЕТИЧЕСКИЙ КОД (ПО мРНК) НИРЕНБЕРГ М. И С.ОЧОА В 1966
г.
Словарь для перевода - биологический код —Триплеты нуклеотидов (кодоны) mRNA
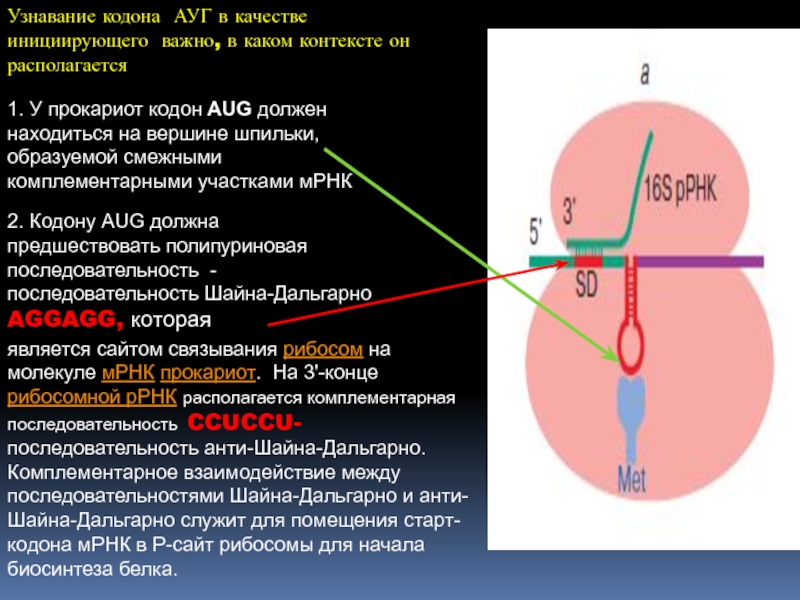
кодируют каждый одну аминокислотуСлайд 311. У прокариот кодон AUG должен находиться на вершине шпильки,
образуемой смежными комплементарными участками мРНК
Узнавание кодона АУГ в качестве
инициирующего важно, в каком контексте он располагается2. Кодону AUG должна предшествовать полипуриновая последовательность - последовательность Шайна-Дальгарно AGGAGG, которая
является сайтом связывания рибосом на молекуле мРНК прокариот. На 3'-конце рибосомной рРНК располагается комплементарная последовательность CCUCCU- последовательность анти-Шайна-Дальгарно. Кoмплементарное взаимодействие между последовательностями Шайна-Дальгарно и анти-Шайна-Дальгарно служит для помещения старт-кодона мРНК в P-сайт рибосомы для начала биосинтеза белка.
Слайд 331 этап. Инициация трансляции
1. Активация инициаторной аминокислоты . Метионин при
участии ферментов связывается с АТФ. Образуется Мet- АДЕНИЛАТ (аминоацил-аденилат, здесь
- метионинаденилат)Активация свободных аминокислот осуществляется при помощи специфических ферментов – аминоацил-тРНК-синтетаз – в присутствии АТФ.
На I стадии аминокислота вступает в реакцию с АТФ, при этом освобождается пиро-фосфат и образуется промежуточный продукт
Аминокислота присоединяется к свободному концевому 2'-ОН АМФ.
Слайд 341 этап. продолжение
2. Аминоациладенилат (метионинаденилат) соединяется с тРНК мет при
помощи фермента аминоацил-тРНК-синтетазы (метионин-тРНКсинтетазы). Образуется АМИНОАЦИЛ-тРНК (Мet-тРНК ), свобождается АМФ.
Обе
стадии катализируются одним и тем же ферментомАминокислота присоединяется к свободному концевому 3'-ОН-гидроксилу рибозы тРНК
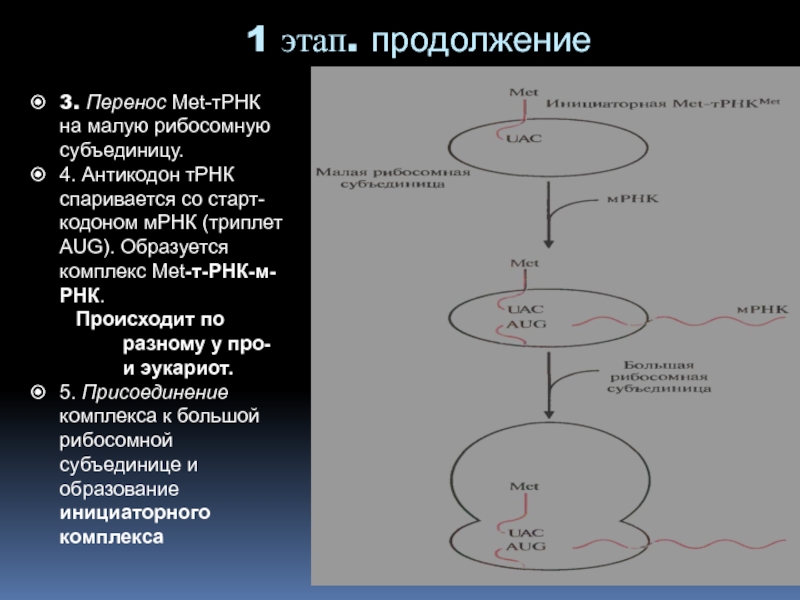
Слайд 353. Перенос Мet-тРНК на малую рибосомную субъединицу.
4. Антикодон тРНК
спаривается со старт-кодоном мРНК (триплет AUG). Образуется комплекс Met-т-РНК-м-РНК.
Происходит
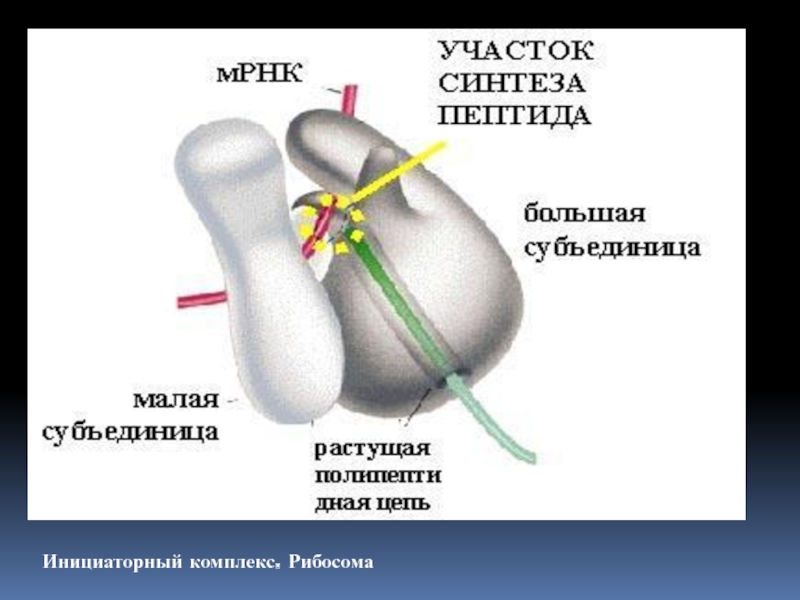
по разному у про- и эукариот. 5. Присоединение комплекса к большой рибосомной субъединице и образование инициаторного комплекса
1 этап. продолжение
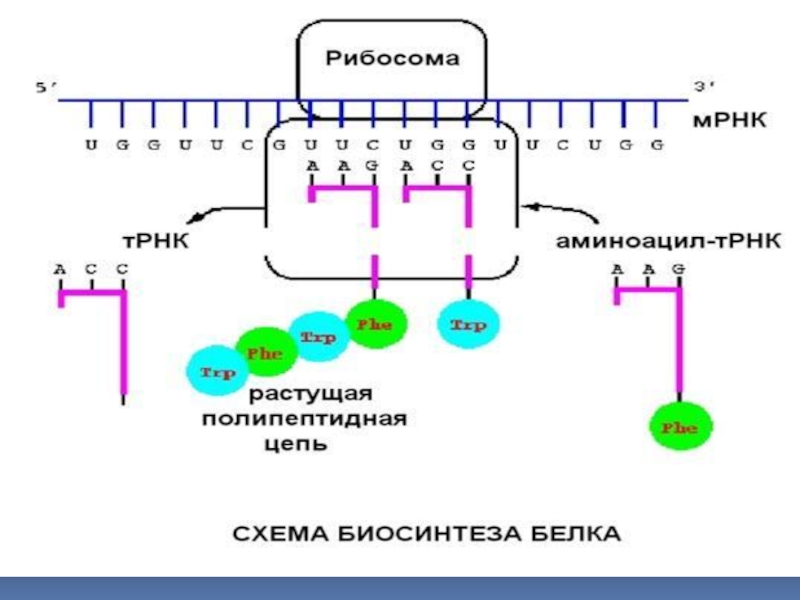
Слайд 372 ЭТАП. ЭЛОНГАЦИЯ (БИОСИНТЕЗ ПОЛИПЕПТИДНОЙ ЦЕПИ)
Элонгация осуществляется при помощи белков
цитозоля (факторов элонгации). Формирование пептидной связи между соседними аминокислотами катализируется
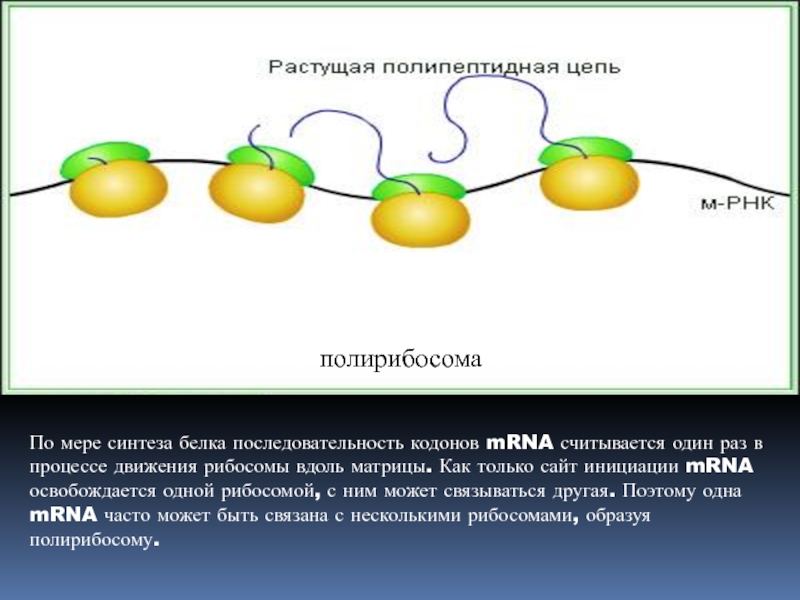
рибосомальной пептидилтрансферазой.Слайд 39По мере синтеза белка последовательность кодонов mRNA считывается один раз
в процессе движения рибосомы вдоль матрицы. Как только сайт инициации
mRNA освобождается одной рибосомой, с ним может связываться другая. Поэтому одна mRNA часто может быть связана с несколькими рибосомами, образуя полирибосому.полирибосома
Слайд 403 ЭТАП. ТЕРМИНАЦИЯ ТРАНСЛЯЦИИ
стоп-кодоны (триплеты UAA, UAG или UGA) прекращают
процесс элонгации
Присоединение к рибосоме БЕЛКОВОГО ФАКТОРА ОСВОБОЖДЕНИЯ (РАСПОЗНАЕТ СТОП-КОДОН И
ПРИСОЕДИНЯЕТСЯ К РИБОСОМЕ)Происходит гидролиз (разрушение) связей между последней тРНК, полипептидом и мРНК
РАСПАД РИБОСОМЫ НА СУБЪЕДИНИЦЫ
Слайд 44Вся информация о третичной структуре белка (не имеющего небелкового компонента)
заключена в его первичной структуре;
Белок не только «знает», какую конформацию
принять, но и делает это самопроизвольноЭто правило соблюдается только для некоторых малых белков!
Для правильной пространственной сборки большинства белков необходимы специальные белки – шапероны и ферменты фолдазы
Они не определяют, какой должна быть пространственная структура белка (т.е. не являются «инструкторами»), но создают условия для ее быстрого формирования