Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Уральский государственный аграрный университет д.х.н., проф. Хонина Татьяна
Содержание
- 1. Уральский государственный аграрный университет д.х.н., проф. Хонина Татьяна
- 2. План лекции Введение. Предмет науки химия. Основные
- 3. п1. Введение. Предмет науки химия. Основные
- 4. 4п.2. Строение вещества. Строение атома. Качественная и
- 5. Особенности микромираКвантование энергии: энергия микрообъекта изменяется не
- 6. 6п. 3. Строение электронных оболочек атомов. Квантовые
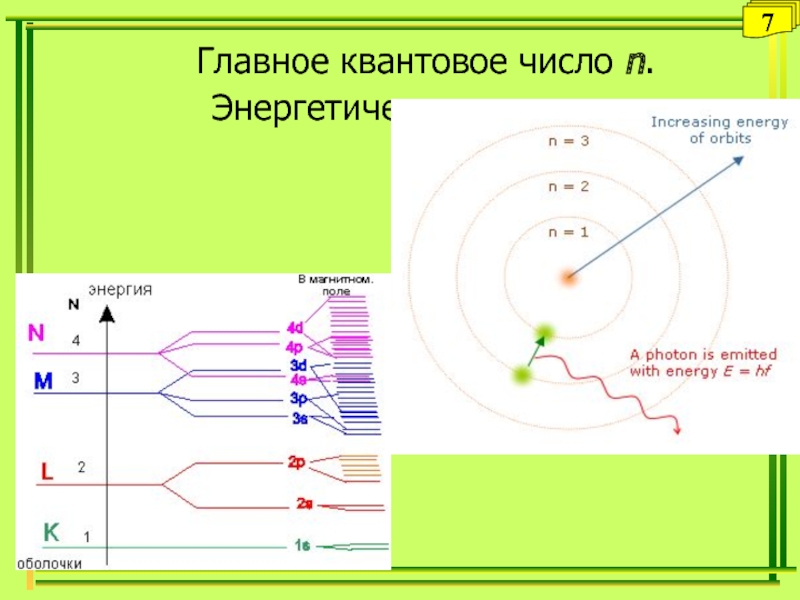
- 7. Главное квантовое число n.Энергетические уровни7
- 8. Орбитальное квантовое число l. Энергетические подуровни. Формы
- 9. Формы электронных орбиталей9
- 10. Магнитное квантовое число (ml) ml =
- 11. Формы электронных орбиталей11
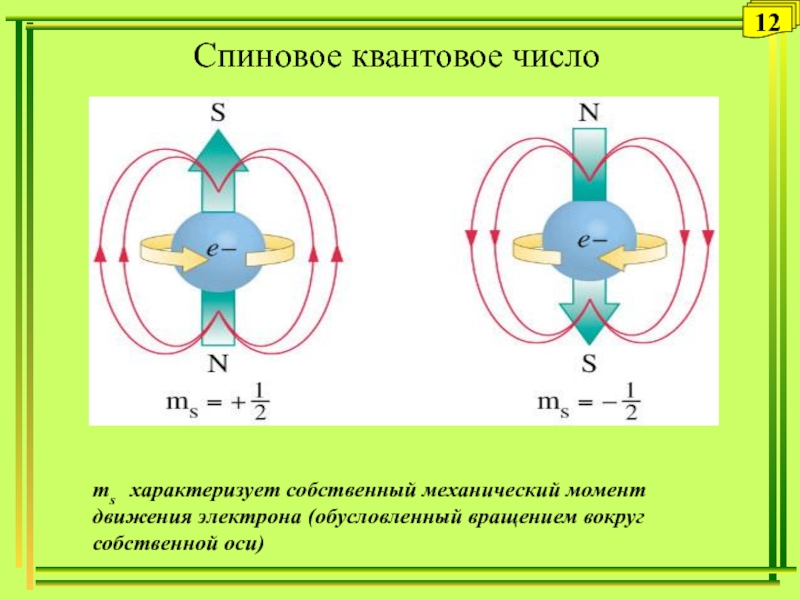
- 12. Спиновое квантовое число s12ms характеризует собственный механический момент движения электрона (обусловленный вращением вокруг собственной оси)
- 13. Периодическая таблица Д.И. Менделеева13
- 14. 14 п.4. Правила составления электронных формул
- 15. Правило КлечковскогоКлечковский Всеволод Маврикиевич (1900 -1972) Россия,
- 16. 16Электронная формула (конфигурация) атома 1H:
- 17. Вольфганг Эрнст Паули (1900 – 1958)Австрия, 1940
- 18. Фридрих Хунд(1896 – 1997)Германия\Правило Хунда:При данном значении
- 19. 19п.5. Химические (окислительные, восстановительные) свойства
- 20. Периодическая таблица Д.И. Менделеева20
- 21. Литература Кафедра химии УрГАУ/ ВКонтактеVk.com/club86527277 Тел кафедры: 221-41-03 1.
- 22. 22Вопросы к экзамену по общей и неорганической
- 23. 23Вопросы к экзамену (продолжение)10. Основные законы химии:
- 24. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Уральский государственный
аграрный университет
д.х.н., проф. Хонина Татьяна Григорьевна
Введение в общеобразовательную
научную дисциплину ХИМИЯ
Слайд 2План лекции
Введение. Предмет науки химия. Основные разделы и понятия.
Материя, вещество. Физические и химические свойства вещества.
Строение вещества. Строение атома.
Качественная и количественная характеристика состава атомов. 3. Строение электронных оболочек атомов. Квантовые числа. Энергетические уровни и подуровни, атомные электронные орбитали.
4. Правила составления электронных формул и схем строения электронных оболочек атомов (принцип минимальной энергии, правила Клечковского, Хунда, принцип Паули).
5. Химические (окислительные, восстановительные) свойства атомов химических элементов и порядок их определения.
2
Слайд 3 п1. Введение. Предмет науки химия. Основные разделы и понятия.
Материя, вещество. Физические и химические свойства вещества Химия –
наука, изучающая состав, строение и свойства вещества Основные понятия химии Материя, вещество Простые и сложные вещества Физические и химические свойства вещества Разделы химии Молекула – наименьшая частица простого или сложного вещества, сохраняющая его химические свойства Атом – наименьшая частица простого вещества, сохраняющая его химические свойства3
Слайд 44
п.2. Строение вещества. Строение атома. Качественная и
количественная характеристика состава атомов
Квантово- механическая модель атома
Атом – сложная
система взаимодействующих элементарных частиц, состоящая из ядра и электронной оболочкиЯдро атома –сложное образование, состоящее из положительно заряженных элементарных частиц – протонов и нейтральных (незаряженных) – нейтронов
Совокупность атомов с одинаковым зарядом ядра называется химическим элементом (118)
Изотопы – атомы химических элементов, имеющие одинаковый заряд ядра (число протонов), но различное число нейтронов.
Слайд 5Особенности микромира
Квантование энергии: энергия микрообъекта изменяется не непрерывно, а дискретно,
порциями (квантами)
Корпускулярно-волновой дуализм микрообъекта – сочетание свойств частицы и волны
Вероятностный
подход к описанию процессов микромира5
Слайд 66
п. 3. Строение электронных оболочек атомов. Квантовые числа. Энергетические
уровни и подуровни, атомные электронные орбитали
Квантовые числа
Главное квантовое число
(n) – характеризует уровень энергии электрона (энергетический уровень Eур.) и средние размеры электронной оболочки. Чем меньше значение n, тем меньше энергия уровня и средний размер электронной оболочки. Орбитальное квантовое число (l) – характеризует подуровень энергии электрона (энергетический подуровень Eподур.) и форму электронного облака. Чем меньше значение l, тем меньше энергия подуровня. Форма электронных облаков различна: s, p, d и f – электроны.
Магнитное квантовое число (ml ) – характеризует ориентацию электронного облака (s, p, d и f) в атомном пространстве .
Спиновое квантовое число (ms ) характеризует собственный механический момент движения электрона
Слайд 8Орбитальное квантовое число l. Энергетические подуровни. Формы электронных орбиталей l =
0, 1, 2, 3…… (n-1) Значения l Обозначения атомных
электронных орбиталей (и электронов) 0 s 1 p 2 d 3 f l характеризует энергию электрона данного подуровня и форму атомной электронной орбитали8
Слайд 10Магнитное квантовое число (ml) ml = -l…… -1, 0, +1……+l Значения l
Значения ml
10
ml характеризует ориентацию электронной орбитали в атомном пространстве; число орбиталей равно количеству значений ml для каждого энергетического подуровня.
Слайд 12Спиновое квантовое число
s
12
ms характеризует собственный механический момент движения
электрона (обусловленный вращением вокруг собственной оси)
Слайд 14
14
п.4. Правила составления электронных формул и схем строения
электронных оболочек атомов (принцип минимальной энергии, правила Клечковского, Хунда, принцип
Паули).Электронная формула атома – это условная запись, в которой все электроны атома распределены по энергетическим уровням и подуровням
1H 1s1 2He 1s2
10Ne 1s22s22p6 18Ar 1s22s22p6 3s23p6
22Ti 1s22s22p6 3s23p6 4s23d2
Слайд 15
Правило Клечковского
Клечковский
Всеволод Маврикиевич
(1900 -1972)
Россия, 1961
Правило Клечковского:
Электрон занимает
в основном состоянии
уровень не с минимально возможным значением n,
а с наименьшим значением суммы (n + l ). Энергетические подуровни с одинаковыми значениями (n + l) заполняются по мере увеличения значения n:1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p
(n+l): 1 2 3 3 4 4 5 5 5 6 6 6 7 7 7 7 8 8 8
l=0 (s) l=1 (p) l=2 (d) l=3 (f)
15
Слайд 16
16
Электронная формула (конфигурация) атома
1H: 1s1
2He: 1s2
10Ne: 1s22s22p6 18Ar: 1s22s22p6 3s23p6
22Ti 1s22s22p6 3s23p6 4s23d2
118 Og: 1s2 2s22p6 3s23p6 4s23d104p6 5s24d10 5p6
6s24f14 5d106p6
7s25f146d10 7p6
118 Og: [Rn]
7s25f146d10 7p6
Слайд 17
Вольфганг Эрнст Паули
(1900 – 1958)
Австрия, 1940
Лауреат нобелевской премии
(1945)
Принцип Паули:
В атоме не может быть двух
электронов, у которых все четыре квантовых числа были бы одинаковы. Электроны должны различаться значениями хотя бы одного квантового числа.17
Слайд 18
Фридрих Хунд
(1896 – 1997)
Германия
\
Правило Хунда:
При данном значении l (т. е.
в пределах определенного энергетического подуровня) электроны располагаются таким образом, чтобы
их суммарный спин был максимальным.18
Слайд 19
19
п.5. Химические (окислительные, восстановительные) свойства атомов химических элементов
и порядок их определения
Окислители и восстановители
1. Атомы, имеющие на
наружном энергетическом уровне1,2,3 и реже 4 электрона, участвуя в химических реакциях, отдают эти электроны другим атомам и превращаются в положительно заряженные ионы, проявляя при этом восстановительные свойства (или металлические)2. Атомы, имеющие на наружном энергетическом уровне 7, 6, 5 и реже 4 электрона, участвуя в химических реакциях, принимают от других атомов недостающие до 8 число электронов и превращаются в отрицательно заряженные ионы, проявляя при этом окислительные свойства (или неметаллические)
Слайд 21Литература
Кафедра химии УрГАУ/ ВКонтакте
Vk.com/club86527277
Тел кафедры: 221-41-03
1. О.С. Габриелян и
др. Химия. Учебное пособие/.
М.: Академия, 2012.
2. И.К. Циткович. Курс
аналитической химии. – Изд. “Лань”, 2007.
3. И.И. Грандберг. Н.Л. Нам. Органическая химия.-
Дрова, 2009.
Дополнительная:
Г.П. Хомченко, И.К. Циткович. Неорганическая
химия. – М.. Высшая школа, 2009.
Методические указания для самостоятельной работы
21
Слайд 2222
Вопросы к экзамену
по общей и неорганической химии
1. Понятия: материя,
вещество. Предмет науки химия
2. Качественная и количественная характеристика состава атомов
3.
Строение электронных оболочек атомов. Квантовые числа. Энергетические уровни и подуровни, атомные электронные орбитали.4. Правила составления электронных формул и схем строения электронных оболочек атомов (принцип минимальной энергии, правила Клечковского, Хунда, принцип Паули)
5. Химические (окислительные, восстановительные) свойства атомов химических элементов и порядок их определения
6. Сущность периодического закона. Причина периодической повторяемости химических свойств и количественных характеристик атомов с увеличение зарядов их ядер
7. Строение периодической системы химических элементов Д.И.Менделеева. Характер и причины изменения металлических и неметаллических свойств, радиусов, энергии ионизации, энергии сродства к электрону, электроотрицательности атомов в периодах и группах периодической системы
8. Основные типы химической связи (ковалентная, ионная, металлическая), механизм их образования и свойства
9. Классы сложных неорганических соединений. Состав, номенклатура, химические свойства и реакции оксидов, кислот, оснований и солей
Слайд 2323
Вопросы к экзамену (продолжение)
10. Основные законы химии: закон сохранения массы
вещества, закон постоянства состава вещества, закон Авогадро и два следствия
из него. Применение этих законов для вычисления состава, массы и объема веществ11. Основы термохимии. Тепловой эффект химической реакции, изменение энтальпии химической реакции. Закон Гесса. Пример расчета изменения энтальпии реакции
12. Понятия скорости гомогенной и гетерогенной реакций. Зависимость скорости химической реакции от концентрации реагирующих веществ, давления, температуры. Закон действия масс, правило Вант-Гоффа.
13. Сущность химического равновесия и условие его наступления. Константа химического равновесия. Определение направления смещение химического равновесия в соответствии с принципом Ле Шателье.
14. Понятие раствор. Типы растворов. Способы выражения состава (концентрации) растворов
15. Теория электролитической диссоциации. Степень и константа диссоциации. Сильные и слабые электролиты
16. Диссоциация воды, ионное произведение воды. Водородный показатель. Шкала рН растворов
17. Реакции ионного обмена, условия их протекания. Порядок составления ионных уравнений
18. Гидролиз солей
19. Сущность окислительно-восстановительных реакций и условие их протекания. Степени окисления атомов и порядок их определения. Составление уравнений окислительно-восстановительных реакции на основе метода электронного баланса
20. Комплексные соединения металлов, их состав и поведение (устойчивость) в растворах. Константа нестойкости комплексных ионов.
21. Химия s,p,d- и f-элементов таблицы Менделеева
22. Химия биогенных элементов. Понятие о микроэлементах.