Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Уральский государственный аграрный университет д.х.н., проф. Хонина Татьяна
Содержание
- 1. Уральский государственный аграрный университет д.х.н., проф. Хонина Татьяна
- 2. План лекции 1. Понятие раствор. Типы растворов.
- 3. Вещество А + вещество ВНеоднородная смесь –
- 4. Смеси веществ (гетерогенные и гомогенные системы) СмесиГрубодисперсные
- 5. Грубодисперсные системыДисперсионная среда – газообразная Дисперсная фаза:твердая
- 6. Истинные растворы (в отличие от коллоидных)
- 7. Качественный состав растворов Растворителем считают то вещество,
- 8. Количественный состав растворовСоотношение количества растворенного вещества и
- 9. Концентрация раствораМолярная концентрация растворасМ(В) = nB /
- 10. Концентрация раствораМоляльная концентрация растворенного вещества В (обозначение
- 11. Растворимость Растворимость – это способность вещества растворяться
- 12. Растворимость твердых веществ в жидкостях (Ж1 +
- 13. Растворимость твердых веществ в жидкостяхВлияние давленияΔV ≈
- 14. Диаграмма растворимостиТсТплТкипГраница области метастабильныхпересыщенных растворов Область пересыщенных
- 15. Ненасыщенный растворНенасыщенным называют раствор, концентрация которого меньше, чем у насыщенного (при данной температуре) раствора.15
- 16. Пересыщенные растворыПересыщенный раствор содержит растворенного вещества больше, чем требуется для насыщения при данной температуре.16
- 17. НасыщенныйНасыщенным (при данной температуре) называют раствор, который
- 18. Применение диаграммы растворимостиЭксперимент: Получение насыщенного раствора из ненасыщенного.Охлаждение насыщенного раствораДиаграмма растворимости 18
- 19. Исследование растворимости веществЭксперимент: растворение кристаллического вещества (хлорид натрия) в жидком растворителе (вода)19
- 20. T = constВода Исследование растворимости веществ20
- 21. Взаимная растворимость жидкостейНеограниченная взаимная растворимость (вода и
- 22. Ограниченная взаимная растворимость в системе вода –
- 23. Растворимость газов Взаимная растворимость газов неограниченна. Растворимость
- 24. Растворимость газов в водеКислород O2:4,89 0°C
- 25. Растворимость газовЖ1 + Г2: сольватация H2O(ж) (H2O)х
- 26. Идеальные растворыПри образовании идеальных растворов не меняются
- 27. Реальные растворыПри смешивании 1 л воды и
- 28. Идеальные и реальные растворыСвойства идеальных растворов представляют
- 29. П.2 Теория электролитической диссоциации. Степень и
- 30. Теория электролитической диссоциацииПроцесс распада молекул электролитов на
- 31. Электролиты и неэлектролитыЭлектролиты – вещества, которые дают
- 32. Электролитыпри растворении в воде или расплавлении распадаются (диссоциируют) на ионы –положительно (катионы) и отрицательно (анионы) заряженные частицы.В растворах и расплавах электролиты проводят электрический ток.32
- 33. Раствор электролитаЧисло формульных единиц введенного в раствор
- 34. НеэлектролитыНеэлектролиты – это вещества, растворы или расплавы которыхне проводят электрический ток34
- 35. Раствор неэлектролитаЧисло формульных единиц введенного в раствор
- 36. Сильные электролитыMA M+(р) + A–(р) Пример:
- 37. Слабые электролитыMxAy(р) x Ma+(р) +
- 38. Константа, степень диссоциации и концентрация слабого электролитаKC
- 39. Закон разбавления ОствальдаKC = 2 с0Вильгельм-Фридрих ОСТВАЛЬД (2.IX.1853 - 4.IV.1932), немецкий физикохимикс00 = f (с0)39
- 40. Факторы, от которых зависит сила электролитаПрочность связи
- 41. Гетерогенные ионные равновесия
- 42. Растворимость (L), моль/лМхАу(т) х
- 43. ЗадачаРассчитать растворимость сульфата серебра, если ПР(Ag2SO4) =
- 44. Слайд 44
- 45. Разбавленные растворы слабых электролитов
- 46. Лекция для самостоятельной работы
- 47. Вопросы к экзамену по общей и неорганической
- 48. 37Вопросы к экзамену (продолжение)10. Основные законы химии:
- 49. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Уральский государственный
аграрный университет
д.х.н., проф. Хонина Татьяна Григорьевна
РАСТВОРЫ
(часть 1 )
Екатеринбург,
2019
Слайд 2План лекции
1. Понятие раствор. Типы растворов. Способы выражения
состава (концентрации) растворов.
2. Теория электролитической диссоциации.
Степень и константа диссоциации. Сильные и слабыеэлектролиты.
2
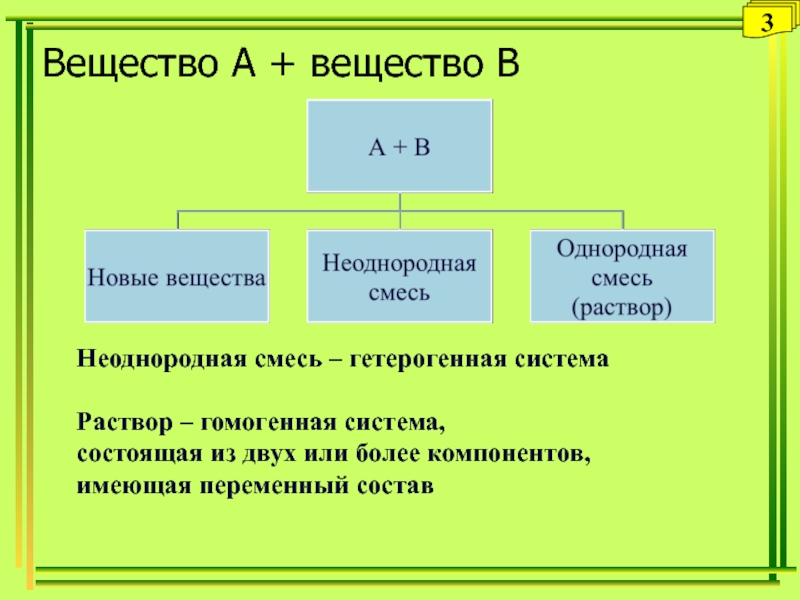
Слайд 3Вещество А + вещество В
Неоднородная смесь – гетерогенная система
Раствор –
гомогенная система,
состоящая из двух или более компонентов,
имеющая переменный
состав3
Слайд 4Смеси веществ
(гетерогенные и гомогенные системы)
Смеси
Грубодисперсные системы (взвеси)
Тонкодисперсные системы (коллоидные
системы)
Истинные растворы
Размеры частиц
более 100 нм
1 – 100 нм
менее 1 нм
4
Слайд 5Грубодисперсные системы
Дисперсионная среда – газообразная
Дисперсная фаза:
твердая – пыль, дым
жидкая
– облако, туман
Дисперсионная среда – жидкая
Дисперсная фаза:
твердая – суспензия, паста
жидкая
– эмульсиягазообразная – пена, газированная вода
Дисперсионная среда – твердая
Дисперсная фаза:
твердая – горные породы, цветные стекла, композиты
жидкая – твердые эмульсии
газообразная – твердые пены
5
Слайд 6Истинные растворы (в отличие от коллоидных) _ однофазные системы
переменного состава, содержащие атомы, ионы или молекулы и различные ассоциаты
последнихСостав раствора: растворитель + растворенное вещество.
Параметры раствора: температура, давление, содержание растворенного вещества.
Агрегатное состояние :
Газообразные (воздух),
Твердые (сплавы)
Жидкие растворы (водные и неводные):
ж.-тв. (H2O – NaCl, CCl4 – I2)
ж.- ж. (Н2O – H2SO4)
ж.- г. (Н2O – СO2)
6
Слайд 7Качественный состав растворов
Растворителем считают то вещество, агрегатное состояние которого
не изменяется при образовании раствора
Растворенное вещество
Если массы растворенного вещества
m B и растворителя mS сопоставимы (m B mS), то раствор считают концентрированным, если масса растворенного вещества mB много меньше массы растворителя mS (m B m S), то раствор считают разбавленным.7
Слайд 8Количественный состав растворов
Соотношение количества растворенного вещества и растворителя количественно определяет
концентрация раствора. В неорганической химии для количественного выражения состава растворов
используют массовую долю, мольную долю, молярную, моляльную и эквивалентную концентрации (а также титр в аналитической химии).8
Слайд 9Концентрация раствора
Молярная концентрация раствора
сМ(В) = nB / Vр ;
(моль/л).
Если в растворе серной кислоты H2SO4 молярная концентрация равна
1 моль/л, то это обозначается как 1М раствор H2SO4 (одномолярный раствор серной кислоты).Массовая доля wB растворенного вещества В
wB= mB / mр= mB / (mB + mводы).
Безразмерная величина
Эквивалентная концентрация (нормальность):
сн(В) = nмоль(экв) (B) / Vр ; [моль(экв.)/л)].
9
Слайд 10Концентрация раствора
Моляльная концентрация растворенного вещества В (обозначение cm) определяется как
отношение количества вещества В (nB, моль) к массе растворителя (ms
, кг):cm (В) = nB / ms..
Единица измерения - моль/кг
Мольная (молярная)доля вещества в смеси (в том числе, в растворе) обозначается как xB и равна отношению количества вещества В (nB, моль) к суммарному количеству всех веществ в cмеси (растворе) ni = nB + n1 + n2 + …+ ni, а именно:
xB = nB / ni ..
Мольная доля – безразмерная величина.
10
Слайд 11Растворимость
Растворимость – это способность вещества растворяться в данном растворителе
при заданной температуре.
Количественно растворимость измеряется как концентрация насыщенного раствора.
(коэфф. растворимости
– масса вещества, растворяющегося при данных усл. в 100 г растворителя; табл. растворимости)Растворимость:
более 10 г/ 100 мл H2O – вещество хорошо растворимо;
менее 1г/ 100мл – малорастворимо;
менее 0,01г/ 100мл практически нерастворимо
11
Слайд 12Растворимость твердых веществ в жидкостях (Ж1 + Т2)
Для смешения: GM
= HM - TSM
Энтропийный фактор:
SM 0; если T, (TSM)
Энтальпийный
фактор:HM = Hкр + Hс + Hр
Hкр – разрушение кристаллической решетки (эндотермич.)
Hс – сольватация (экзотермич.)
Hр – разрушение структуры растворителя (эндотермич.), 0
12
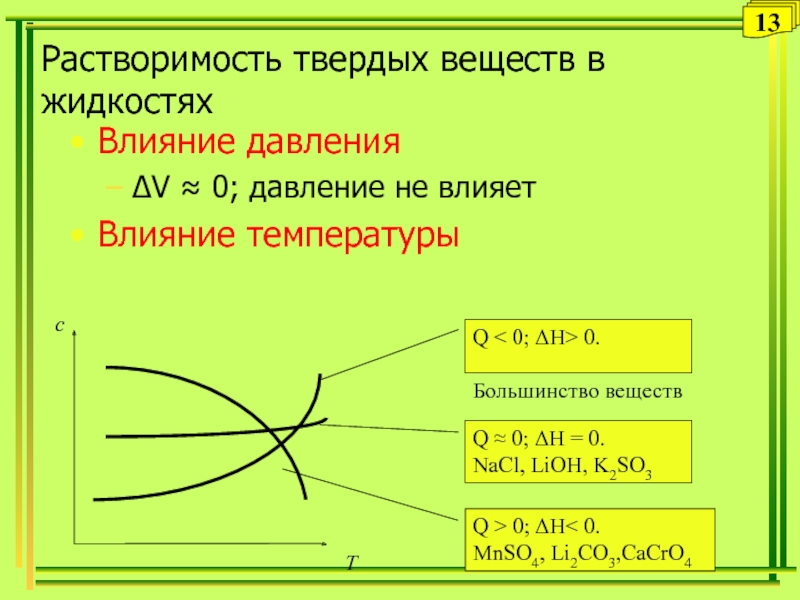
Слайд 13Растворимость твердых веществ в жидкостях
Влияние давления
ΔV ≈ 0; давление не
влияет
Влияние температуры
Т
с
Q < 0; ΔН> 0.
Большинство веществ
Q ≈ 0; ΔН
= 0.NaCl, LiOH, K2SO3
Q > 0; ΔН< 0.
MnSO4, Li2CO3,CaCrO4
13
Слайд 14 Диаграмма растворимости
Т
с
Тпл
Ткип
Граница области метастабильных
пересыщенных растворов
Область пересыщенных растворов c(B) >
[B]
Кривая растворимости
c(B) = [B]
Область ненасыщенных растворов c(B) < [B]
14
Слайд 15Ненасыщенный раствор
Ненасыщенным называют раствор, концентрация которого меньше, чем у насыщенного
(при данной температуре) раствора.
15
Слайд 16Пересыщенные растворы
Пересыщенный раствор содержит растворенного вещества больше, чем требуется для
насыщения при данной температуре.
16
Слайд 17Насыщенный
Насыщенным (при данной температуре) называют раствор, который находится в равновесии
с растворяемым веществом.
Устанавливается фазовое равновесие: растворяемое вещество раствор
17
Слайд 18Применение диаграммы растворимости
Эксперимент:
Получение насыщенного раствора из ненасыщенного.
Охлаждение насыщенного раствора
Диаграмма
растворимости
18
Слайд 19Исследование растворимости веществ
Эксперимент: растворение кристаллического вещества (хлорид натрия) в жидком
растворителе (вода)
19
Слайд 21Взаимная растворимость жидкостей
Неограниченная взаимная растворимость (вода и этанол, вода и
серная кислота, вода и ацетон и др.)
Практически полная нерастворимость (вода
и бензол, вода и CCl4 и др.)Ограниченная взаимная растворимость (вода и бутанол и др.)
21
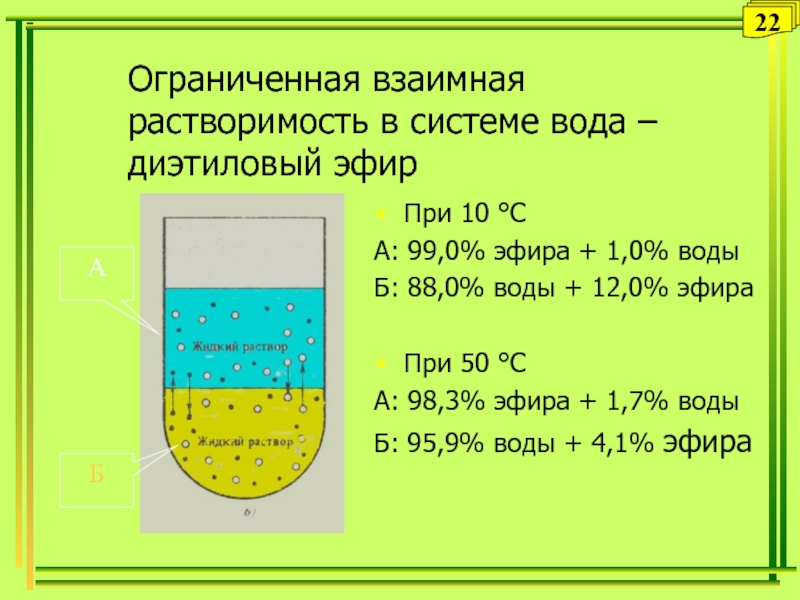
Слайд 22Ограниченная взаимная растворимость в системе вода – диэтиловый эфир
При 10
°С
А: 99,0% эфира + 1,0% воды
Б: 88,0% воды +
12,0% эфираПри 50 °С
А: 98,3% эфира + 1,7% воды
Б: 95,9% воды + 4,1% эфира
А
Б
22
Слайд 23Растворимость газов
Взаимная растворимость газов неограниченна.
Растворимость газа в жидкости
зависит от природы газа, растворителя, температуры и прямо пропорциональна парциальному
давлению pB газа B над поверхностью его раствора: wB=Kг PB (закон Генри), где wB-мольная доля
Масса газа, растворяющегося при постоянной температуре в данном объеме жидкости, прямо пропорциональна парциальному давлению газа
23
Слайд 24Растворимость газов в воде
Кислород O2:
4,89 0°C 3,10 20°C 1,72
100°C
Азот N2:
2,35 0°C 1,54 20°C 0,95 100°C
Радон Rn:
51,0 0°C
22,4 25°C 13,0 50°C(в мл газа/100 г H2O)
24
Слайд 25Растворимость газов
Ж1 + Г2: сольватация
H2O(ж) (H2O)х при 25 °С
х 4
Энтальпия сольватации Нс 0 (экзотермич.)
Г(р) Г(H2O)y
Г(s)
Г(ж1)y25
Слайд 26Идеальные растворы
При образовании идеальных растворов не меняются агрегатные состояния веществ,
входящих в его состав, а объемный и энтальпийный эффект растворения
равны нулю:Hм = 0, Vм = 0
26
Слайд 27Реальные растворы
При смешивании 1 л воды и 1 л этанола
объем раствора при 25 С равен не 2 л, а
1,93 л.Объемный эффект растворения
C6H6 + н-гексан C6H14 : Vм = 0,13%
C6H6 + CCl4 : Vм = 0,52%
27
Слайд 28Идеальные и реальные растворы
Свойства идеальных растворов представляют собой функции только
количественного состава растворов, а не природы растворяемого вещества и растворителя.
Близки по свойствам к идеальным бесконечно разбавленные растворы (для концентрации растворенного вещества меньшей чем 0,1 моль/л).
28
Слайд 29П.2 Теория электролитической диссоциации. Степень и константа диссоциации. Сильные
и слабые электролиты.
Теория электролитической диссоциации (1887 г.)
В водном
растворе (или расплаве) происходит распад растворенных веществ – электролитов – на ионы:MA(т,ж,г) + Ж1
MA(s) + M+(s) + А–(s)
MA(s) – сольватированная молекула растворенного вещества; M+(s) и А–(s) – сольватированные катион и анион.
Сванте-Август АРРЕНИУС
(19.11 1859 - 2.Х 1927), шведский физикохимик
29
Слайд 30Теория электролитической диссоциации
Процесс распада молекул электролитов на ионы в растворе
или расплаве называется электролитической диссоциацией или ионизацией.
В растворе или расплаве
электролитов ионы движутся хаотически. При пропускании электрического тока – положительно заряженные ионы (катионы) движутся к катоду, а отрицательно заряженные ионы (анионы) – к аноду.Диссоциация – процесс обратимый: одновременно идут два противоположных процесса диссоциация и ассоциация)
30
Слайд 31Электролиты и неэлектролиты
Электролиты – вещества, которые дают заметные изменения числа
формульных единиц при переходе в раствор, а при появлении разности
потенциалов проводят электрический ток.Неэлектролиты – вещества, для которых не происходит изменения числа формульных единиц в растворе, при растворении меняются только силы межмолекулярного взаимодействия.
31
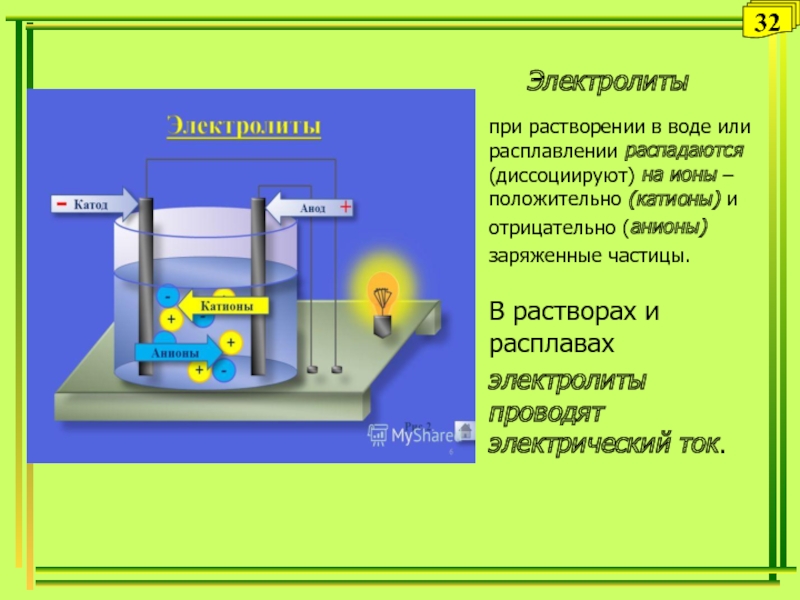
Слайд 32Электролиты
при растворении в воде или расплавлении распадаются (диссоциируют) на ионы –положительно (катионы) и
отрицательно (анионы)
заряженные частицы.
В растворах и расплавах
электролиты
проводят электрический ток.
32
Слайд 33Раствор электролита
Число формульных единиц введенного в раствор вещества увеличивается
В
1 л 0,01М раствора KСl содержится 0,01 моль катионов K+
и анионов Cl–:0,01 моль KСl + H2O
0,01 моль K+ (р) + 0,01 моль Cl– (р)
33
Слайд 34Неэлектролиты
Неэлектролиты – это вещества, растворы или расплавы которых
не проводят электрический
ток
34
Слайд 35Раствор неэлектролита
Число формульных единиц введенного в раствор вещества сохраняется
В
1 л раствора 0,01М сахарозы содержится 0,01 моль гидратированных молекул
C12H22O11 (В) :0,01 моль B + H2O 0,01 В (р)
35
Слайд 36Сильные электролиты
MA M+(р) + A–(р)
Пример: NaCl(р) = Na+(р)
+ Cl–(р)
[MA] = 0, [M+] = [A–] = c0
Степень диссоциации:
36
Слайд 37Слабые электролиты
MxAy(р) x Ma+(р) + y Ab–(р)
Пример:
HgCl2
HgCl+ + Cl– ( = 2–5%):
Это соединение имеет молекулярную
структуру, является бинарным соединениемКонстанта диссоциации KD (KC)
37
Слайд 38Константа, степень диссоциации и концентрация слабого электролита
KC = [M+] [A–]
/ [MA] = ( с0 · с0) / (1–)с0
KC = 2 с0 / (1–)
38
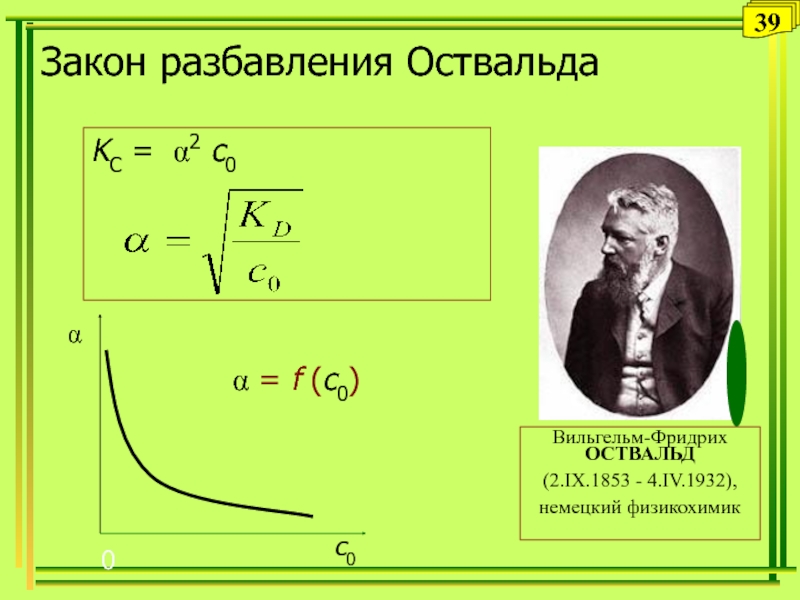
Слайд 39Закон разбавления Оствальда
KC = 2 с0
Вильгельм-Фридрих ОСТВАЛЬД
(2.IX.1853 - 4.IV.1932),
немецкий физикохимик
с0
0
= f (с0)
39
Слайд 40Факторы, от которых зависит сила электролита
Прочность связи (M+–A–) или (M+)
(A–)
Прочность образующихся сольватов
Концентрация раствора
Температура
Природа растворителя (его диэлектрическая
проницаемость)40
Слайд 41Гетерогенные ионные равновесия
МА(т)
М M+ + А–Для малорастворимых сильных электролитов:
Kс = [M+][A–] = ПР(МА)
(произведение растворимости)
В общем виде:
МхАу(т) х Ма+ + у Аb–
Тогда ПР = [Ma+]x [Ab–]y
ПР = const при T = const
ПР = f(T)
41
Слайд 42Растворимость (L), моль/л
МхАу(т) х Ма+ + у
Аb–
[Ma+] = x L; [Ab–] = y L
ПР(МхАу) = (x
L)x (y L)y = xx yy Lx+y42
Слайд 43Задача
Рассчитать растворимость сульфата серебра, если ПР(Ag2SO4) = 1,2 . 10–5
Ag2SO4(т)
2Ag+ + SO42–
L
2L L ПР = [Ag+ ]2 [SO42–] = (2L)2L = 4L3
43
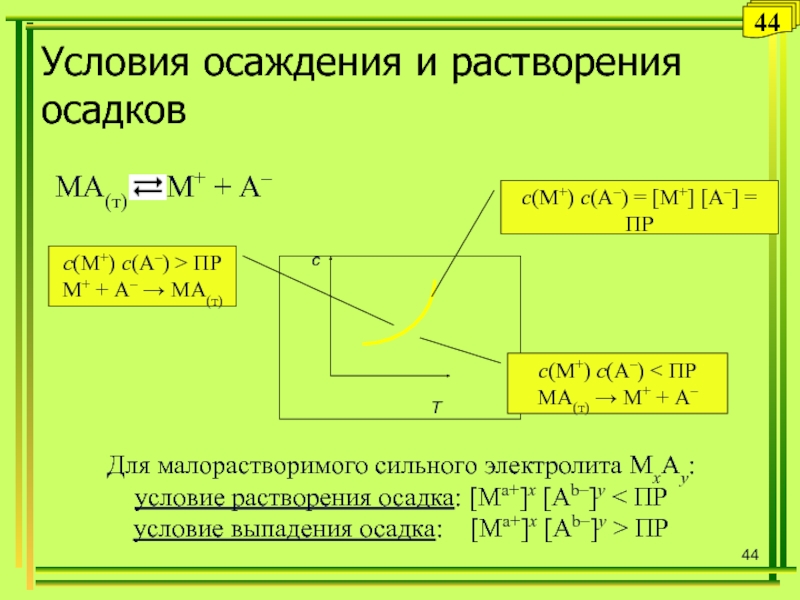
Слайд 44
Т
Условия осаждения и растворения осадков
с
с(М+) с(А–) = [M+] [А–] = ПР
с(М+) с(А–) < ПР
МА(т) М+ + А–
с(М+) с(А–) > ПР
М+ + А– МА(т)
МА(т) М+ + А–
Для малорастворимого сильного электролита МхAy
условие растворения осадка: [Ma+]x [Ab–]y < ПР
условие выпадения осадка: [Ma+]x [Ab–]y > ПР
44
Слайд 45Разбавленные растворы слабых электролитов
1.Понижение давления пара растворителя над раствором (закон
Рауля):
pi =Ni pо ; Ni – мольная доля растворителя.
2.Понижение температуры
кристаллизации раствора:tкрист. = К m; m – моляльная концентрация раство-
ренного вещества; К - криоскопическая постоянная р-ля.
3.Повышение температуры кипения раствора:
tкип. = E m; Е – эбулиоскопическая постоянная р-ля.
4.Осмотическое давление (P, кПа):
P = CM RT, R – универсальная газовая постоянная;
T- температура, К.
Слайд 46Лекция для самостоятельной работы
Основы термохимии. Тепловой эффект химической реакции, изменение
энтальпии химической реакции. Закон Гесса.
Пример расчета изменения энтальпии реакции.
Слайд 47Вопросы к экзамену
по общей и неорганической химии
1. Понятия: материя,
вещество. Предмет науки химия
2. Качественная и количественная характеристика состава атомов
3.
Строение электронных оболочек атомов. Квантовые числа. Энергетические уровни и подуровни, атомные электронные орбитали.4. Правила составления электронных формул и схем строения электронных оболочек атомов (принцип минимальной энергии, правила Клечковского, Хунда, принцип Паули)
5. Химические (окислительные, восстановительные) свойства атомов химических элементов и порядок их определения
6. Сущность периодического закона. Причина периодической повторяемости химических свойств и количественных характеристик атомов с увеличение зарядов их ядер
7. Строение периодической системы химических элементов Д.И.Менделеева. Характер и причины изменения металлических и неметаллических свойств, радиусов, энергии ионизации, энергии сродства к электрону, электроотрицательности атомов в периодах и группах периодической системы
8. Основные типы химической связи (ковалентная, ионная, металлическая), механизм их образования и свойства
9. Классы сложных неорганических соединений. Состав, номенклатура, химические свойства и реакции оксидов, кислот, оснований и солей
Слайд 4837
Вопросы к экзамену (продолжение)
10. Основные законы химии: закон сохранения массы
вещества, закон постоянства состава вещества, закон Авогадро и два следствия
из него. Применение этих законов для вычисления состава, массы и объема веществ11. Основы термохимии. Тепловой эффект химической реакции, изменение энтальпии химической реакции. Закон Гесса. Пример расчета изменения энтальпии реакции
12. Понятия скорости гомогенной и гетерогенной реакций. Зависимость скорости химической реакции от концентрации реагирующих веществ, давления, температуры. Закон действия масс, правило Вант-Гоффа.
13. Сущность химического равновесия и условие его наступления. Константа химического равновесия. Определение направления смещение химического равновесия в соответствии с принципом Ле Шателье.
14. Понятие раствор. Типы растворов. Способы выражения состава (концентрации) растворов
15. Теория электролитической диссоциации. Степень и константа диссоциации. Сильные и слабые электролиты
16. Диссоциация воды, ионное произведение воды. Водородный показатель. Шкала рН растворов
17. Реакции ионного обмена, условия их протекания. Порядок составления ионных уравнений
18. Гидролиз солей
19. Сущность окислительно-восстановительных реакций и условие их протекания. Степени окисления атомов и порядок их определения. Составление уравнений окислительно-восстановительных реакции на основе метода электронного баланса
20. Комплексные соединения металлов, их состав и поведение (устойчивость) в растворах. Константа нестойкости комплексных ионов.
21. Химия s,p,d-элементов таблицы Менделеева
22. Химия биогенных элементов. Понятие о микроэлементах.
37











![Уральский государственный
аграрный университет
д.х.н., проф. Хонина Татьяна Диаграмма растворимостиТсТплТкипГраница области метастабильныхпересыщенных растворов Область пересыщенных растворов c(B) > [B]Кривая Диаграмма растворимостиТсТплТкипГраница области метастабильныхпересыщенных растворов Область пересыщенных растворов c(B) > [B]Кривая растворимости c(B) = [B]Область ненасыщенных растворов](/img/thumbs/4343c823aec28a60024ef2233ea12b09-800x.jpg)



















![Уральский государственный
аграрный университет
д.х.н., проф. Хонина Татьяна Сильные электролитыMA M+(р) + A–(р) Пример: NaCl(р) = Na+(р) + Сильные электролитыMA M+(р) + A–(р) Пример: NaCl(р) = Na+(р) + Cl–(р)[MA] = 0, [M+] = [A–]](/img/thumbs/a0775c8c54613fd87015b574f139cafb-800x.jpg)

![Уральский государственный
аграрный университет
д.х.н., проф. Хонина Татьяна Константа, степень диссоциации и концентрация слабого электролитаKC = [M+] [A–] / Константа, степень диссоциации и концентрация слабого электролитаKC = [M+] [A–] / [MA] = ( с0 · ](/img/thumbs/db9586adf9d9a2b73fe6cc3edb1ed86a-800x.jpg)


![Уральский государственный
аграрный университет
д.х.н., проф. Хонина Татьяна Растворимость (L), моль/лМхАу(т) х Ма+ + у Аb–[Ma+] = x Растворимость (L), моль/лМхАу(т) х Ма+ + у Аb–[Ma+] = x L; [Ab–] = y](/img/thumbs/c454dc2a4c1f4f8fde6d4095fc4dd80f-800x.jpg)