Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Уральский государственный аграрный университет д.х.н., проф. Хонина Татьяна
Содержание
- 1. Уральский государственный аграрный университет д.х.н., проф. Хонина Татьяна
- 2. План1. Классификация 2. Номенклатура и изомерия3. Методы получения4. Физические свойства5. Химические свойства2
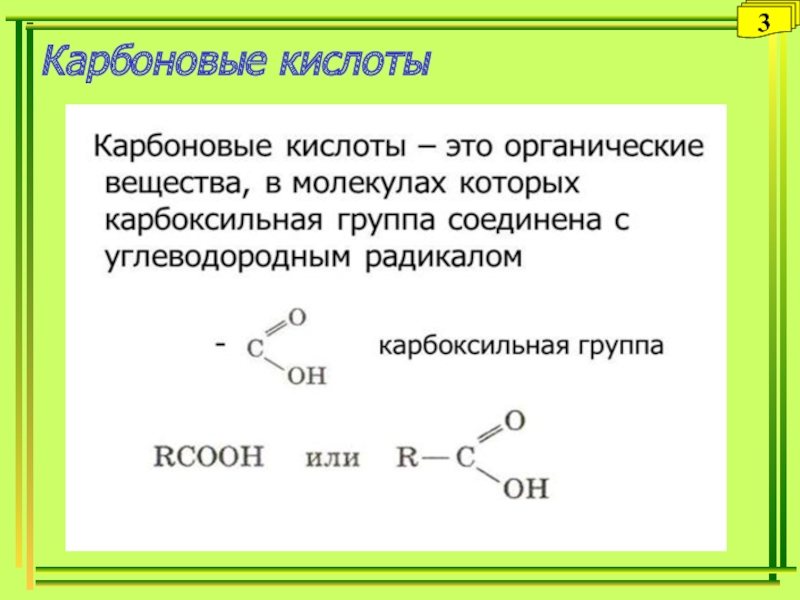
- 3. Карбоновые кислоты3
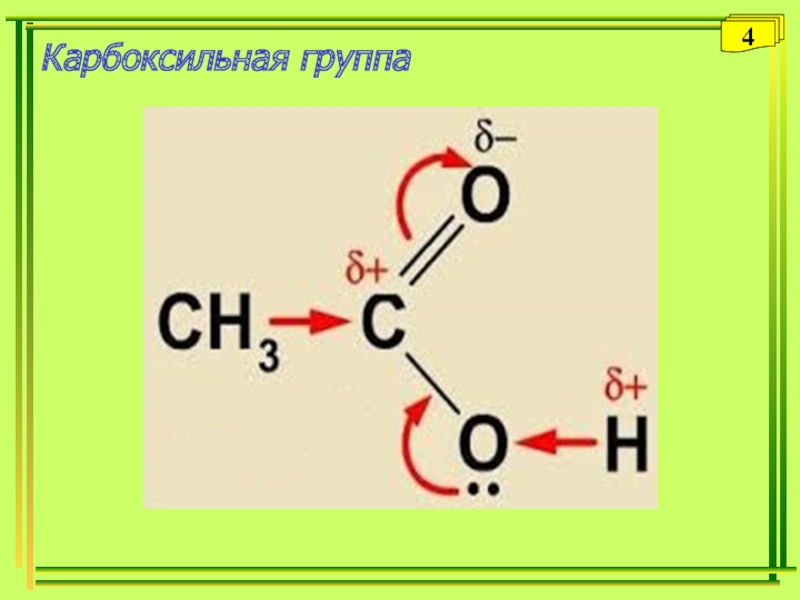
- 4. Карбоксильная группа4
- 5. КлассификацияОдноосновные, двухосновные, трехосновные - в зависимости от
- 6. Номенклатура и изомерияНазвание карбоновой кислоты образуется от
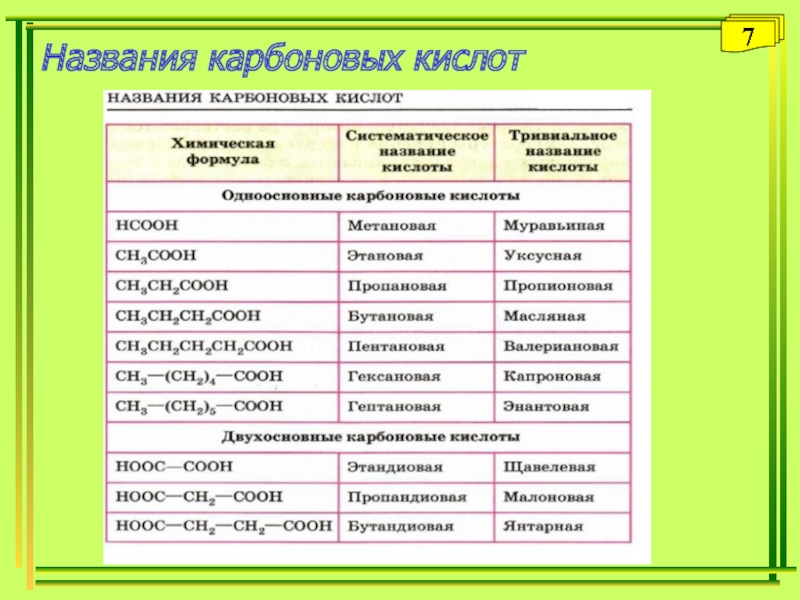
- 7. Названия карбоновых кислот7
- 8. 8
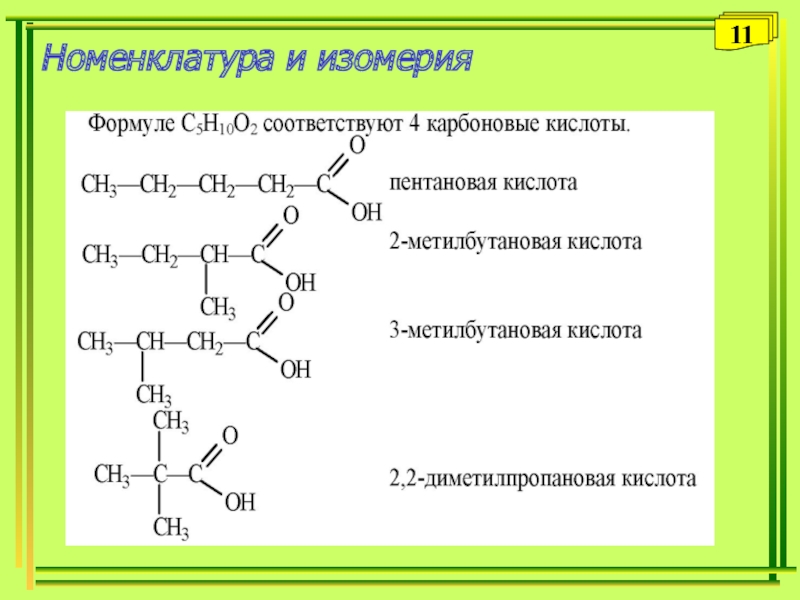
- 9. ИзомерияИзомерия углеводородного радикала СН3-СH2-CH2-COOH
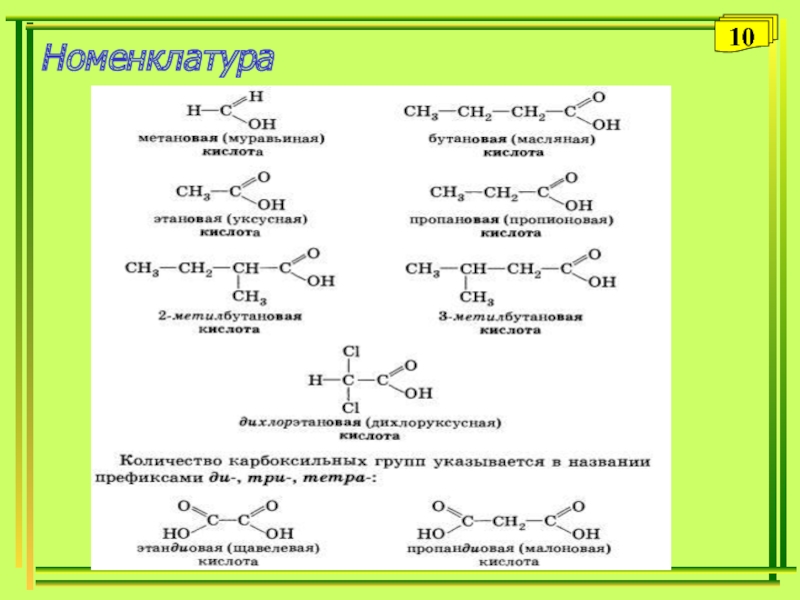
- 10. Номенклатура10
- 11. Номенклатура и изомерия11
- 12. 12
- 13. 13
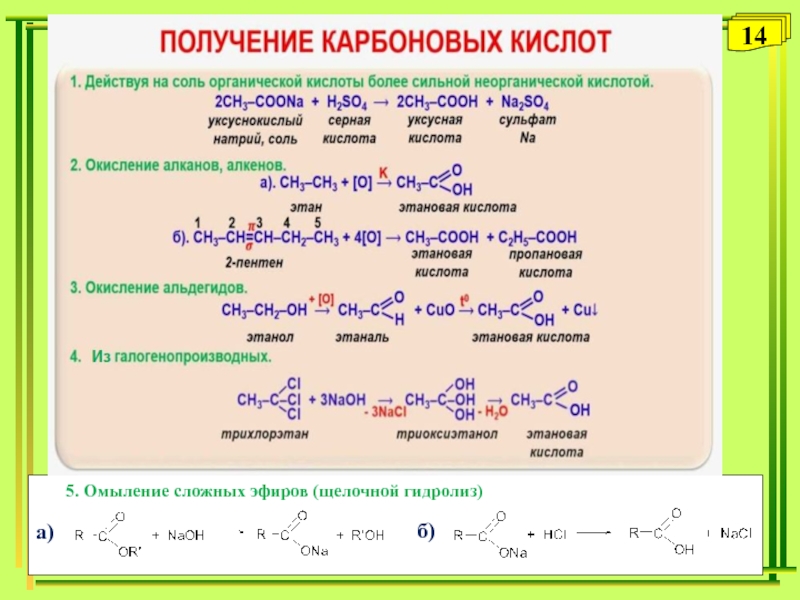
- 14. 145. Омыление сложных эфиров (щелочной гидролиз) а)б)
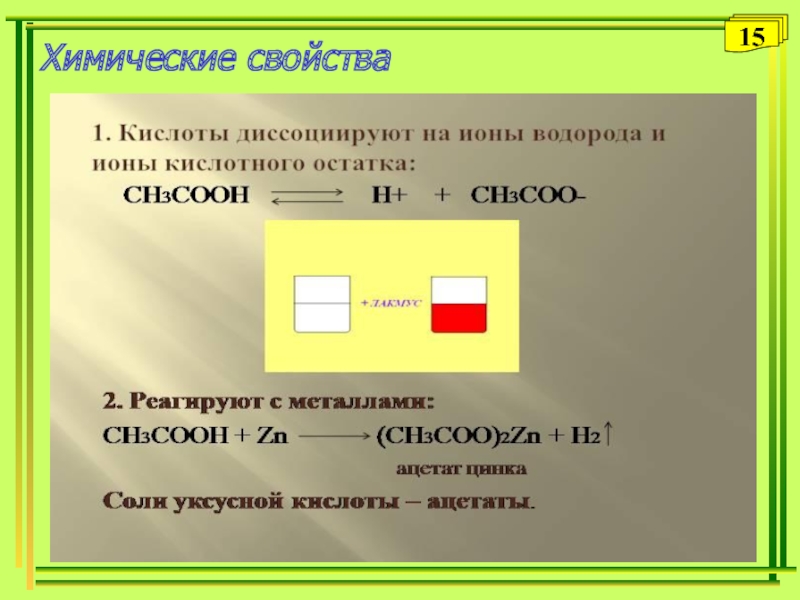
- 15. Химические свойства15
- 16. Химические свойства (прод.)16
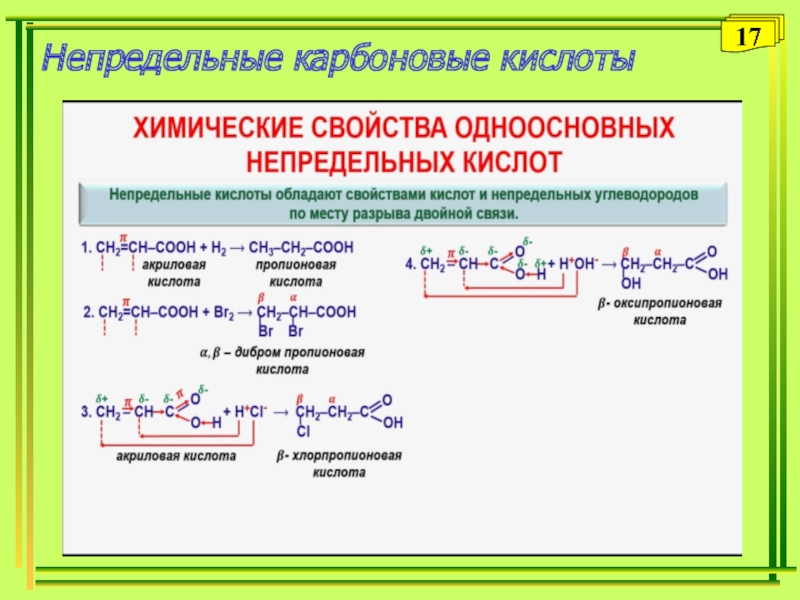
- 17. Непредельные карбоновые кислоты17
- 18. Жиры — это природные соединения, которые представляют собой сложные эфиры трёхатомного спирта глицерина и жирных кислот.18
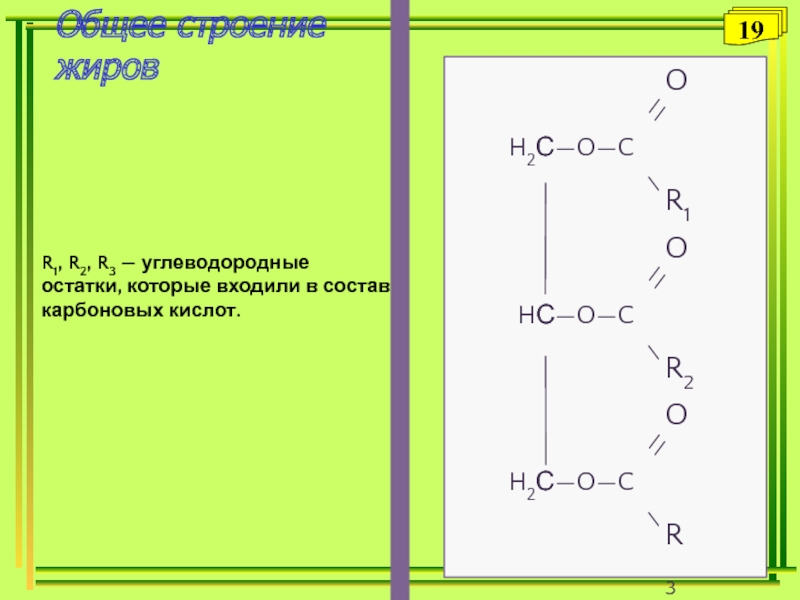
- 19. R1, R2, R3 — углеводородные остатки, которые входили в состав карбоновых кислот. Общее строение жиров19
- 20. Кислоты в составе жиров:С15H31СOOH — пальмитиновая кислотаС17H35СOOH
- 21. В воде жиры не растворяются, так как
- 22. Жиры не имеют постоянной температуры плавления или застывания, т.к. представляют собой многокомпонентные смеси. 22
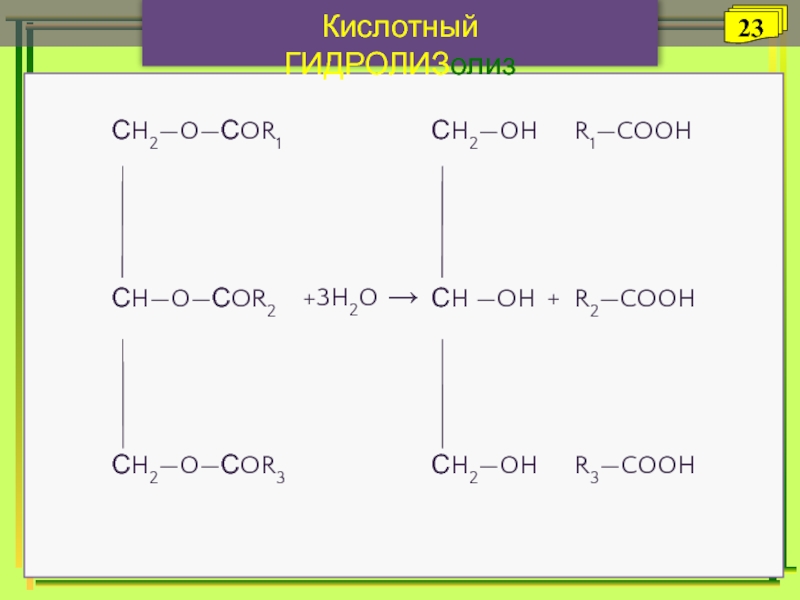
- 23. +3H2O →+ Кислотный ГИДРОЛИЗолизЖирГлицеринКарбоновыекислоты23
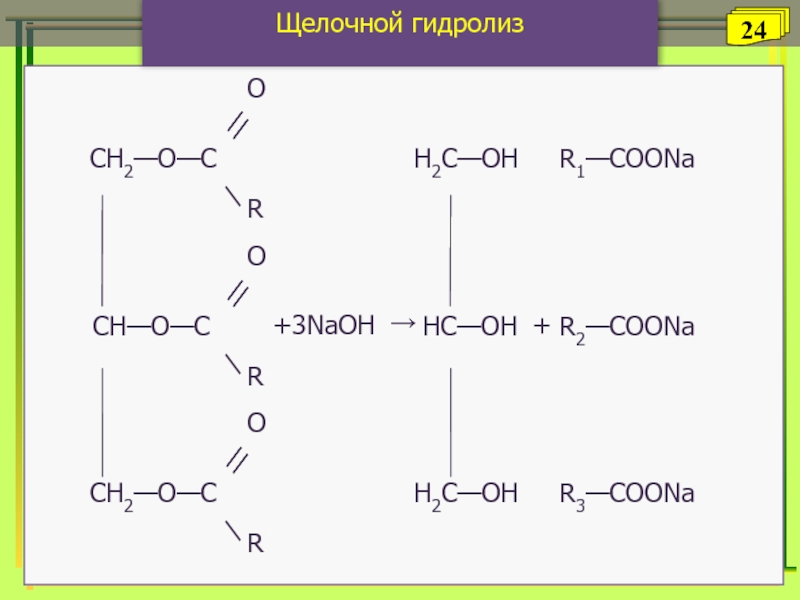
- 24. Щелочной гидролизГлицеринСоли высшихКарбоновых кислот24
- 25. Жиры являются очень важной составной частью пищевого
- 26. Скачать презентанцию
План1. Классификация 2. Номенклатура и изомерия3. Методы получения4. Физические свойства5. Химические свойства2
Слайды и текст этой презентации
Слайд 1Уральский государственный
аграрный университет
д.х.н., проф. Хонина Татьяна Григорьевна
Органическая химия
Карбоновые кислоты
(ч.3)
Слайд 2План
1. Классификация
2. Номенклатура и изомерия
3. Методы получения
4. Физические свойства
5.
Химические свойства
2
Слайд 5Классификация
Одноосновные, двухосновные, трехосновные - в зависимости от числа карбоксильных групп
в молекуле.
Алифатические, алициклические, ароматические – в зависимости от строения углеводородного
радикала.Предельные, непредельные - в зависимости от строения углеводородного радикала.
А также: полифункциональные карбоновые кислоты: гидроксикислоты, оксокислоты
Высшие (жирные кислоты) (cвыше шести атомов C) и низшие кислоты
5
Слайд 6Номенклатура и изомерия
Название карбоновой кислоты образуется от названия соответствующего алкана
с добавлением суффикса – ов, окончания – ая и слова
– кислота.Пример: этан – этановая кислота (CH3-COOH)
Нумерация атомов углерода начинается с карбоксильной группы.
Пример: CH3-CH=CH-COOH бутен-2-овая кислота
Количество карбоксильных групп указывается в названии префиксами – ди-,три, тетра. Так, названия дикарбоновых кислот имеют окончания – диовая.
Пример: HOOC-COOH - этандиовая кислота
Многие кислоты имеют исторически сложившиеся (тривиальные названия): муравьиная, уксусная, щавелевая и т.д.
6
Слайд 9Изомерия
Изомерия углеводородного радикала
СН3-СH2-CH2-COOH
СН3-СH-COOH
бутановая (масляная) кислота
|CH3
2-метилпропановая (изомасляная)кислота
Межклассовая изомерия со сложными эфирами
СН3-СH2-COOH СН3СOOСН3
пропановая кислота метиловый эфир уксусной кислоты
9
Слайд 18Жиры — это природные соединения, которые представляют собой сложные эфиры
трёхатомного спирта глицерина и жирных кислот.
18
Слайд 19R1, R2, R3 — углеводородные остатки, которые входили в состав
карбоновых кислот.
Общее строение
жиров
19
Слайд 20
Кислоты в составе жиров:
С15H31СOOH — пальмитиновая кислота
С17H35СOOH — стеариновая кислота
С17H33СOOH
— олеиновая кислота
С17H31СOOH — линолевая кислота
С17H29СOOH — линоленовая кислота
20
Слайд 21В воде жиры не растворяются,
так как их плотность меньше,
чем
у воды.
Это легко проверить, если в воду налить растительное масло.
21
Слайд 22Жиры не имеют постоянной температуры плавления
или застывания, т.к. представляют
собой многокомпонентные смеси.
22
Слайд 25Жиры являются очень важной составной частью пищевого рациона человека. Физиологическая
роль жиров в организме велика.
Прежде всего жир — это
ценный энергетический материал. Калорийность жира в 2,5 раза выше, чем белков и углеводов.Жирные кислоты (наряду с глюкозой) являются источником энергии для работающих мышц.
Жиры и жироподобные вещества, как
и белки, входят в состав клеток органов
и тканей.
25