нитрат! Признаться, я не рад…
Но ни людей, ни печь,
я в этом не виню; наоборот, развеселю и даже… опьяню! ...
Найди меня. Я газ. Я прост. Я рыжий, словно лисий хвост. Я образуюсь из нитрата, а в воздухе - из газа-брата.
А если встречусь я с водой, то стану сильной кислотой. ...
Я никто. Меня не сыщешь: я невидимый, дружище. Электрический разряд – мой родитель, друг и брат.
Когда я в воздух выделяюсь, то постепенно окисляюсь. …
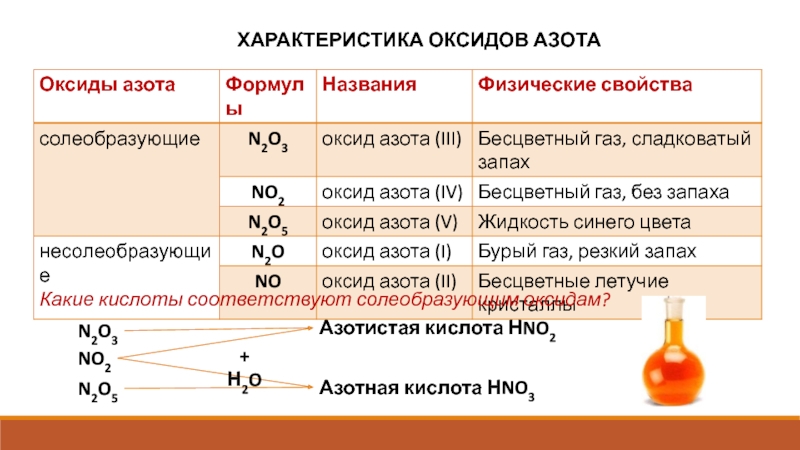
Оксид азота (II)
NO
Оксид азота (IV)
NO2
Бурый газ
Оксид азота (I)
N2O
«веселящий газ»
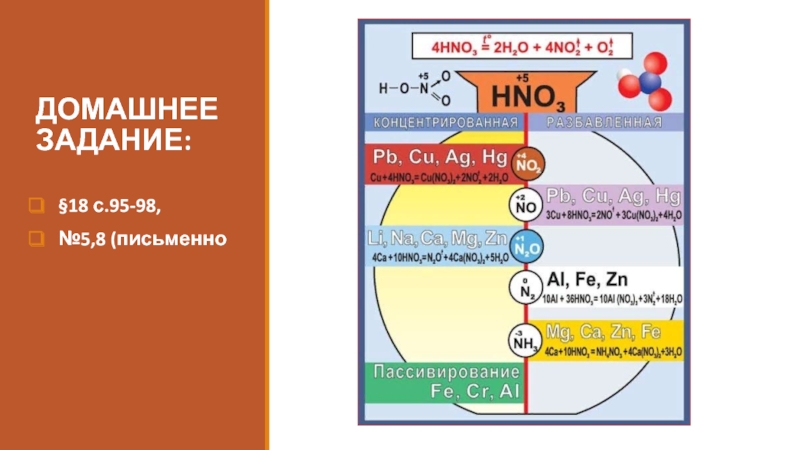
КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ АЗОТА.