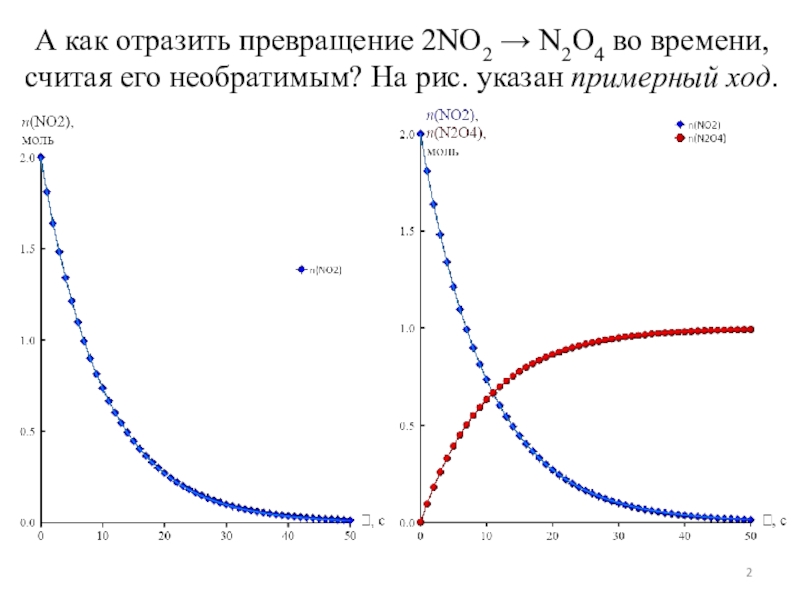
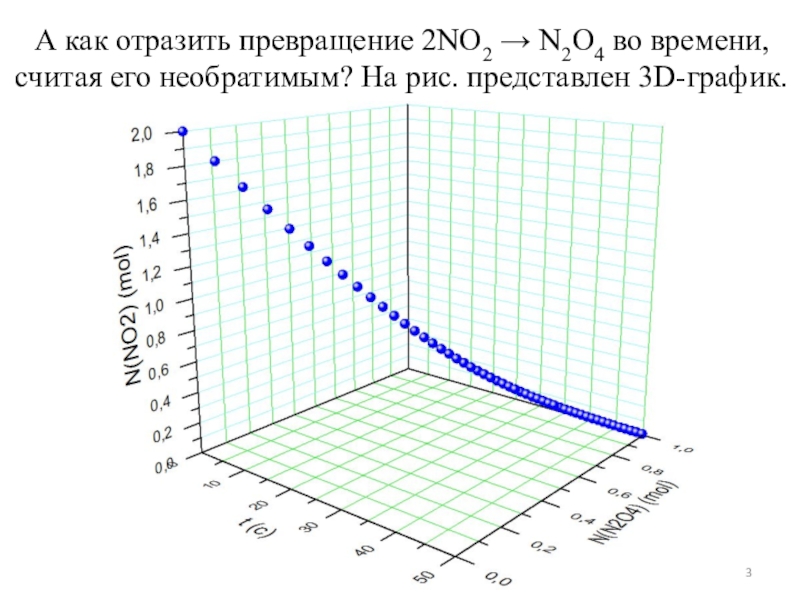
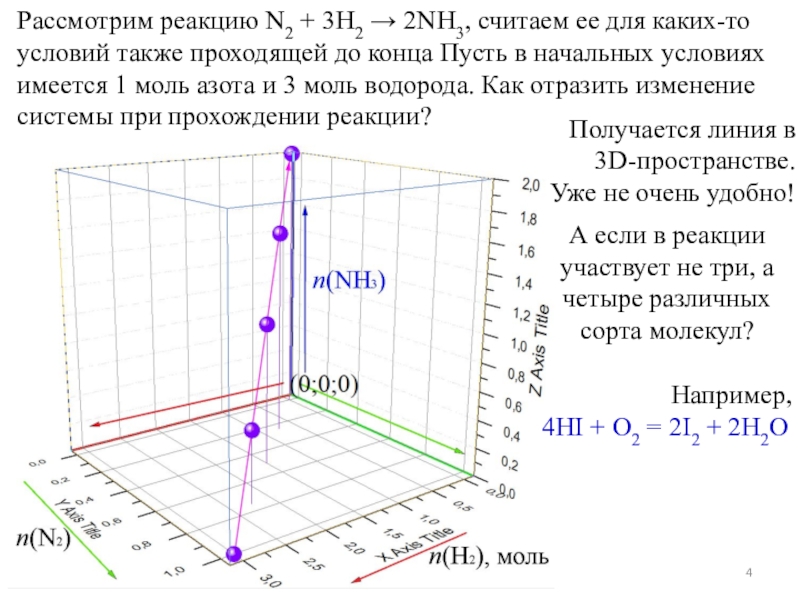
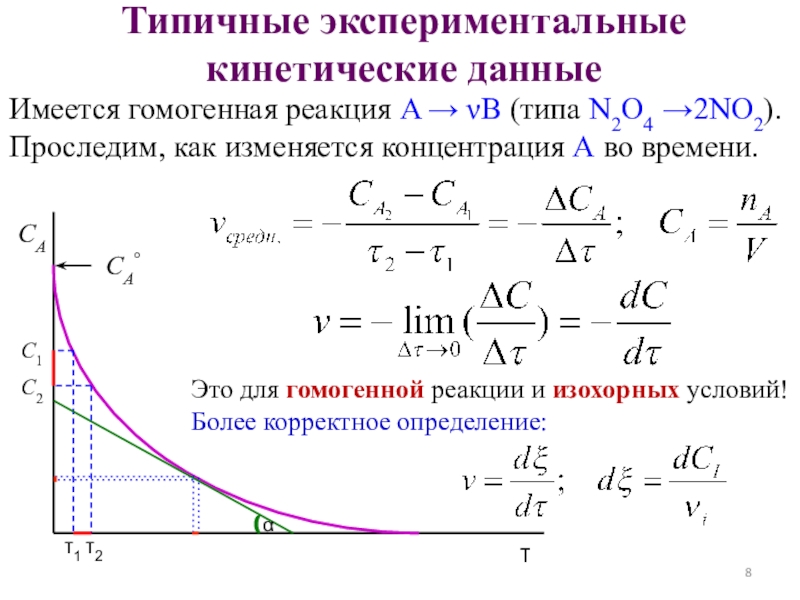
показать такое превращение?
Пусть диоксид NO2 превращается в свой димер: 2NO2
N2O4. Предположим, взято 2 моль этого оксида. Пусть в нулевой момент времени продукта еще нет. Предположим, что реакция протекает в сторону димера до конца. На графике получим такую зависимость.
n(NO2)
n(N2O4)
4
3
2
1
1 2 3
А если взять не 2, а 4 моль NO2?
(См. красную линию.)