Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Вещества и их свойства
Содержание
- 1. Вещества и их свойства
- 2. Тема урока: «Вещества и их свойства». Цели
- 3. Слайд 3
- 4. Разминка.• 1.Что такое вещества?• 2.На какие группы
- 5. Назовите классыСоставьте ур-я р-йпо генетическим рядам меди и фосфора
- 6. 3 лишний1. Гидроксид натрия , гидроксид калия
- 7. Дифференцированное задание: Уровень А: закончить уравнение, указать
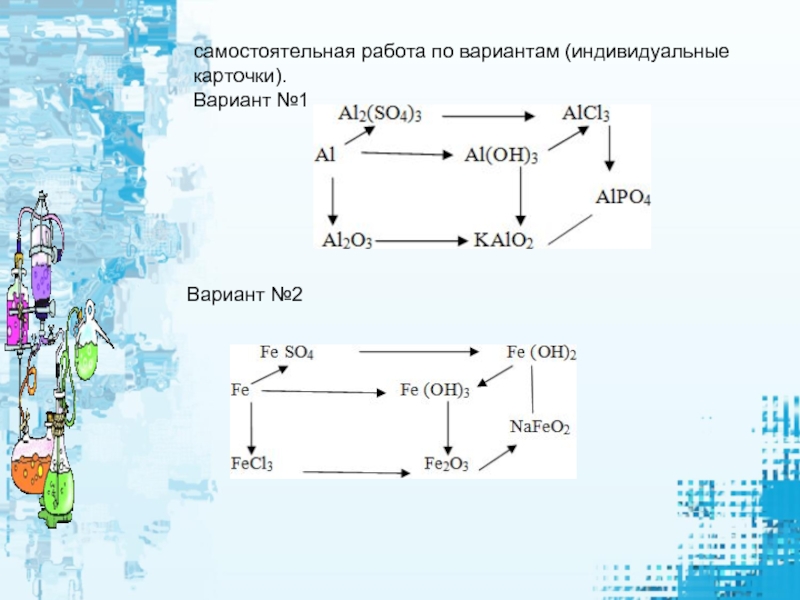
- 8. самостоятельная работа по вариантам (индивидуальные карточки).Вариант №1Вариант №2
- 9. 1)Установите соответствие между формулой оксида и его
- 10. 1.Общая формула одноатомного спирта:1CnH2n 2 CnH2n-2 3
- 11. Генетическая связь (по материалам ЕГЭ)А1. Для осуществления
- 12. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Тема урока:
«Вещества и их свойства».
Цели урока: Обобщить знания уч-ся по
теме
«Вещества и свойства»,
Воспитывать диалектико-материалистической
мировоззрение уч-ся, патриотизм;Развивать умения использовать инновационные
методы на уроках химии.
Вещества
Слайд 4Разминка.
• 1.Что такое вещества?
• 2.На какие группы делятся простые вещества?
•
3.Как изменяются металлические свойства в
периоде? В группе?
•
4. Как изменяются неметаллические свойства впериоде ? В группе?
• 5. Что такое аллотропия ? Приведите примеры
• 6.Какие классы сложных веществ в неорганической
и органической химии вы знаете?
• 7. Что такое генетический ряд металла и неметалла?
Слайд 63 лишний
1. Гидроксид натрия , гидроксид калия ,
гидроксид меди.
2. Оксид железа, оксид азота, оксид
меди.3.Оксид лития , оксид цинка, оксид
алюминия .
4. Серная кислота, соляная кислота,
угольная кислота.
5. Железо, калий , рубидий
Слайд 7
Дифференцированное задание:
Уровень А: закончить уравнение, указать тип
реакции, расставить степени
окисления.
Уровень Б: составить уравнения реакции , указать
тип реакции, указать
степени окисления.Уровень В: составить уравнения, указать тип
реакции , указать окислитель,
восстановитель, число отданных электронов.
Слайд 91)Установите соответствие между формулой оксида и его классификацией:
1) BeO
3) FeO А) амфотерный оксид В) основный оксид2) N2O 4) Mn2O7 Б) несолеобразующий оксид Г) кислотный оксид
Ответ дайте в виде последовательности букв, соответствующих цифрам по порядку от 1 до 4.
1) ВГАГ 2) АБВГ 3) ВАВГ 4) БВА
2). Одинаковое слабое основание это –
1) Zn(OH)2 2) LiOH 3) Cu(OH)2 4) NH3H2O
3. Амфотерным гидроксидом является:
1) Be(OH)2 2) Cr(OH)2 3) NH3H2O 4) KOH
4. Двухосновная кислородосодержащая кислота:
1) H3PO4 2) HI 3) H2SiO3 4) H2S
5. Слабая кислота это –
1) HF 2) HCl 3) HBr 4) HI
6. Установите соответствие между формулой соли и ее классификацией:
1) Ca3(PO4)2 3) (CuOH)2CO3 А) основная соль В) кислая соль
2) KHS 4) Na2[Be(OH)4] Б) средняя соль Г) комплексная соль
ТЕСТ
7. Составьте уравнения реакций по следующей схеме :
Ca → CaO → CaCl2 → CaCO3 →Ca(HCO3)2 → CO2. Укажите условия проведения реакций.
8. Из задания 7 выберите и рассмотрите одно из уравнений с точки зрения ОВР, другое в свете ТЭД.
9. При сжигании 3,9 г органического вещества образовалось 2,7 г воды и 13,2 г углекислого газа (н.у).
Слайд 101.Общая формула одноатомного спирта:
1CnH2n 2 CnH2n-2 3 CnH2n+2OH 4 CnH2n+1OH
•
2.Раствор метаналя в воде называют :
1 Формалином 2 Карбамидом 3
Хлоркой 4 Аммиаком• 3. Полиэтилен получают реакцией полимеризации:
1 Бутена 2 Этана 3 Этена 4 Изопрена
• 4. Формула формиата калия:
1 K2CO3 2 HCOOK 3 CH3OK 4CH3COOK
5.Реакция « серебряного зеркала» характерна для:
1 алканов 2 бензола 3 спиртов 4 альдегидов
•6. Реакцией Кучерова можно получить:
1 алкен 2 спирт 3 альдегид 4 карбоновую кислоту
• 7. Бутин гомолог :
1 ацетилена 2 бутана 3 пропена 4 глюкозы
• 8. Пептидная связь образуется между молекулами:
1 спиртов 2 аминокислот 3 карбоновых кислот 4 фенолов
ТЕСТ «Органические в-ва»
Слайд 11Генетическая связь (по материалам ЕГЭ)
А1. Для осуществления превращений в соответствии
со схемой:
Al(OH)3→AlCL3→ Al
Необходимо последовательно использовать
1) хлор и водород
2) хлорид натрия
и водород3) хлороводород и цинк
4) соляную кислоту и калий
А2. В схеме превращений:
CH4→X → CH3NH2
Веществом Х является
1) метанол
2) нитрометан
3) диметиловый эфир
4) дибромметан
А3. Для осуществления превращений в соответствии со схемой:
ZnO→ X →Y→ZnO
Веществами X Y могут быть
1) гидроксид цинка и цинк
2) хлорид цинка и фторид цинка
3) гидроксид цинка и хлорид цинка
4) нитрат цинка и гидроксид цинка
А4. В схеме превращений:
C2H6→ X →C2H5OH
Веществом Х является
1) этином
2) этандиолом
3) этеном
4) дибромэтаном
А5. В схеме превращений:
C2H5OH→X C6H5COOC2H5
Веществом Х является
1) пальмитиновая кислота
2) бензойная кислота
3) бензол
4) бензиловый спирт