Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Виконала: студентка групи бп-32 ХІМІКО-БІОЛОГІЧНОГО ФАКУЛЬТЕТУ КУЗИК КАТЕРИНА
Содержание
- 1. Виконала: студентка групи бп-32 ХІМІКО-БІОЛОГІЧНОГО ФАКУЛЬТЕТУ КУЗИК КАТЕРИНА
- 2. Історія виникнення залізаВикористання заліза почалося набагато раніше,
- 3. Загальна характеристика Феруму Ферум
- 4. Поширення в природі Залізо —
- 5. Фізичні властивостіЗа звичайних умов чисте залізо –
- 6. Хімічні властивості Залізо належить до середньої хімічної
- 7. Залізо в природі Природне залізо
- 8. Ферум є життєво важливим елементом. В організмі людини, як
- 9. Обмін заліза в організмі
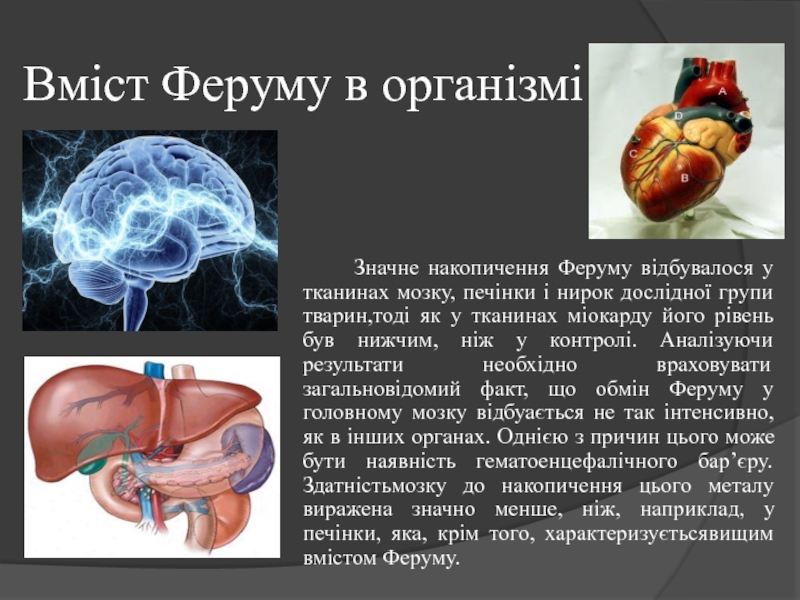
- 10. Вміст Феруму в організмі Значне
- 11. Ізотопи залізаІзотоп заліза 56Fe належить до найстабільніших
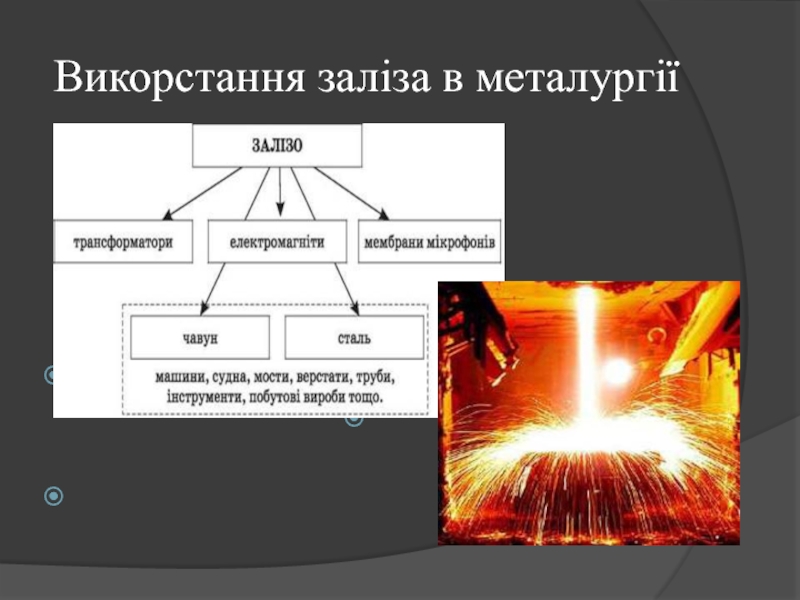
- 12. Викорстання заліза в металургії
- 13. Слайд 13
- 14. Кінець.Кінець.
- 15. Скачать презентанцию
Історія виникнення залізаВикористання заліза почалося набагато раніше, ніж його виробництво. Перші залізні вироби мали космічне (метеоритне) походження і були виготовлені з уламків метеоритів ще в III–II тис. до н. е. Час від часу
Слайды и текст этой презентации
Слайд 1
Виконала:
студентка групи бп-32
ХІМІКО-БІОЛОГІЧНОГО ФАКУЛЬТЕТУ
КУЗИК КАТЕРИНА
Ферум(Залізо)
Fe
Слайд 2Історія виникнення заліза
Використання заліза почалося набагато раніше, ніж його виробництво.
Перші залізні вироби мали космічне (метеоритне) походження і були виготовлені
з уламків метеоритів ще в III–II тис. до н. е. Час від часу знаходили шматки сірувато-чорного металу, який перековували на кинджал або наконечник списа, що був зброєю міцнішою і пластичнішою, ніж бронза, і довше тримав гостре лезо.Першим кроком у зародженні металургії заліза було отримання його шляхом відновлення з окису. Руда перемішувалася з деревним вугіллям і закладалася в піч. При високій температурі, створюваної горінням вугілля, вуглець починав з'єднуватися не лише з атмосферним киснем, але і з тим, що пов'язаний з атомами заліза. Після вигоряння вугілля в печі залишалася так звана криця — грудка речовини з домішкою відновленого заліза. Крицю потім знову розігрівали і піддавали обробці куванням, вибиваючи залізо із шлаку.
Вперше залізо навчилися обробляти народи Анатолії. Давньогрецька традиція вважала відкривачем заліза народ халібів, для яких традиційно вживалася стійка назва «батько заліза», і сама назва народу бере початок саме від грецького слова Χάλυβας («залізо»).
«Залізна революція» почалася на межі I тисячоліття до н. е. в Ассирії. З VIII століття до н. е. зварне залізо швидко стало поширюватися в Європі. Першими, хто почав на землях сучасної України виплавляти з болотної руди залізо, були кіммерійці (VII ст. до н. е.)[8]. У IV–III ст. до н. е. більша частина арсеналу зброї скіфських воїнів — мечі, кинджали, бойові сокири тощо було виготовлено з заліза. У III столітті до н. е. залізо витіснило бронзу в Галлії, у II столітті нової ери з'явилося у Німеччині, а в VI столітті нашої ери вже широко вживалося в Скандинавії. В Японії залізний вік настав лише в VIII столітті нашої ери.
Технологічніший шлях одержання пружної сталі, при якому не потрібні ні особливо чиста руда, ні графіт, ні спеціальні печі, було винайдено в Китаї в II столітті нашої ери. Сталь перековували дуже багато разів, під час кожного кування складаючи пластину вдвічі, внаслідок чого виходив відмінний матеріал для зброї, що отримав назву дамаська сталь, з якого, зокрема, робилися японськікатани.
Слайд 3Загальна характеристика Феруму
Ферум – металічний елемент
побічної підгрупи VІІІ групи 4 періоду періодичної системи хімічних елементів.
Він є представником d-елементів. На зовнішньому енергетичному рівні атома Феруму знаходиться два s-електрони, а на передзовнішньому енергетичному рівні відбувається заповнення d-підрівня. У своїх сполуках Ферум здатен проявляти ступені окиснення +2 та +3.Масова частка Феруму в земній корі становить 5 %. Він займає четверте місце по розповсюдженості в природі. Найважливішими залізними рудами є: магнетит Fе3О4, гематит Fe2О3, лімоніт — Fe2O3 · nH2O, сидерит FеСО3, пірит FеS2.
Слайд 4
Поширення в природі
Залізо — один з найбільш поширених у
природі елементів: за вмістом у земній корі — 4,7 %
(масових). Зустрічається у вигляді оксидів і сульфідів, сконцентрованих у вигляді родовищ, придатних для промислової розробки.Найважливіші руди:
• бурі залізняки (НFеO2 x Н20), пірит FеS2;
• червоні залізняки (Fе2O3);
• магнітні залізняки (Fе3O4);
• шпатові залізняки (FеСO3):
Слайд 5Фізичні властивості
За звичайних умов чисте залізо – це сріблясто білий
блискучий метал, воно досить мяке і пластичнее, легко кується. Густина
його становить 7,87 г/см3, температура плавлення 1535 ºС. Має магнітні властивості. Використовують в основному не чисте залізо, а його сплави – чавун і сталь.Слайд 6Хімічні властивості
Залізо належить до середньої хімічної активності. Взаємодія з
киснем:
3Fe + 2O2 = Fe3O4 4Fe + 3O2 =
Fe2O3 (у вологому повітрі) Взаємодія з сіркою: Fe + S = FeS
Інші характерні реакції 2Fe + 3Cl2 = 2FeCl3
3Fe + C = Fe3C
Fe + H2O = FeO + H2 ↑
Fe + H2SO4 = FeSO4 + H2 ↑
Fe + CuSO4 = FeSO4 + Cu
Слайд 7Залізо в природі
Природне залізо складається з чотирьох
стабільних ізотопів: 54Fe (ізотопна поширеність 5,845%), 56Fe (91,754%), 57Fe (2,119%)
і 58Fe (0,282%). Також відомо більше 20 нестабільних ізотопів заліза з масовими числами від 45 до 72, найстійкіші з яких — 60Fe (період напіврозпаду за уточненими в 2009 році даними становить 2,6 мільйона років[5]), 55Fe (2,737 року), 59Fe (44,495 доби) і 52Fe (8,275 години); інші ізотопи мають період напіврозпаду менше 10 хвилин.Ізотоп заліза 56Fe належить до найстабільніших ядер із найменшою енергією зв'язку у розрахунку на один нуклон. Усі попередні елементи можуть зменшити енергію зв'язку за рахунок синтезу, а всі наступні — шляхом розпаду. Вважають, що залізом закінчується процес синтезу елементів в ядрах нормальних зірок. Раніше вважалося, що всі наступні елементи можуть утворитися тільки в результаті вибухів наднових. Проте за сучасними уявленнями, синтез елементів, важчих заліза, відбувається не лише у наднових, а й у надрах зір-гігантів на пізніх стадіях їх еволюції завдяки s-процесу.
Слайд 8Ферум є життєво важливим елементом. В організмі людини, як і тварин, ферум
присутній в усіх тканинах, проте найбільша його частина (приблизно три
грами) зосереджена в кров’яних кульках. Атоми Феруму займають центральне положення в молекулах гемоглобіну, їм гемоглобін зобов’язаний своїм забарвленням і здатністю приєднувати та відщеплювати кисень.Залізо
Ферум бере участь у процесі перенесення кисню від легенів до тканин організму. Добова потреба організму у Ферумі становить 15-20 мг. Загальна його кількість потрапляє в організм людини з рослинною їжею та м’ясом.
При втраті крові потреба у Ферумі перевищує кількість, яку людина отримує з їжею. Нестача Феруму в організмі може привести до стану, який характеризується зменшенням кількості еритроцитів та гемоглобіну крові. Медичні препарати Феруму слід вживати тільки за призначенням лікаря.