Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Вирусы-особая форма жизни
Содержание
- 1. Вирусы-особая форма жизни
- 2. Вирусы (лат. «virus» яд) — мельчайшие микроорганизмы, не
- 3. В настоящее время вирусология - бурно развивающаяся
- 4. Основные свойства вирусов , по которым они
- 5. Все вирусы существуют в двух качественно разных
- 6. Номенклатура вирусов.Название семейства вирусов заканчивается на “viridae”,
- 7. Строение (морфология) вирусов.1.Геном вирусов образуют нуклеиновые кислоты, представленные
- 8. При спиральной симметрии белковые субъединицы располагаются по спирали,
- 9. Слайд 9
- 10. Слайд 10
- 11. 3.Просто устроенные вирусы имеют только нуклеокапсид, т.е. комплекс
- 12. Основные этапы взаимодействия вируса с клеткой хозяина.1.Адсорбция-
- 13. Исходы взаимодействия вирусов с клеткой хозяина.1.Абортивный процесс-
- 14. 2. Продуктивный процесс- репликация (продукция) вирусов:- гибель (лизис)
- 15. Слайд 15
- 16. 3.Интегративный процесс- интеграция вирусного генома с геномом
- 17. Слайд 17
- 18. Острая инфекция - после образования вирусного потомства
- 19. Пути проникновения вируса в организм:Воздушно-капельный: 1.респираторные вирусы
- 20. Распространение вирусов
- 21. Основные методы культивирования вирусов.1.В организме лабораторных животных.2.В куриных эмбрионах.3.В клеточных культурах — основной метод.
- 22. Культура клеток популяция однотипных клеток организма животных
- 23. Первичные культуры клеток получают из тканей животных
- 24. Слайд 24
- 25. Полуперевиваемые культуры клеток представляют собой диплоидные клетки
- 26. Перевиваемые культуры клеток – это однотипные опухолевые
- 27. HeLa — линия «бессмертных» клеток, используемая во множестве научных исследований в
- 28. Клетки HeLa под электронным микроскопомДеление клеток HeLa под электронным микроскопом
- 29. Специальные питательные среды для культур клеток.синтетические вирусологические
- 30. Выращивание культур клеток независимо от их типа
- 31. Куриные эмбрионы. Широко доступны и просты в
- 32. Слайд 32
- 33. Слайд 33
- 34. Индикация вирусов – это обнаружение вирусов в
- 35. 1.Цитопатический эффект.Цитопатические эффекты вирусов оценивают при микроскопии
- 36. Слайд 36
- 37. Слайд 37
- 38. 2. Тельца включений. Многие вирусы вызывают появление
- 39. ТЕЛЬЦА ПАШЕНАвирусные частицы, обнаруживаемые в ороговевших клетках эпидермиса у больных, страдающих коровьей или натуральной оспой.
- 40. Обнаружение телец Бабеша-Негри в мазках-отпечатках, гистологических срезах
- 41. 3. Бляшкообразование вирусов«Бляшками» называют негативные колонии —
- 42. Слайд 42
- 43. Слайд 43
- 44. 4.Выявление гемагглютинина вирусов- гемадсорбция, гемагглютинация.Гемадсорбцией называется адсорбция (прилипание)
- 45. 5.Цветная проба СОЛКАОбычный цвет используемых культуральных сред(среда
- 46. Индикация вирусов на лабораторных животных. О присутствии
- 47. Идентификация вирусов в иммунных реакциях. Идентификация вирусов
- 48. Слайд 48
- 49. Слайд 49
- 50. Вирусологический метод диагностики.отбор материала для исследования; обработка
- 51. 2. Обработка вируссодержащего материала. Проводится с целью
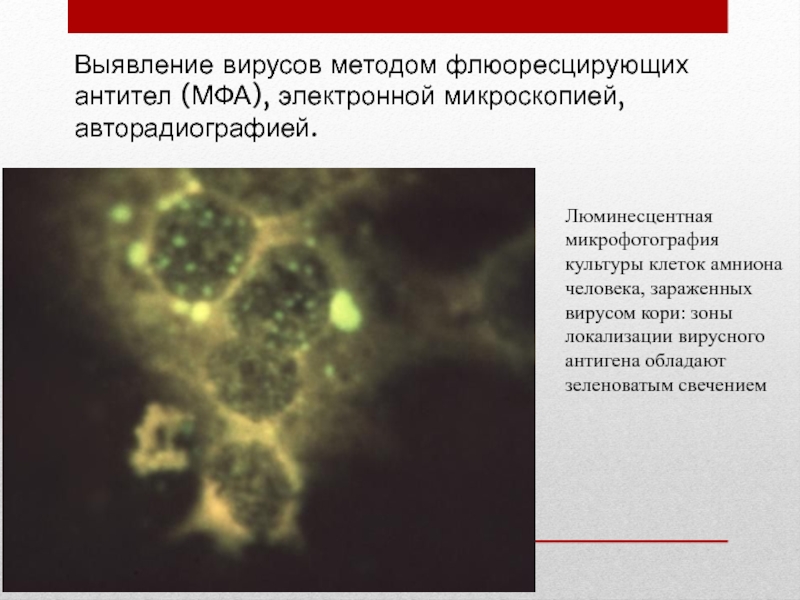
- 52. Выявление вирусов методом флюоресцирующих антител (МФА), электронной
- 53. Скачать презентанцию
Вирусы (лат. «virus» яд) — мельчайшие микроорганизмы, не имеющие клеточного строения, белоксинтезирующей системы и способные к воспроизведению лишь в клетках высокоорганизованных форм жизни (облигатные внутриклеточные паразиты).
Слайды и текст этой презентации
Слайд 3В настоящее время вирусология - бурно развивающаяся наука, что связано
с рядом причин:
- ведущей ролью вирусов в инфекционной патологии человека
(вирус гриппа, ВИЧ, цитомегаловирус и другие герпесвирусы) на фоне практически полного отсутствия средств специфической химиотерапии;- использованием вирусов для решения многих фундаментальных вопросов биологии и генетики.
Слайд 4Основные свойства вирусов , по которым они отличаются от остального
живого мира.
1.Ультрамикроскопические размеры (измеряются в нанометрах). Крупные вирусы (вирус оспы)
могут достигать размеров 300 нм, мелкие- от 20 до 40 нм. 1мм=1000мкм, 1мкм=1000нм.2.Вирусы содержат нуклеиновую кислоту только одного типа- или ДНК (ДНК- вирусы) или РНК (РНК- вирусы).У всех остальных организмов геном представлен ДНК, так и РНК.
3.Вирусы не способны к росту и бинарному делению.
4.Вирусы размножаются путем воспроизводства себя в инфицированной клетке хозяина за счет собственной геномной нуклеиновой кислоты.
5.У вирусов нет собственных систем мобилизации энергии и белок- синтезирующих систем, в связи с чем вирусы являются абсолютными внутриклеточными паразитами.
6.Средой обитания вирусов являются живые клетки - бактерии (это вирусы бактерий/бактериофаги), клетки растений, животных и человека.
Слайд 5Все вирусы существуют в двух качественно разных формах:
внеклеточной- вирион и внутриклеточной-вирус. Таксономия
этих представителей микромира основана на характеристике вирионов - конечной фазы
развития вирусов.Слайд 6Номенклатура вирусов.
Название семейства вирусов заканчивается на “viridae”, рода- “virus”, для
вида обычно используют специальные названия, например — вирус краснухи, вирус
иммунодефицита человека- ВИЧ, вирус парагриппа человека типа 1 и т.д.Слайд 7
Строение (морфология) вирусов.
1.Геном вирусов образуют нуклеиновые кислоты, представленные одноцепочечными молекулами РНК
(у большинства РНК- вирусов) или двухцепочечными молекулами ДНК (у большинства
ДНК- вирусов).2. Капсид — белковая оболочка, в которую упакована геномная нуклеиновая кислота. Капсид состоит из идентичных белковых субъединиц- капсомеров. Существуют два способа упаковки капсомеров в капсид- спиральный (спиральные вирусы) и кубический (сферические вирусы).
Слайд 8При спиральной симметрии белковые субъединицы располагаются по спирали, а между ними,
также по спирали, уложена геномная нуклеиновая кислота.
При кубическом типе симметрии
вирионы могут быть в виде многогранников, чаще всего- двадцатигранники — икосаэдры.Слайд 113.Просто устроенные вирусы имеют только нуклеокапсид, т.е. комплекс генома с капсидом
и называются “голыми”.
4. У других вирусов поверх капсида есть дополнительная
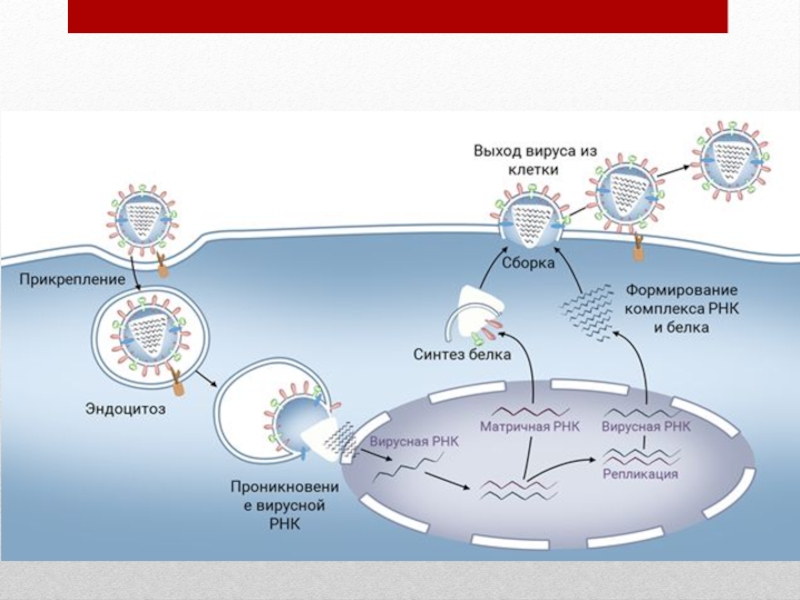
мембраноподобная оболочка, приобретаемая вирусом в момент выхода из клетки хозяина- суперкапсид. Такие вирусы называют “одетыми”.Слайд 12Основные этапы взаимодействия вируса с клеткой хозяина.
1.Адсорбция- пусковой механизм, связанный
со взаимодействием специфических рецепторов вируса и хозяина (у вируса гриппа- гемагглютинин, у
вируса иммунодефицита человека- гликопротеин gp 120).2.Проникновение- путем слияния суперкапсида с мембраной клетки или путем эндоцитоза (пиноцитоза).
3.Освобождение нуклеиновых кислот- “раздевание” нуклеокапсида и активация нуклеиновой кислоты.
4.Синтез нуклеиновых кислот и вирусных белков, т.е. подчинение систем клетки хозяина и их работа на воспроизводство вируса.
5.Сборка вирионов- ассоциация реплицированных копий вирусной нуклеиновой кислоты с капсидным белком.
6.Выход вирусных частиц из клетки, приобретения суперкапсида оболочечными вирусами.
Слайд 13Исходы взаимодействия вирусов с клеткой хозяина.
1.Абортивный процесс- когда клетки освобождаются
от вируса:
- при инфицировании дефектным вирусом, для репликации которого нужен вирус -
помощник, самостоятельная репликация этих вирусов невозможна ( так называемые вирусоиды). Например, вирус дельта (D) гепатита может реплицироваться только при наличии вируса гепатита B, его Hbs — антигена, аденоассоциированный вирус- в присутствии аденовируса);- при инфицировании вирусом генетически нечувствительных к нему клеток;
- при заражении чувствительных клеток вирусом в неразрешающих условиях.
Слайд 142. Продуктивный процесс- репликация (продукция) вирусов:
- гибель (лизис) клеток (цитопатический эффект)- результат
интенсивного размножения и формирования большого количества вирусных частиц — характерный
результат продуктивного процесса, вызванного вирусами с высокой цитопатогенностью (носит достаточно узнаваемый специфический характер);- стабильное взаимодействие, не приводящее к гибели клетки (персистирующие , хронические, медленные, латентные инфекции) — вирусная трансформация клетки.
Слайд 163.Интегративный процесс- интеграция вирусного генома с геномом клетки хозяина.
Вирус
реплицируется вместе с геномом клетки хозяина и может длительно находиться
в латентном состоянии. Встраиваться в ДНК- геном хозяина могут только ДНК- вирусы (принцип “ДНК- в ДНК”). Единственные РНК- вирусы, способные интегрироваться в геном клетки хозяина- ретровирусы, имеют для этого специальный механизм (синтез ДНК провируса на основе геномной РНК с помощью фермента обратной транскриптазы с последующим встраиванием ДНК в геном хозяина).Слайд 18Острая инфекция - после образования вирусного потомства клетка погибает/ выздоравливает
и не содержит вирусных частиц.
Хроническая - клетка продолжает длительно продуцировать
вирусные частицы и передавать эту способность дочерним клеткам.Слайд 19Пути проникновения вируса в организм:
Воздушно-капельный:
1.респираторные вирусы репродуцируются в эпителии
ВДП, местная инфекция
2. ВДП-входные ворота, без местных проявлений- генерализация (ветряная
оспа, корь, паротит)Пищевой: энтеровирусы, реовирусы
Трансмиссивно: арбовирусы
Транскутанно: бешенство, папиллома
Половой: герпес-вирусы
Парентеральный: гепатиты
Вертикальный: герпес, краснуха
Слайд 21Основные методы культивирования вирусов.
1.В организме лабораторных животных.
2.В куриных эмбрионах.
3.В клеточных
культурах — основной метод.
Слайд 22Культура клеток
популяция однотипных клеток организма животных или человека, которая
выращивается в искусственных условиях и предназначается для культивирования вирусов. По
длительности жизни клеточные культуры подразделяются на:1) первичные;
2) полуперевиваемые;
3) перевиваемые.
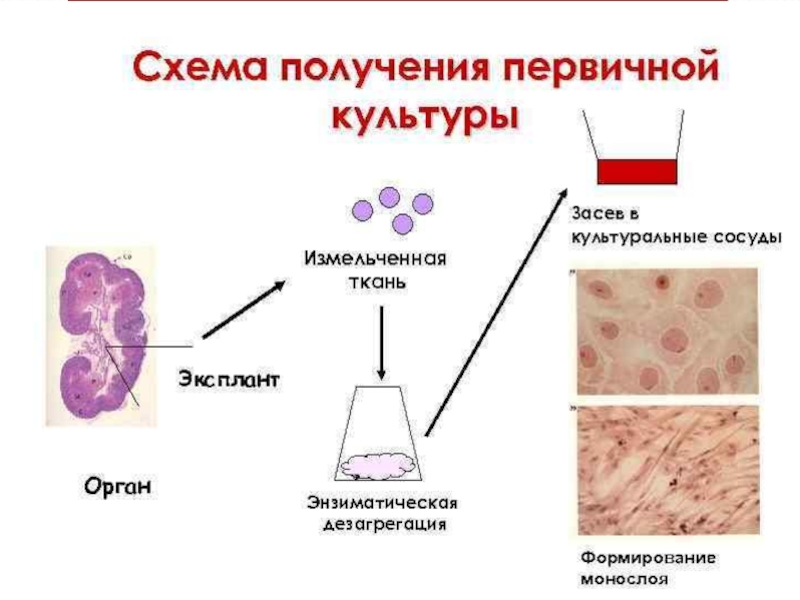
Слайд 23Первичные культуры клеток получают из тканей животных и человека путём
их ферментативной дезинтеграции. Кусочки ткани помещают в 0,25 % раствор
трипсина при температуре 37˚С и периодически перемешивают. В результате этого происходит отделение клеток ткани друг от друга. Порции клеток собирают по мере их отделения, центрифугируют, трипсин сливают, вносят среду роста и суспендируют в ней клетки. Первичные культуры клеток могут претерпевать до 10 делений in vitro, обладают высокой чувствительностью ко многим вирусам, могут быть получены в большом количестве, безопасны в онкогенном отношении. Недостаток: трудоёмкость и длительность получения, а также возможная контаминация латентными вирусами. К первичным культурам клеток относятся клетки почки эмбриона человека, макаки резус, эмбриона свиньи, фибробласты куриных эмбрионов.Слайд 25Полуперевиваемые культуры клеток представляют собой диплоидные клетки одного типа, которые
способны претерпевать in vitro до 100 делений, сохраняя при этом
исходный диплоидный набор хромосом. К полуперевиваемым культурам клеток относятся фибробласты эмбриона человека. Эти клетки чрезвычайно требовательны к условиям культивирования, поэтому в практике вирусологических лабораторий имеют ограниченное применение.Слайд 26Перевиваемые культуры клеток – это однотипные опухолевые или нормальные клетки
человека и животных с изменённым кариотипом, способные к неограниченному росту
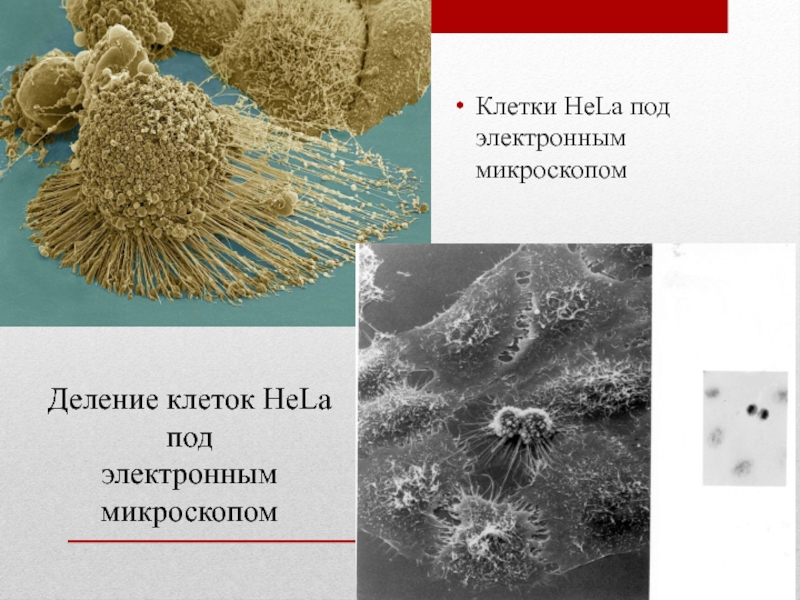
в условиях in vitro. Перевиваемые культуры клеток просты при культивировании, в связи с чем широко используются при лабораторной диагностике вирусных заболеваний у человека. К перевиваемым культурам клеток относятся линии НеLа (клетки карциномы шейки матки человека), КВ (клетки карциномы полости рта человека), Vero (клетки почки зеленой мартышки), СПЭВ (клетки почки эмбриона свиньи) и др.Слайд 27HeLa — линия «бессмертных» клеток, используемая во множестве научных исследований в области биологии и
фармакологии
Линия была получена 8 февраля 1951 года из раковой опухоли шейки матки пациентки
по имени Генриетта Лакс (англ. Henrietta Lacks), умершей от этого заболевания 4 октября того же года.Клетки из опухолевого образования Генриетты были изъяты без её ведома и согласия исследователем Джорджом Гейем, который обнаружил, что в них можно поддерживать жизнь. Ему удалось выделить одну конкретную клетку, умножить её и начать клеточную линию. Он назвал их клетками HeLa, по начальным буквам имени Генриетты Лакс. Это первые клетки, выращенные в лаборатории, которые были «бессмертными» — они не погибали после нескольких делений и могли быть использованы во многих экспериментах.
Особенности
Клетки HeLa называют «бессмертными», они способны делиться бесконечное число раз, в отличие от обычных клеток, имеющих предел Хейфлика. Это происходит потому, что как и при многих типах раковых опухолей, клетки HeLa производятфермент теломеразу, которая наращивает теломеры на концах ДНК хромосом. Существующая по сей день популяция клеток HeLa унаследована от образцов ткани, извлечённой у Генриетты Лакс. Эти клетки пролиферируют необычайно быстро, даже в сравнении с другими раковыми клетками. Иногда эти клетки заражают культуры других клеток.
Клетки HeLa были с самого начала заражены вирусом папилломы, что часто случается с клетками рака, от которого умерла Генриетта. Клетки HeLa обладают аномальным кариотипом, различные сублинии HeLa имеют 49 — 78 хромосом, в отличие от нормального кариотипа человека, содержащего 46 хромосом.
Клетки HeLa эволюционировали за эти годы, адаптируясь к росту in vitro, и по причине их разделения возникло несколько ветвей. На данный момент существует несколько линий клеток HeLa, все они происходят от общего предка, эти линии клеток используют, в том числе в качестве модели раковых клеток, для исследования механизмов передачи сигнала между клетками и для других применений.
Слайд 29Специальные питательные среды для культур клеток.
синтетические вирусологические питательные среды сложного
состава с факторами роста- среда 199, Игла, раствор Хэнкса, гидролизат
лактальбумина. В среды добавляют стабилизаторы рН (Hepes), различные в видовом отношении сыворотки крови (наиболее эффективной считают эмбриональную телячью сыворотку), L-цистеин и L-глютамин.В зависимости от функционального использования среды могут быть ростовые (с большим содержанием сыворотки крови) — их используют для выращивания клеточных культур до внесения вирусных проб, и поддерживающие (с меньшим содержанием сыворотки или ее отсутствием)- для содержания инфицированных вирусом клеточных культур.
Слайд 30Выращивание культур клеток независимо от их типа проводится в стерильных
условиях в специальных плоских стеклянных сосудах – матрацах, в которые
вносится питательная среда. На дне матраца клетки при своем размножении образуют монослой.Слайд 31Куриные эмбрионы. Широко доступны и просты в работе. Применяют куриные
эмбрионы в возрасте от 5 до 14 дней. Перед заражением
куриные эмбрионы овоскопируют: определяют их жизнеспособность, отмечают на скорлупе границу воздушного мешка и месторасположение эмбриона («темный глаз» эмбриона). Работа с куриными эмбрионами проводится в стерильном боксе стерильными инструментами (пинцеты, шприцы, ножницы, копье и др.). После выполнения фрагмента работы инструменты погружают в 70 % этиловый спирт и перед следующей манипуляцией прожигают. Перед заражением скорлупу куриного эмбриона протирают горящим спиртовым тампоном и спиртовым раствором йода. Объем исследуемого материала, вводимого в эмбрион, составляет 0,1-0,2 мл. Для выделения вирусов из одного материала используют не менее 4 куриных эмбрионов.После заражения эмбрионы инкубируют в термостате, располагая тупым концом кверху. Температура и продолжительность инкубации зависят от биологических свойств изолируемого вируса. По окончании инкубации эмбрионы охлаждают при +4˚С 16-18 ч. После этого куриный эмбрион стерильно вскрывают, вырезая в скорлупе отверстие над воздушным мешком выше обозначенной границы. Пастеровской пипеткой или шприцем отсасывают аллантоисную, затем амниотическую жидкость, разрезают хорион-аллантоисную оболочку для изучения, остальное содержимое яйца извлекают в чашку Петри. Аллантоисная и амниотическая жидкости используются для индикации вирусов.
Слайд 34Индикация вирусов – это обнаружение вирусов в исследуемом материале без
установления их принадлежности к семейству, роду, виду или сероварианту.
Слайд 351.Цитопатический эффект.
Цитопатические эффекты вирусов оценивают при микроскопии клеточных культур.
Размножение
вирусов в культурах клеток сопровождается нарушениями морфологии клеток монослоя. Некоторые
вирусы вызывают характерные цитопатические изменения, что позволяет быстро поставить предварительный диагноз.Слайд 382. Тельца включений.
Многие вирусы вызывают появление в заражённых клетках
характерных образований — скоплений вирусных белков или частиц, видимых в
световой микроскоп. Тельца включений могут располагаться как в цитоплазме (тельца Гварнери при оспе), так и в ядрах клеток (аденовирусы).Слайд 39ТЕЛЬЦА ПАШЕНА
вирусные частицы, обнаруживаемые в ороговевших клетках эпидермиса у больных,
страдающих коровьей или натуральной оспой.
Слайд 40Обнаружение телец Бабеша-Негри в мазках-отпечатках, гистологических срезах мозга и ткани
слюнных желез также быстрым методом диагностики бешенства.
В одной клетке может
быть одно или несколько телец. Они окружены четко очерченной оболочкой и имеют внутреннюю структуру в виде базофильной зернистости, чаще располагаются около ядра.Слайд 413. Бляшкообразование вирусов
«Бляшками» называют негативные колонии — участки разрушенных клеток,
выглядящие как зоны просветления на монослоях клеток, покрытых слоем агара.
В некоторых случаях дозу и цитопатогенность вируса выражают в бляшкообразуюших единицах (БОЕ).Слайд 444.Выявление гемагглютинина вирусов- гемадсорбция, гемагглютинация.
Гемадсорбцией называется адсорбция (прилипание) эритроцитов к поверхности
клеток, зараженных вирусом. Чаще это явление наблюдают у гемагглютинирующих вирусов.
Чтобы наблюдать гемадсорбцию, из пробирки с зараженной вирусом культурой клеток удаляют культуральную жидкость и вносят 0,5%-ную взвесь эритроцитов, оставляют на 5—10 мин, затем слой клеток споласкивают физиологическим раствором (чтобы смыть эритроциты).
Если в зараженной культуре клеток идет репродукция вируса, то на таких клетках под малым увеличением микроскопа можно видеть адсорбировавшие эритроциты, в контрольных (незараженных) культурах клеток таковые отсутствуют.
Слайд 455.Цветная проба СОЛКА
Обычный цвет используемых культуральных сред(среда Игла, 199), содержащих
в качестве индикатора рН феноловый красный, при оптимальных для клеток
условиях культивирования (рН около 7,2)- красный.Размножение клеток, не зараженных вирусом, меняет рН и соответственно- цвет среды с красного на желтый за счет смещения рН в кислую сторону.
При размножении в клеточных культурах вирусов происходит лизис клеток, изменения рН и цвета среды не происходит.
Слайд 46Индикация вирусов на лабораторных животных. О присутствии вирусов в организме
свидетельствует развитие симптомов заболевания или гибель животного.
Слайд 47Идентификация вирусов в иммунных реакциях.
Идентификация вирусов – это установление
их вариантной, видовой, родовой и семейственной принадлежности. Идентификация вирусов проводится
по принципу: определение неизвестного по известному. Известным компонентом при идентификации вирусов являются специфические противовирусные сыворотки (противогриппозные, противокоревые и др.), которые используют в серологических реакциях нейтрализации (РН), торможения гемадсорбции (РТГадс), торможения гемагглютинации (РТГА), РПГА, РСК, а также при ИФА и РИА. Эти сыворотки содержат специфические противовирусные антитела и называются диагностическими.Слайд 50Вирусологический метод диагностики.
отбор материала для исследования;
обработка вируссодержащего материала;
заражение
материалом чувствительных живых систем;
индикация вирусов в живых системах;
титрование
выделенных вирусов; идентификация вирусов в иммунных реакциях.
1. Отбор материала для исследования. Проводится в ранние сроки заболевания при соблюдении правил, предотвращающих контаминацию материала посторонней микрофлорой и инфицирование медицинского персонала. Для предупреждения инактивации вирусов при транспортировке материала, он помещается в вирусную транспортировочную среду (ВТС), состоящую из сбалансированного солевого раствора, антибиотиков и сывороточного альбумина. Транспортируется материал в специальном контейнере с термоизоляцией и закрытыми пластиковыми пакетами, содержащими лед. При необходимости материал хранят при -20˚С. Каждый образец материала для исследования должен иметь маркировку и этикетку с указанием фамилии больного, типа материала, даты его забора, развернутый клинический диагноз и другие сведения.