Слайд 2План
1. Вода як хімічна сполука, її структура, ізотопний склад
2.
Хімічні властивості води
3. Вода як розчинник. Соляний склад природних
вод
4. Солоність води та її визначення
5. Значення води в житті людини
6. Гігієнічне та епідеміологічне значення води
7. Контроль якості води – важлива вимога сьогодення
8. Фізіологічне значення мінеральних речовин
Висновки
Слайд 3 Найважливішою з неорганічних речовин, що входять до складу
живих організмів, є вода - Н2О. Вода є основним середовищем,
у якому відбуваються процеси обміну речовин та перетворення енергії.
Слайд 4Вода як хімічна сполука, її структура, ізотопний склад
Вода
- це хімічна сполука водню з киснем. Вода складається з
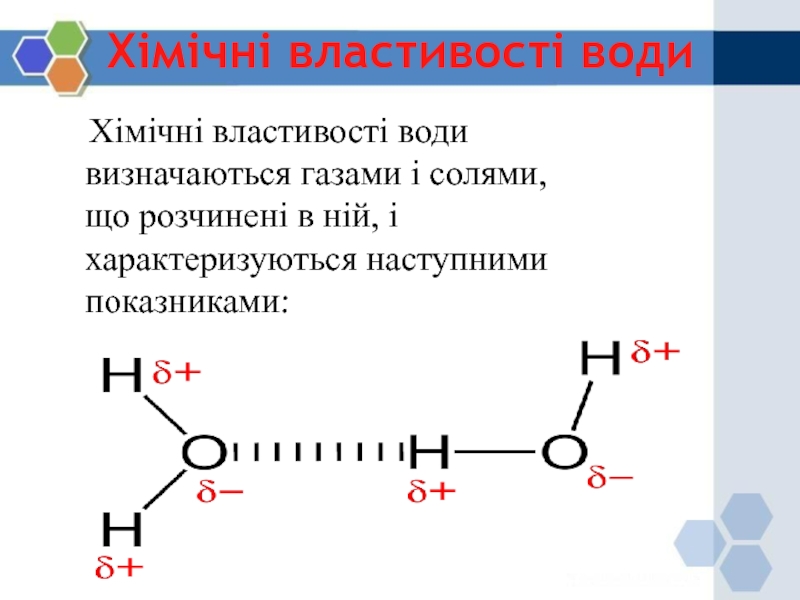
11,11% водню і 88,89% кисню (по масі). При утворенні води з одним атомом кисню з'єднується два атоми водню. В молекулі води атоми кисню і водню розташовані по кутах рівнобедреного трикутника: при вершині знаходиться атом кисню, а в кутах при основі - по атому водню. Внаслідок того, що обидва атома водню зсунені в одну сторону від атому кисню, молекули води характеризуються значною полярністю, тобто неврівноваженістю позитивних і негативних електричних зарядів.
Слайд 5Вода як хімічна сполука, її структура, ізотопний склад
Сторона
молекули з атомом кисню має деякий надмір негативного заряду електрики,
а протилежна сторона, в котрій знаходяться атоми водню, - надмір позитивного заряду. Полярність та деякі інші сили обумовлюють здатність молекули води об'єднуватися в асоціації - по декілька разом.
Слайд 6Вода як хімічна сполука, її структура, ізотопний склад
У
льоді звичайно переважають молекули тригідроля, що мають найбільший об'єм, а
прості, що не поєдналися, відсутні. В пароподібному стані при температурі вище 1000С вода складається головним чином з молекул гідроля, тому що значна швидкість руху молекул при цій температурі порушує асоціацію (об'єднання) молекул. В рідкому стані вода являє собою суміш гідроля, дигідроля та тригідроля. Співвідношення між цими ізотопами залежить від температури.
Слайд 7Хімічні властивості води
Основні хімічні властивості води - агресивність і накипоутворення.
Агресивність - це здатність води руйнувати метали, бетон і вапняні
кладки, газами і солями, що розчинені в ній, а також вилуженням.
Накипоутворення - це відкладення карбонатних солей на стінках парових котлів, чайників та ін.
Вода має і лікувальні властивості. Це мінеральні води, що вміщують специфічні мікроелементи або розчинені гази (сірководень).
Слайд 8Хімічні властивості води
Хімічні властивості води визначаються газами і
солями, що розчинені в ній, і характеризуються наступними показниками:
Слайд 9Хімічні властивості води
а). Концентрація іонів водню (рН):
Концентрація іонів водню у воді - це вміст іонів водню
в розчині, що виражається в грам-іонах на літр розчину. Якщо в воді при 22оС вміщується 10-7 г/л іонів водню (Н+), то вона буде мати нейтральну реакцію; при меншому вмісті іонів водню реакція буде лужною, а при більшому - кислотною.
Концентрацію іонів водню прийнято виражати умовно символом рН, що означає від'ємний логарифм числа, що її характеризує.
Таким чином, при рН=7 реакція води нейтральна, при рН<7 - кисла, а при рН>7 - лужна.
Слайд 10Хімічні властивості води
б). Жорсткість:
Жорсткість
води виражається сумою міліграм-еквівалентів кальцію і магнію, що вміщуються в1
л води.
Розрізняють жорсткість загальну, переборну та постійну.
Загальна жорсткість - це загальна кількість кальцію і магнію, що вміщуються в воді.
Переборна жорсткість характеризує ступень зменшення жорсткості води при тривалому її кип'ятінні.
Постійна жорсткість - це жорсткість, що залишається після випадання карбонатних солей в результаті кип'ятіння води.
В залежності від загальної жорсткості розрізняють воду: дуже м'яку (до 1,5 мг-екв/л), м'яку (1,5 - 3,0 мг-екв/л), помірно жорстку (3 - 6 мг-екв/л), жорстку (7 - 9 мг-екв/л), дуже жорстку (вище 9 мг-екв/л).
Слайд 11Хімічні властивості води
в). Мінералізація води:
Мінералізація води
- це ступень концентрації та склад розчинених у воді речовин.
В залежності від відносного складу розчинених мінеральних речовин води поділяють на:
прісні - з вмістом розчинених речовин до 1 г/кг;
солонуваті - до 1 - 25 г/кг;
солоні - >25 г/кг.
Природні води, що мають мінералізацію більше 1 г/л і вміщують ряд специфічних мікроелементів, які благотворно впливають на людину, називаються мінеральними.
Слайд 12Вода як розчинник. Соляний склад природних вод
Природні води - це однорідний розчин, до складу якого входять
вода, солі, незначна кількість завислих твердих частинок, розчинених газів і органічних сполук.
Природні води мають гідрохімічну класифікацію. Гідрохімічна класифікація - це поділ вод на певні групи в залежності від наявності й співвідношення в них (в мг/екв) різних іонів. Іони в природних водах представляють собою атоми, у яких порушена електростатична рівновага внаслідок переходу деякої частини їх електронів у склад сусідніх атомів або внаслідок залучення зайвих електронів. Позитивно заряджені іони, тобто атоми, що лишилися частини електронів, називаються катіонами, а негативно заряджені - аніонами.
Слайд 13Вода як розчинник. Соляний склад природних вод
Процес
утворення іонів в природних водах відбувається, наприклад, при розчині у
воді електролітів (кислот, основ, солей). В гідрохімії розглядаються головним чином розчини солей.
По О.А. Альокіну, виділяються наступні гідрохімічні класи вод:
1) гідрокарбонатний з перевагою іонів НСО3 - + СО3 2-;
2) сульфатний з перевагою іонів SO4 2-;
3) хлоридний з перевагою іонів Cl-.
Слайд 14Вода як розчинник. Соляний склад природних вод
Кожний
клас поділяється потім на три групи по катіону, що переважає:
кальцій (Са2+), магній (Mg2+) або натрій + калій (Na+ + K+).
В свою чергу кожна група поділяється на три типи, що характеризуються різними співвідношенням між іонами.
Перший тип характеризується співвідношенням:
НСО3 - > Са2+ + Mg2+;
Для другого типу характерно співвідношення:
НСО3 - < Са2+ + Mg2+ < НСО3 - + SO4 2-;
Третій тип має співвідношення:
НСО3 - + SO4 2- < Ca2+ + Mg2+;
Четвертий тип характеризується простим співвідношенням:
НСО3 - = 0,
тобто води цього типу кислі. Завдяки цьому в клас карбонатних вод цей тип не входить, а належить тільки до сульфатного і хлоридного класів в групах Са2+ і Mg2+, де немає першого типу.
Слайд 15Солоність води та її визначення
Здавалось би, випарювання
- це самий простий спосіб відділити солі від води, в
якій вони розчинені. Якби можна було випарити всю воду без втрати солей, ми змогли б визначити масу солі, розчиненої в одиниці маси морської води. В дійсності, на жаль, при нагріванні морської води до температури кипіння деякі іони при взаємодії утворюють гази, що теж випаровуються в атмосферу. По цій причині такий спосіб визначення солоності води не можна вважати задовільним.
Слайд 16Солоність води та її визначення
В 1 кг
морської води розчинено близько 35 г солі. Вісім іонних компонентів
складають 99,9 % від всієї маси солі і їх вважають основними елементами соляного складу морської води:
Хлорид (Cl-) ............................ 55,04 %
Натрій (Na+)............................ 30,61 %
Сульфат (SO4).......................... 7,68 %
Магній (Mg++)......................... 3,69 %
Кальцій (Ca++)........................ 1,16 %
Калій (К+)................................. 1,10 %
Бікарбонат (НСО3-).............. 0,41 %
Бромід (Br-)............................. 0,19 %
Інші........................................... 0,12 %
Слайд 17Солоність води та її визначення
Ще в позаминулому столітті
було встановлено, що хоча концентрація солі в пробах води, взятих
в різних місцях Світового океану, різна, однак співвідношення основних солей залишаються на диво сталими (постійними). Новітні дані стверджують, що це практично справедливо для всіх випадків, за винятком дуже круто розведеної морської солі (рапи).
Слайд 18Солоність води та її визначення
Приблизно до 1960
р. закон сталості соляного складу морської води був основою для
визначення вмісту в морській воді солі, тобто солоності, яка визначається в г/кг, або промілях (‰). По даному методу визначали хлорність морської води титруванням із нітратом срібла. Хлорність - це сумарний вміст хлору, брому, йоду, що випадають в осад у вигляді сполук срібла в даній масі морської води. Цей осад забарвлений у білий колір. Потім по хлорності розраховують солоність. Для цього використовують наступне емпіричне співвідношення:
S = 1,80655 Cl
Слайд 19Солоність води та її визначення
В останні роки
визначення солоності титруванням хлору було замінено вимірюванням електропровідності, для чого
використовується так званий вимірювач солоності (солемір). Цей спосіб дуже ефективний, оскільки ці вимірювання виконуються достатньо швидко. До того ж електричні сигнали легко передаються на реєстратор, якщо необхідно провести вимірювання на глибині. Основні проблеми при цьому виникають із-за сильної залежності електропровідності від температури і в меншому ступені - від тиску. Для усунення їхнього впливу зараз використовують спеціальні компенсатори.
Максимального значення солоність верхнього шару морської води досягає в районі двадцятих градусів широти, де випаровування перевищує опади (зона пасатної циркуляції). В екваторіальній зоні значні опади, а в високих широтах утворення й танення криги ускладнює розподіл солоності верхнього шару й призводить до її сезонних коливань. На значній глибині значення солоності води майже не відчувають коливань - нижче двох кілометрів солоність майже не змінюється, знаходячись між 34,5 та 35 ‰.

Слайд 20Значення води в житті людини
Вода є одним з
найважливіших елементів біосфери. Без води неможливе життя людей, тварин і
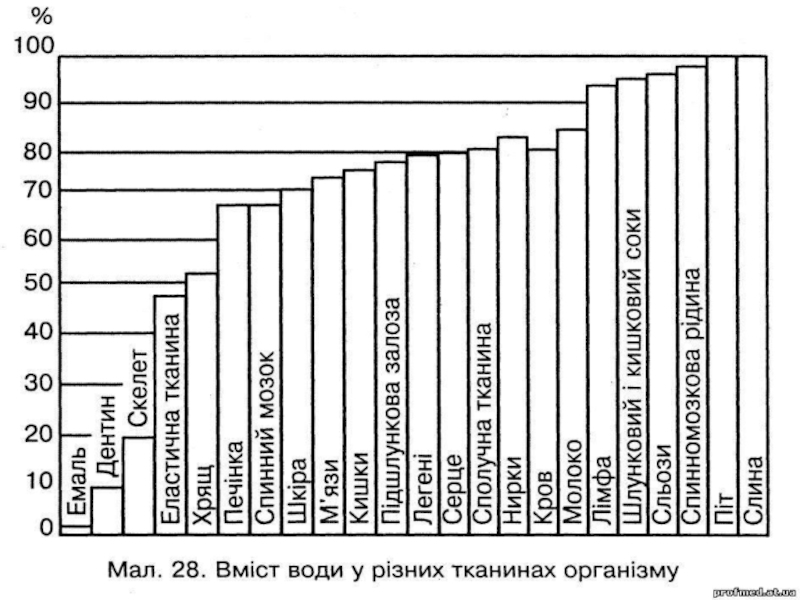
рослин. Людина без води може прожити не більше 5-6 діб. Організм дорослої людини складається в середньому на 65 % з води. З віком її кількість зменшується. Так, зародок людини містить 97 % води, організм новонароджених -77 %, у 50 річному віці кількість води в організмі становить лише 60 %. Основна маса води (70 %) зосереджена всередині клітин, а 30 % - це позаклітинна вода, яка розподілена в організмі неоднаково: менша (близько 7 %) - це кров ї лімфа, більша - вода, що омиває клітини. У різних органах і тканинах вміст води теж неоднаковий: скелет містить 20 %, м'язова тканина - 76, сполучна тканина - 80, плазма крові - 92, склоподібне тіло - 99 % води.
Слайд 22Значення води в житті людини
Для задоволення фізіологічних потреб
людині необхідно 2,5-3,0 л води на добу. Вона в організм
людини надходить з питвом і харчовими продуктами. З водою потрапляє багато фізіологічно необхідних солей, в тому числі таких макро- і мікроелементів, як кальцій, магній, натрій, калій, йод, фтор тощо.
Слайд 23Значення води в житті людини
Скільки води надходить в
організм людини, стільки ж її і виділяється. У стані спокою
вода з організму людини виводиться через нирки із сечею —1,5 л/добу, через легені у вигляді водяної пари - приблизно 0,4 л, через кишечник з калом - близько 0,2 л. Ще 0,6 л води виділяється через пори шкіри, що пов'язано з терморегуляцією організму. Таким чином, щодоби з організму людини в стані спокою виводиться приблизно 3 л води. При важкій роботі, роботі в гарячих цехах, влітку в полі, при патологічних станах тощо її виводиться до 8-10 л.
Слайд 24Значення води в житті людини
Організм людини погано
переносить зневоднення. Втрата 1,0-1,5 л води вже викликає відчуття спраги.
Воно пов'язано із збудженням певних відділів центральної нервової системи ("питного" центру), які беруть участь у регуляції і поповненні водних ресурсів організму. Якщо втрата води не відновлюється, тоді погіршується самопочуття, знижується працездатність, порушуються водно сольовий обмін, терморегуляція і може настати перегрів організму. Недостатнє споживання води негативно впливає на всмоктування поживних речовин у кишках. Втрата води в кількості 15-20 % маси тіла при температурі повітря понад 30 °С є смертельною, а 25 % - є смертельною і при нижчій температурі. Це так зване фізіологічне значення води.
Слайд 25Гігієнічне та епідеміологічне значення води
Гігієнічне значення води
полягає у використанні води для підтримки чистоти тіла, приготування їжі
й миття посуду, прання білизни, прибирання житла і громадських приміщень, видалення нечистот через каналізаційну мережу, поливу вулиць і зелених насаджень. Вода сприяє покращенню умов проживання населення. Обводнення, створення озер, ставків, водосховищ, фонтанів покращують мікроклімат місцевості. Це особливо важливо в південних районах, де висока середньорічна температура і низька вологість повітря.
Слайд 26Гігієнічне та епідеміологічне значення води
Епідеміологічне значення води
і його знання надзвичайно важливі в роботі медичних працівників різних
ланок. Воно значною мірою залежить від умов водопостачання, санітарної очистки населених місць, рівня санітарної освіти населення. Забруднена вода може бути причиною виникнення ряду шлунково-кишкових захворювань. Насамперед до них відносяться гострі кишкові інфекції (холера, черевний тиф, паратифи, бактерійна й амебна дизентерії, гострі ентерити інфекційного характеру). У США і країнах Західної Європи ці захворювання ще в XIX столітті були справжнім лихом, проявлялись у вигляді страхітливих епідемій І забирали у могилу тисячі людей. У 1996 році спостерігався великий спалах холери (Ель-Тор) у м. Маніпура (Індія). Захворіло близько 1200 людей. Причиною епідемії була річкова вода, забруднена стічними водами населеного пункту, розташованого вище за течією.
Слайд 28Контроль якості води – важлива вимога сьогодення
Вода,
що використовується населенням для пиття і господарсько-побутових цілей, повинна відповідати
певним гігієнічним вимогам, викладеним в Державних санітарних правилах і нормах (ДСанПіН) України № 383 1996 року "Вода питна. Гігієнічні вимоги до якості води централізованого господарсько-питного водопостачання".
Слайд 29Контроль якості води – важлива вимога сьогодення
Згідно з вимогами доброякісна питна вода повинна:
1. Бути безпечною в
епідемічному відношенні. Вода не повинна містити патогенних мікробів, вірусів та інших біологічних включень, небезпечних для здоров'я споживачів.
2. Бути нешкідливою за хімічним складом (хімічні речовини не повинні завдавати шкоди споживачеві або обмежувати використання води в побуті).
3. Мати добрі органолептичні властивості (бути прозорою, без кольору, не мати будь-якого присмаку або запаху).
4. Бути безпечною в радіаційному відношенні.
Слайд 30Контроль якості води – важлива вимога сьогодення
Показники
нешкідливості хімічного складу питної води включають регламенти для неорганічних і
органічних компонентів. Переважно до них відносяться1 високотоксичні хімічні елементи (2-го класу небезпеки). Вони допускаються у питній воді в такій кількості: алюміній — 0,2 (0,5) мг/дм3, барій і нікель - 0,1 мг/дм3, миш'як, селен і свинець не більше 0,01 мг/дм3. Дещо у вищих концентраціях допускається вміст фтору (1,5 мг/дм3) і нітратів (45,0 мг/дм3). Сумарна концентрація пестицидів не повинна перевищувати 0,0001 мг/дм3, тригалометанів (ТГМ) - 0,1 мг/дм3,інакше вода буде негативно впливати на здоров'я людей.
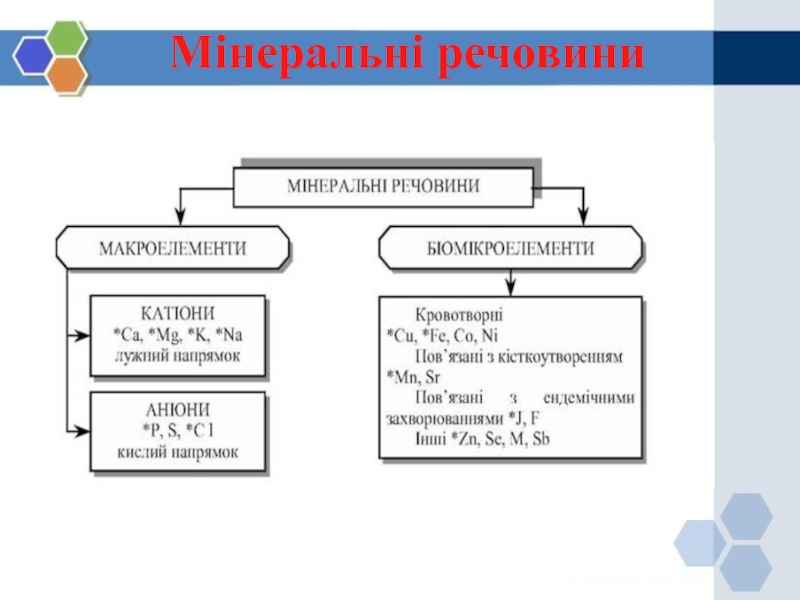
Слайд 32Фізіологічне значення мінеральних речовин
Фізіологічне значення мінеральних
речовин дуже велике. Вони входять в склад білків, кісток скелету,
ферментів, гормонів. Загальна кількість мінеральних речовин становить 4,5% всього тіла, із них 5/6 входить в склад кісток. Мінеральні речовини забезпечують нормальну реалізацію всіх функцій організму. Іони мінеральних речовин підтримують постійність астматичного тиску, активність реакції крові і тканин. Вони необхідні для діяльності нервової системи, згортання крові, всмоктування, обміну газами. Вони не являються джерелом енергії. При надлишку в їжі повареної солі в шкірі створюються запаси хлористого натрію, які використовуються при споживанні їжі, бідною повареною сіллю.
Слайд 33Фізіологічне значення мінеральних речовин
НАТРІЙ забезпечує постійність
осмотичного тиску внутрішньоклітинної рідини. Синтез і відкладання глікогену в тканинах
здійснюється з поглинанням іонів калію. Недостатність іонів калію тормошить анаболічні процеси в організмі.
ХЛОР являється важливим аніоном зовнішньо клітинної рідина, забезпечуючи постійність осмотичного тиску.
КАЛЬЦІЙ і ФОСФОР знаходяться в основному в кістковій тканині. Утримання кальцію в плазмі і крові являється одною з біологічних констант, так як навіть незначні здвигни в рівні цього іона можуть призвести до тяжких наслідків для організму. Зменшення рівня кальцію у крові викликає скорочення м’язів, судороги і в результаті зупинки дихання настає смерть. Збільшення рівня кальцію в крові супроводжується зменшенням збудливості нервової і м’язової тканин, появленням паралічів, ран. Кальцій необхідний для побудови кісток, тому він повинен надходить в достатній кількості в організм з їжею.
Фосфор бере участь в обміні багатьох речовин, так як входить в склад макроергічних з’єднань (наприклад, АТФ). Велике значення має відкладання фосфору в кістках.

Слайд 34Фізіологічне значення мінеральних речовин
ЗАЛІЗО знаходиться в організмі
у вигляді комплексних солей. Залізо входить всклад гемоглобіну, міоглобіну, а
також в склад ферментів, які беруть участь в окислювально-відновлювальних реакціях. Недостатнє надходження в організм заліза супроводжується нарушенням синтезу гемоглобіну. Зменшення синтезу гемоглобіну веде до анемії (малокрів’я). Добова необхідність в залізі дорослої людини становить 10-30 мкг.
ЙОД в організмі утримується в невеликій кількості. Загалом його значення велике. Це зв’язано з тим, що йод входить всклад гормонів щитовидної залози, які виявляють виражений вплив на всі обмінні процеси, ріст і розвиток організму.
Найбільше значення мають іони – хлориди, фосфати, сульфати, карбонати, силікати і катіони – натрій, калій, кальцій, залізо, магній, мідь. Крім цього, у відновленні фізіологічних процесів організму беруть участь фосфор, сірка, йод, цинк, бром, фтор.
Добова потреба людини: в натрію – 4-6г, кальцію – 1г (вагітні жінки і матері, які годують дітей груддю – 1,5-4г), калію – 3г, фосфорі – 1,5г, залізі – 15-30 мг.

Слайд 35Фізіологічне значення мінеральних речовин
Мінеральні речовини, які
складають основну частину цитоплазми, називаються макроелементами (натрій, кальцій, фосфор), а
ті, які утримуються в малих кількостях, називаються мікроелементами (марганець, кобальт, мідь, цинк, бром, йод, хром, фтор, миш’як, молібден).
Макроелементи накопичуються в органах нерівномірно: мідь – в печінці і кістковому мозку, хром, марганець, бром – в гіпофізі, цинк – головним чином в статевих залозах, гіпофізі і підшлунковій залозі, нікель – в підшлунковій залозі, кадмій – в нирках, стронцій – в кістках.
Мікроелементи входять в склад ферментів гормонів і вітамінів і посилюють їх дію. Цинк утримується у ферментах обміну білків і карбоангідразе, залізо – в дихальних ферментах, хром – в трипсині. Кобальт активує ферменти м’язів, марганець – фосфату крові і тканин. В гормоні щитовидної залози знаходяться йод, в підшлунковій – цинк, в гіпофізі – бром. У вітамін В12 входить кобальт. Марганець активізує вітамін В1, мідь – вітамін А, групи В,С, Е і РР, підвищений вміст міді в їжі супроводжується великим збільшенням вітаміну В1.

Слайд 36Фізіологічне значення мінеральних речовин
Практичне значення мікроелементів
дуже велике. Наприклад, кобальт необхідний для внутріутробного розвитку. Він підвищує
м’ясну і шерстну продуктивність сільськогосподарських тварин. Мідь бере участь у внутрітканинному диханні, впливає на розмноження тварин. Ці два мікроелементи утримуються головним чином в печінці.
В процесі росту кісток і нервової тканини дитини використовуються натрій, калій, кальцій, фосфор. Для росту кісток організму і для розмноження тварин необхідний марганець..
Найбільша кількість кобальту, міді і цинку утримують картопля, капуста (особливо цвітна), столовий буряк, морква, квас, жовток курячого яйця, печінка, гов’ядина, лящ, щука. В малині міститься марганець, а в абрикосах – мідь.
Слайд 37Фізіологічне значення мінеральних речовин
В рослинній їжі і
воді різних геохімічних зон знаходяться різні мікроелементи. Тому необхідно нормалізувати
їх утримання в їжі і воді.
Мінеральні речовини виводяться із організму з сечею, калом і потом, тому цю втрату потрібно зрівнювати їх поступлення в організм.
Недостатність неорганічних сполучень викликає розлад фізіологічних функцій і може призвести до смерті. А з другої сторони, їх залишок також призводить до порушення функцій організму. Наприклад, введення великої кількості солей натрію викликає у дітей підвищення температури – солева лихоманка.
Слайд 39ЗАХВОРЮВАННЯ ПОВЯЗАНІ З НЕСТАЧЕЮ ВОДИ
Найпростіший прояв нестачі води в організмі
- це спрага і сухість у роті. При тривалій недостатності
води в організмі починають страждати внутрішні органи: нирки, печінка, шлунок, підшлункова залоза. У людини може підніматися артеріальний тиск через те, що кров стає дуже густою. Нестача води в організмі проявляється у вигляді сухої шкіри обличчя, сухого і ламкого волосся, ламких і нееластичних нігтів.
До складу клітини входить лімфа, що має здатність накопичувати в собі токсини. При недостатньому вживанні води клітина недоотримує рідину, і токсини з неї не виводяться. Зневоднення клітин призводить до раннього старіння всього організму.
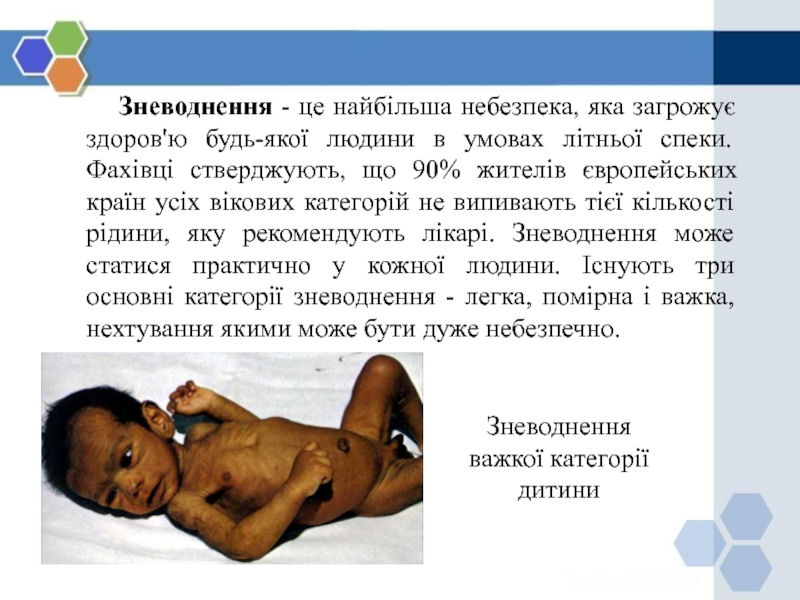
Слайд 40 Зневоднення - це найбільша небезпека, яка загрожує здоров'ю
будь-якої людини в умовах літньої спеки. Фахівці стверджують, що 90%
жителів європейських країн усіх вікових категорій не випивають тієї кількості рідини, яку рекомендують лікарі. Зневоднення може статися практично у кожної людини. Існують три основні категорії зневоднення - легка, помірна і важка, нехтування якими може бути дуже небезпечно.
Зневоднення важкої категорії
дитини
Слайд 41 Почуття спраги літніх людей стає слабким, тому часто
вони схильні просто забувати пити воду.
Симптоми зневоднення зазвичай стають помітними
після втрати 2% води організму. Легке зневоднення проявляється через спрагу, зниження об’єму сечі, дратівливість, відсутність сліз, сухість у роті, запаморочення. В деяких випадках безсоння також є симптомом легкого зневоднення.
Під час помірної і важкої дегідратації спостерігається млявість або сонливість, судоми, западання очей, можлива втрата свідомості. Інші симптоми зневоднення можуть включати в себе головні болі, схожі на ті, що бувають при похміллі, м’язові спазми та зниження артеріального тиску.
Слайд 42Недолік мінеральних речовин у харчуванні проявляється у людей так :
втомлюваність, сонливість, дратівливість, зниження концентрації уваги і пам'яті, зниження імунітету,
розшарування нігтів, випадіння волосся, лущення і сухість шкірних покривів і т.д. В даний час існує багато різних вітамінно-мінеральних комплексів зміцнювальних загальний імунітет. Варто пам'ятати, що значення мінеральних речовин у харчуванні, як і вітамінів дуже велике. Кожний атом мінеральних речовин впливає на організм по різному :
ЗАХВОРЮВАННЯ ПОВЯЗАНІ З НЕСТАЧЕЮ МІНЕРАЛЬНИХ РЕЧОВИН
Слайд 43К
Недолік калію проявляється у млявості м'язів і
зниження кров'яного тиску.
P
Нестача фосфору виникає
рідко, так як фосфором багаті багато продуктів харчування. Сполуки фосфору відіграють важливу роль у діяльності головного мозку, скелетних та серцевих м'язів, функціонуванні нервової системи.
Fe
Нестача заліза в харчуванні викликають залізодефіцитну анемію (недокрів'я).
I
Небезпеку проявляє як нестача йоду, так і надлишок. При недоліку цього елементу може виникнути базедова хвороба, відставання в розумовому розвитку, надлишок йоду викликає гіперфункцію щитовидної залози.
Na
Відповідає за регуляцію водного обміну в організмі. При фізичних навантаженнях і в умовах жаркого клімату, потреба в натрії виростає, тому що разом з потом втрачається велика концентрація натрію.
Слайд 44 Організм людини засвоює близько половини кальцію, що надходить з
їжею. Недолік кальцію (гіпокальціємія) може стати причиною низки болючих змін
в організмі, основним з яких є тетанія.
Тетанія - це підвищена нервово-м'язова збудливість, обумовлена зниженням концентрації в крові і в міжклітинному рідини іонізованого кальцію (Са + + ), яка проявляється нападами судом окремих м'язових груп.
Іншими причинами гіпокальціємії є: нестача вітаміну D (наприклад, при рахіті у дітей), захворювання органів травлення, що супроводжуються проносом (втрата кальцію і порушення його всмоктування), недостатнє поповнення кальцію у вагітних і годуючих грудьми жінок, порушення функції нирок, вроджені порушення фосфор-кальцієвого обміну.
Ca
Слайд 45 Тетанія пов'язана зі зміною кислотно-лужного обміну в лужну
сторону, що виникає при нестримної блювоті, при введенні хворим великої
кількості содового розчину, при отруєнні щавлевою кислотою (в цьому випадку утворюються нерозчинні солі кальцію) та інше . Розрізняють явну і приховану тетанії. Типовий напад тетанії починається з провісників у вигляді парестезій - порушень чутливості (наприклад, «мурашок» по тілу або оніміння), після чого починаються м'язові посмикування, а потім тонічні (тривалі) судоми окремих м'язових груп.
Характерний так званий карпопедальний спазм: судомні скорочення м'язів нижньої частини кінцівок і м'язів-згиначів.
Слайд 46 При судомах в області верхніх кінцівок руки приведені
до тулуба, зігнуті в ліктях, кисті опущені вниз, великий палець
приведений до зігнутим IV та V пальцях.
При судомах м'язів особи воно приймає характерний вираз: губи відкриті, повіки напівопущені, брови зведені, зведення жувальних м'язів викликає сардонічну посмішку. У важких випадках можливе поширення судом на м'язи тулуба і діафрагми, що викликає спазм бронхів і дихальну недостатність. У дітей такий спазм може викликати зупинку дихання і смерть.
Слайд 48Висновки
Отже, вода як універсальний розчинник відіграє
надзвичайно важливу роль у живих організмах, оскільки більшість біохімічних реакцій
відбувається у водних розчинах. Надходять речовини у клітини та виводяться з них продукти життєдіяльності також переважно в розчиненому вигляді. Крім води, в організмах є ще неорганічні сполуки - мінеральні солі. Вони знаходяться у дисоційованому (розчиненому) стані у вигляді катіонів (К+, №+, Са2+, М§2+ та ін.) та аніонів (СІ-, НСО3-, Н2РО 4 , БС^2- та ін.) або перебувають у вигляді твердих сполук (СаСО3, Са3(РО4)2).