Слайд 1Водород
Н – самый распространенный элемент Вселенной,
5 место на Земле.
Вода,
минералы, все живые существа.
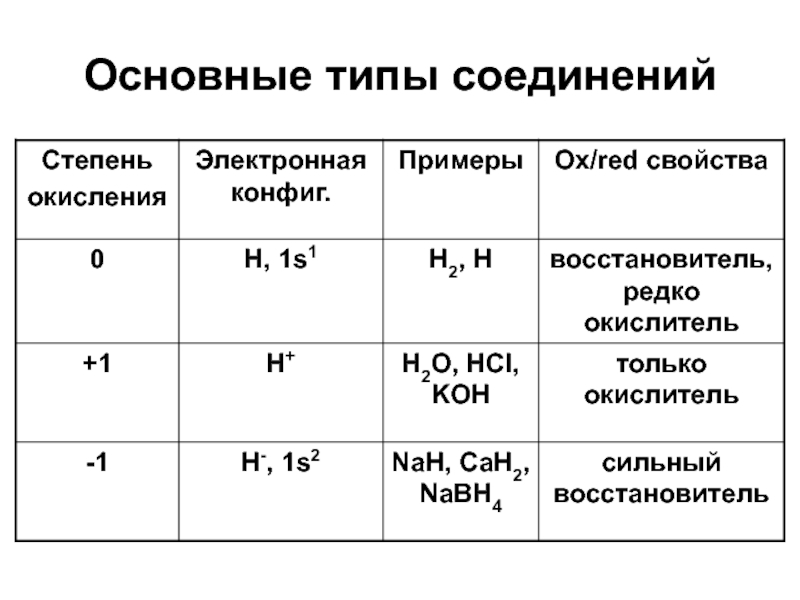
Положение в ПС:
Н: 1s1, 1 группа или
17 группа?
1 группа: один валентный электрон образует H+,
но неметалл.
17 группа: H- – гидрид ион (X-), H2 (Х2)
Слайд 2Изотопы водорода
1H – протий; 2H – дейтерий (D); 3H –
тритий (T)
T – радиоактивный изотоп, 1/2 = 12,4 года
производство
трития для термоядерного оружия.
Ткип для Н2 = -252,8 оС;
Ткип для D2 = -249,7 оС.
Ткип для Н2O = 100,00 оС;
Ткип для D2O = 101,42 оС
Слайд 3Изотопный эффект
Влияние на скорости реакций (образуются или разрываются связи с
участием водорода):
2H+ + 2e H2;
2D+ + 2e D2
идет медленнее c D, можно сконцентрировать D2O!
Колебательная спектроскопия:
частота колебаний связи Э–D всегда меньше,
чем для связи Э–Н:
Слайд 4Получение диводорода
Газификация угля («водяной газ», 1000 оС):
C +
H2O CO + H2
(соотношение 1:1);
для увеличения доли диводорода
(450ºС, Fe2O3 кат-р):
CO + H2O CO2 + H2;
(отмывка от СО2 водой или р-ром К2СО3)
Каталитическая конверсия метана водяным паром («синтез-газ», Ni кат-р, 1000 ºС):
CH4 + H2O CO + 3H2
(соотношение 1:3);
электролиз воды (электролит H2SO4, NaOH, Na2SO4):
H2O H2 + 1/2O2
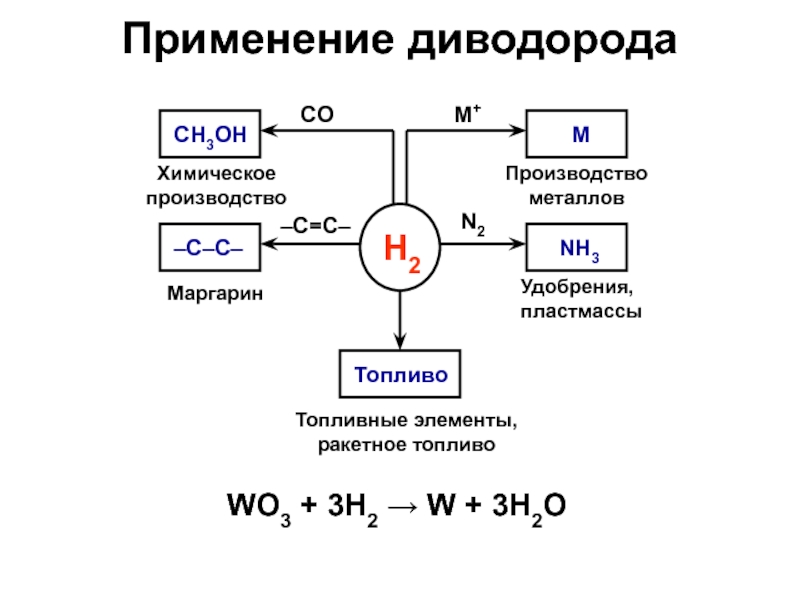
Слайд 5Применение диводорода
WO3 + 3H2 W + 3H2O
H2
–C–C–
–C=C–
CO
M+
N2
Химическое производство
Маргарин
Топливные элементы,
ракетное топливо
Удобрения, пластмассы
Производство металлов
Слайд 6Водородная энергетика
Основной вид топлива – диводород, получаемый
из воды (электролиз
воды или фотохимическое разложение воды в присутствии солнечного света
и
катализаторов типа TiO2).
2H2 + O2 2H2O
Проблема глобального потепления (?)
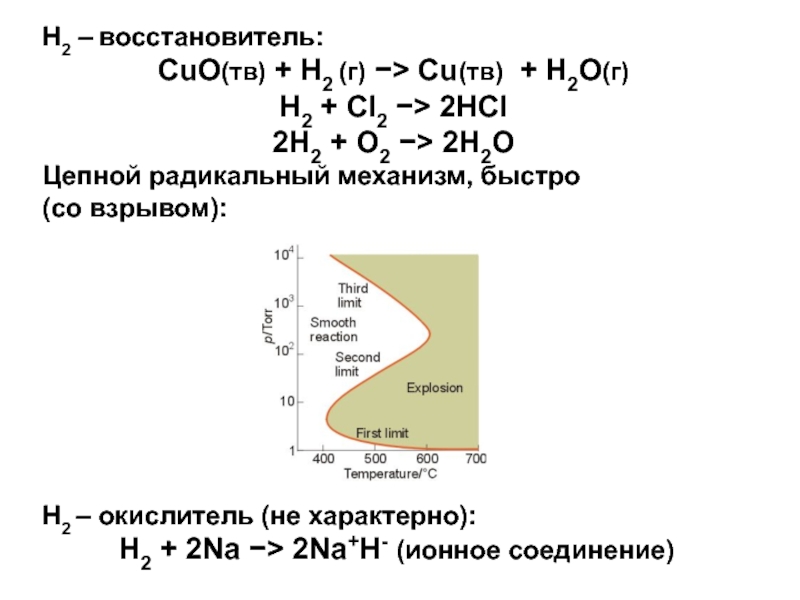
Слайд 8Н2 – восстановитель:
CuO(тв) + H2 (г) Cu(тв) + H2O(г)
H2
+ Cl2 2HCl
2H2 + O2 2H2O
Цепной радикальный
механизм, быстро
(со взрывом):
Н2 – окислитель (не характерно):
H2 + 2Na 2Na+H- (ионное соединение)
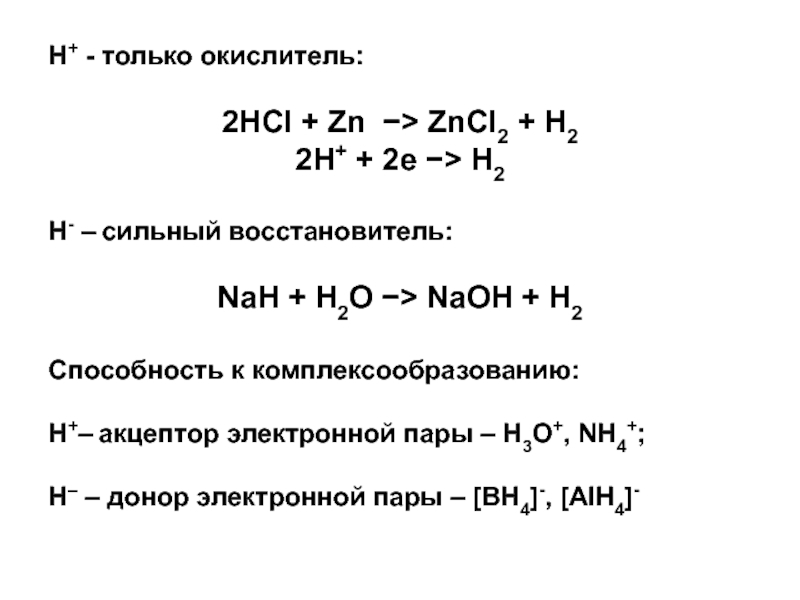
Слайд 9Н+ - только окислитель:
2HCl + Zn ZnCl2 + H2
2H+
+ 2e H2
Н- – сильный восстановитель:
NaH + H2O
NaOH + H2
Способность к комплексообразованию:
Н+– акцептор электронной пары – Н3О+, NH4+;
H– – донор электронной пары – [BH4]-, [AlH4]-
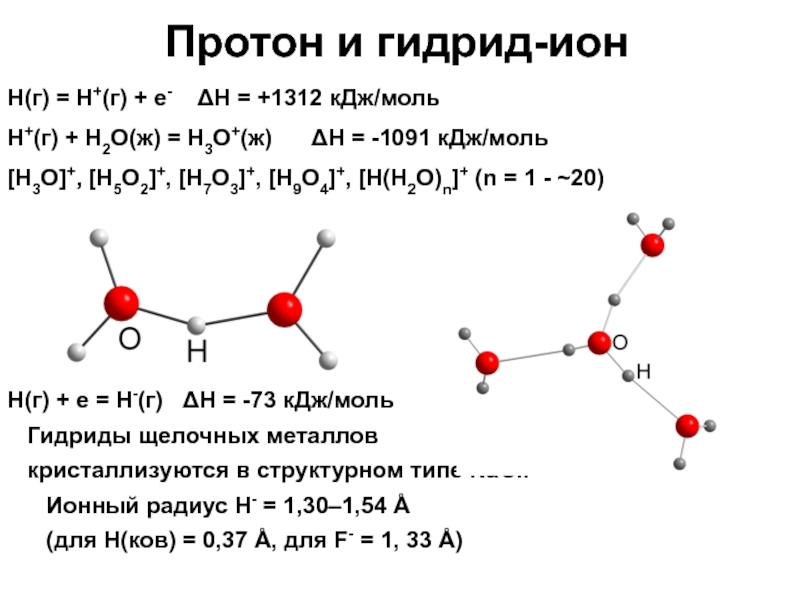
Слайд 10Протон и гидрид-ион
H(г) = Н+(г) + е- ΔН =
+1312 кДж/моль
H+(г) + H2O(ж) = H3O+(ж) ΔН =
-1091 кДж/моль
[H3O]+, [H5O2]+, [H7O3]+, [H9O4]+, [H(H2O)n]+ (n = 1 - ~20)
H(г) + е = Н-(г) ΔН = -73 кДж/моль
Гидриды щелочных металлов
кристаллизуются в структурном типе NaCl.
Ионный радиус Н- = 1,30–1,54 Å
(для Н(ков) = 0,37 Å, для F- = 1, 33 Å)
Слайд 11Реакции диводорода
Низкая реакционная способность H2.
Гомолитический разрыв связи Н–Н:
H–H H.
+ H. ΔHo = 434 кДж/моль
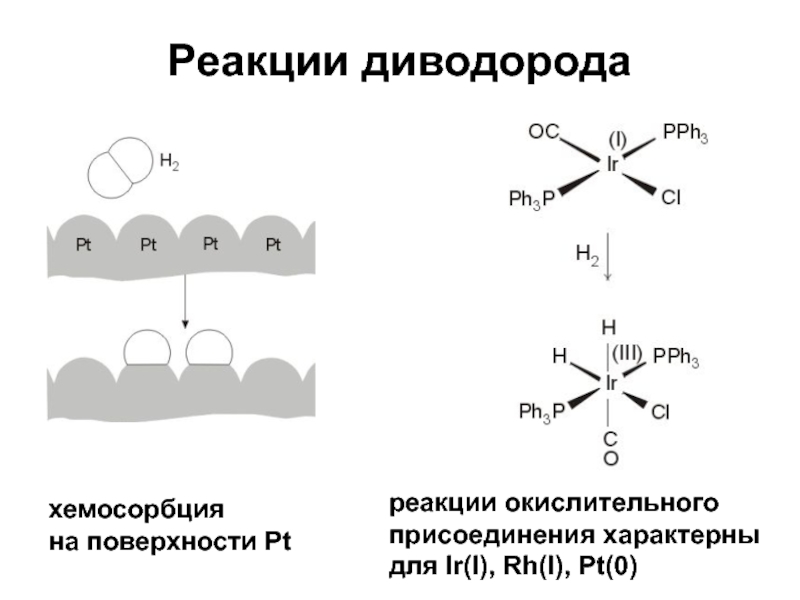
Слайд 12Реакции диводорода
хемосорбция
на поверхности Pt
реакции окислительного присоединения характерны для Ir(I), Rh(I),
Pt(0)
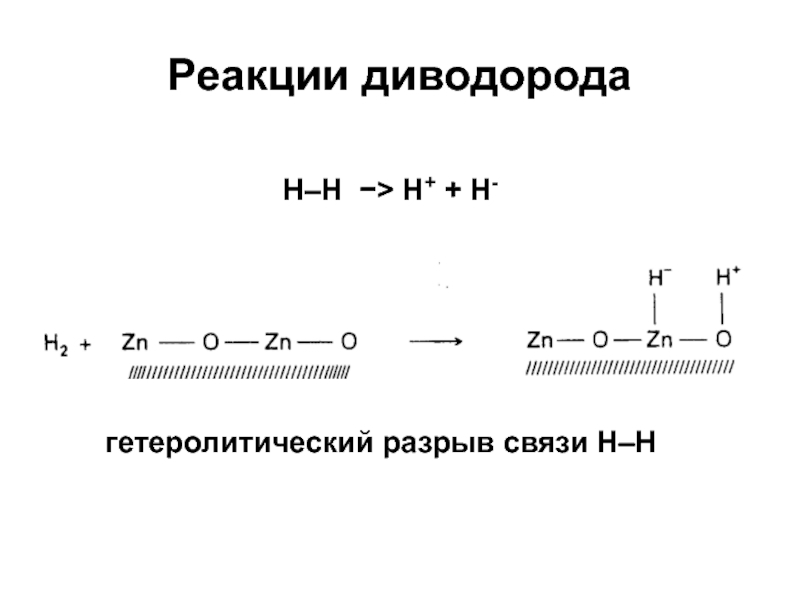
Слайд 13Реакции диводорода
гетеролитический разрыв связи Н–Н
H–H H+ + H-
Слайд 14Диводород как лиганд
[W(CO)3(H2)(i-Pr3P)2]
Слайд 15Бинарные соединения
с водородом
Молекулярные соединения;
Ионные гидриды;
Металлоподобные гидриды
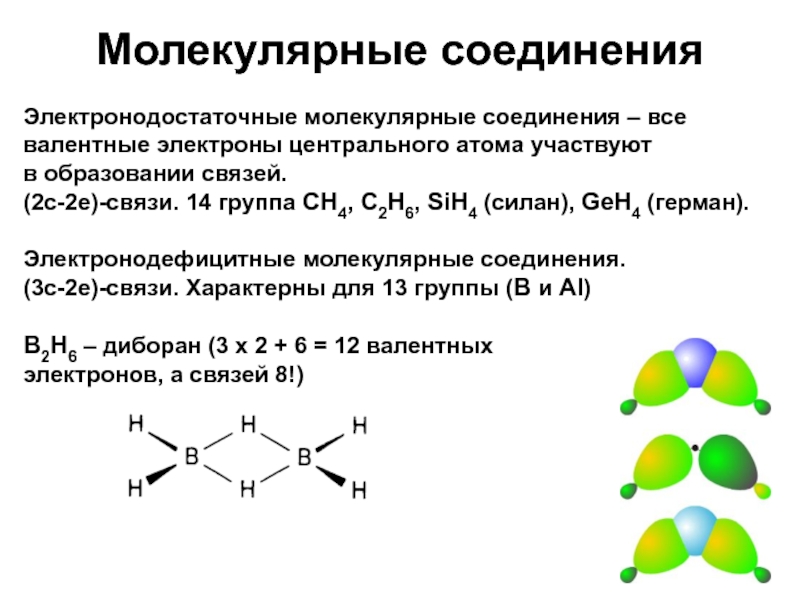
Слайд 16Молекулярные соединения
Электронодостаточные молекулярные соединения – все валентные электроны центрального атома
участвуют
в образовании связей.
(2с-2е)-связи. 14 группа CH4, C2H6, SiH4
(силан), GeH4 (герман).
Электронодефицитные молекулярные соединения.
(3с-2е)-связи. Характерны для 13 группы (B и Al)
B2H6 – диборан (3 х 2 + 6 = 12 валентных
электронов, а связей 8!)
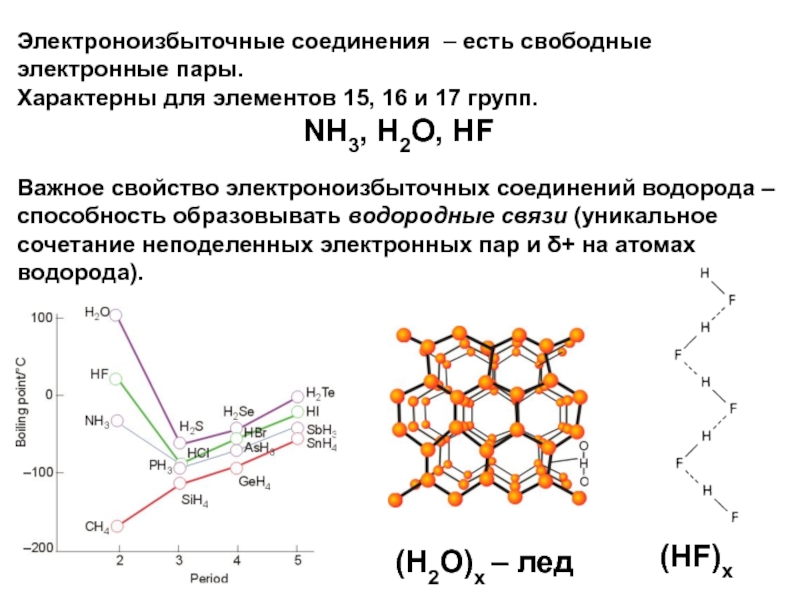
Слайд 17Электроноизбыточные соединения – есть свободные электронные пары.
Характерны для элементов
15, 16 и 17 групп.
NH3, H2O, HF
Важное свойство электроноизбыточных соединений
водорода – способность образовывать водородные связи (уникальное сочетание неподеленных электронных пар и + на атомах водорода).
(HF)x
(H2O)x – лед
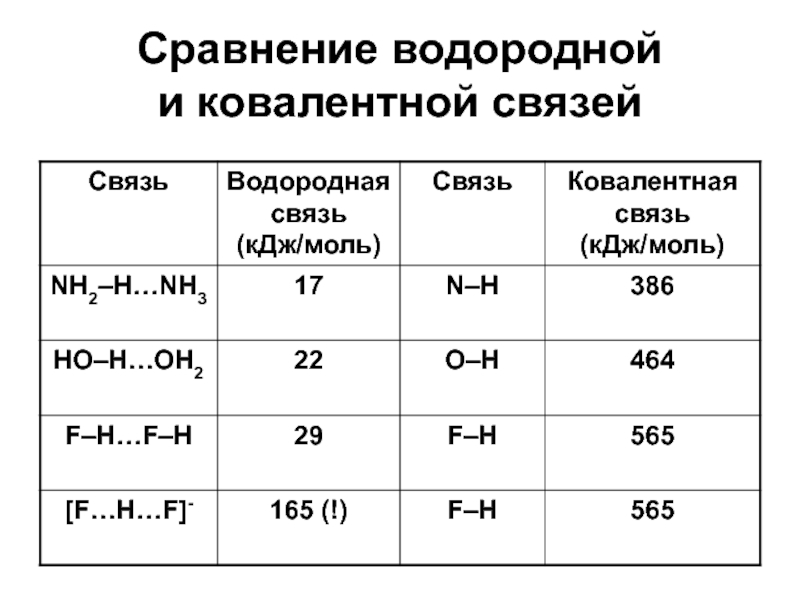
Слайд 18Сравнение водородной
и ковалентной связей
Слайд 19 [Cl–H….Cl]-
1,37 Å 1,85 Å
[F….H….F]-
1,13 Å
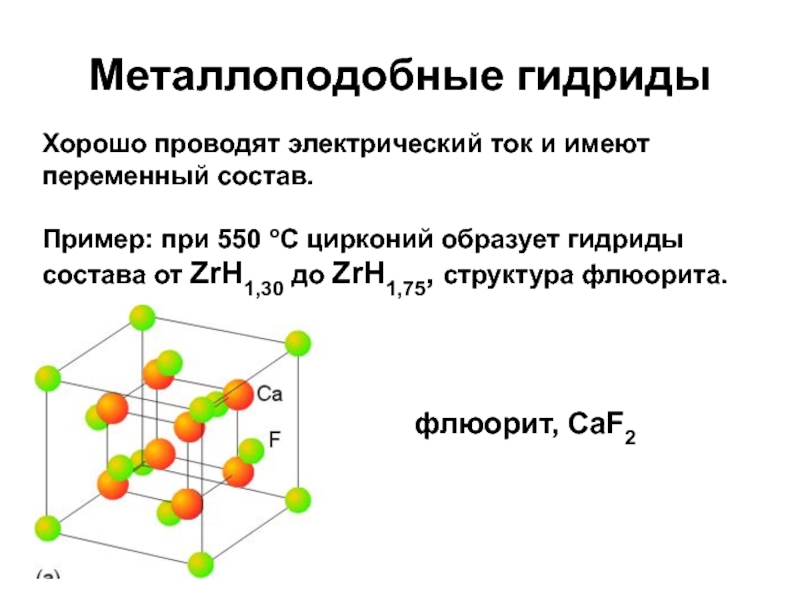
Слайд 20Металлоподобные гидриды
Хорошо проводят электрический ток и имеют переменный состав.
Пример: при
550 оС цирконий образует гидриды состава от ZrH1,30 до ZrH1,75,
структура флюорита.
флюорит, CaF2
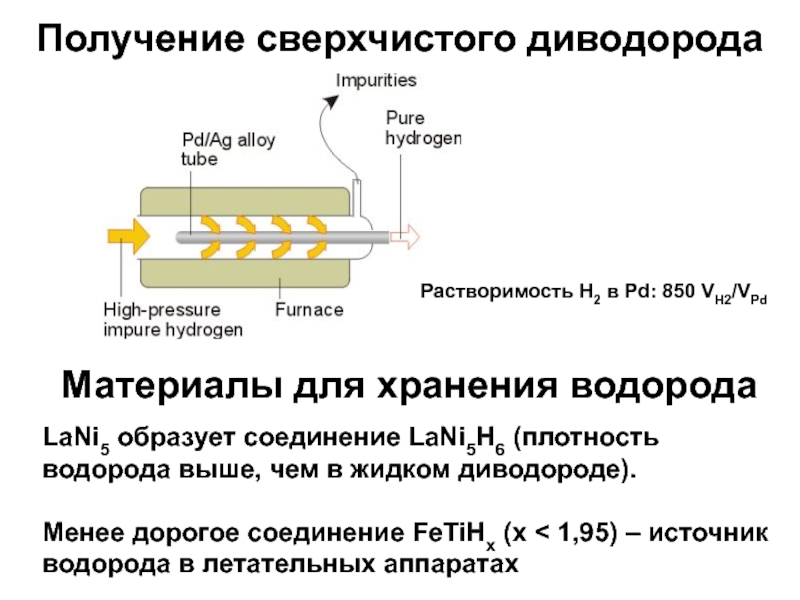
Слайд 21Получение сверхчистого диводорода
Материалы для хранения водорода
LaNi5 образует соединение LaNi5H6
(плотность водорода выше, чем в жидком диводороде).
Менее дорогое соединение FeTiHx
(x 1,95) – источник водорода в летательных аппаратах
Растворимость Н2 в Pd: 850 VH2/VPd
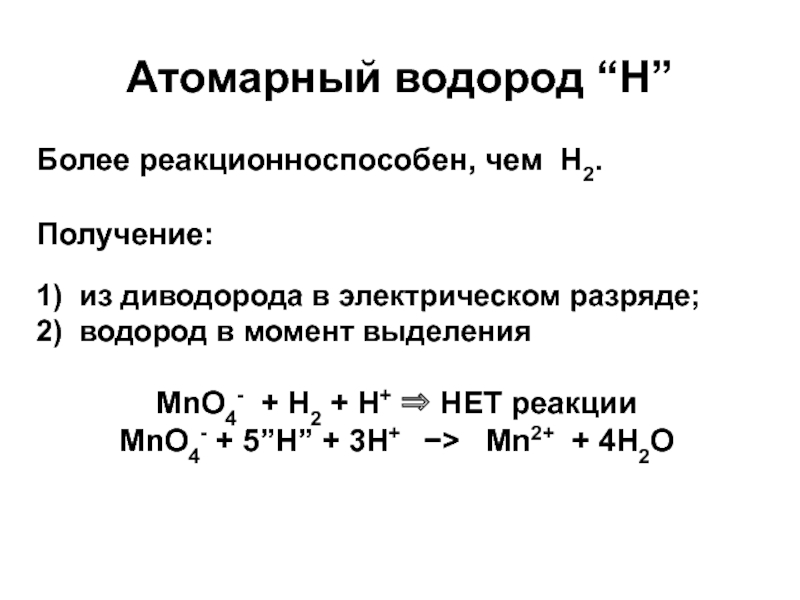
Слайд 22Атомарный водород “Н”
Более реакционноспособен, чем Н2.
Получение:
1) из диводорода
в электрическом разряде;
2) водород в момент выделения
MnO4- + H2 +
H+ НЕТ реакции
MnO4- + 5”H” + 3H+ Mn2+ + 4H2O
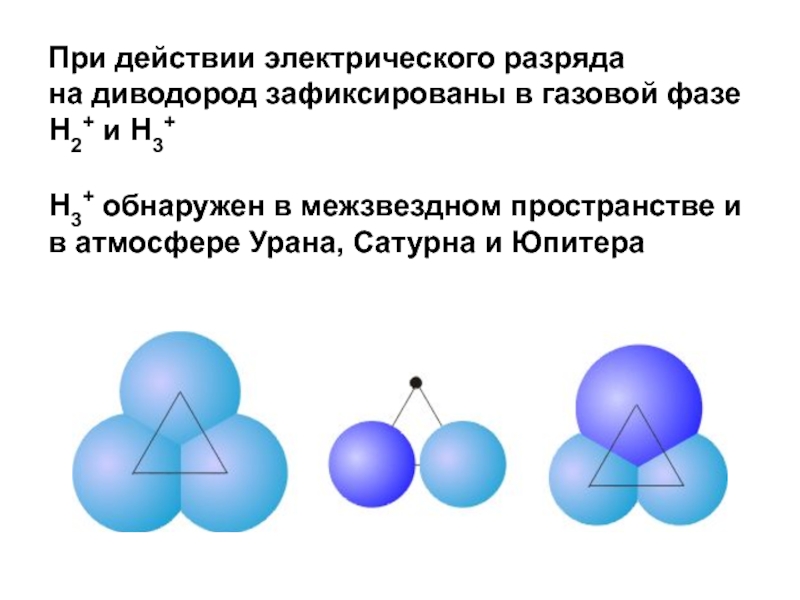
Слайд 23При действии электрического разряда
на диводород зафиксированы в газовой фазе
H2+ и H3+
H3+ обнаружен в межзвездном пространстве и в атмосфере
Урана, Сатурна и Юпитера
Слайд 24Орто- и параводород
T = 200 oC; 25 % пара-H2
T =
-253 oC; 99,8 % пара-H2
Катализатор активированный уголь.
Технология получения пара-H2
(чл.-корр.
РАН Р. А. Буянов)






![Водород Диводород как лиганд[W(CO)3(H2)(i-Pr3P)2] Диводород как лиганд[W(CO)3(H2)(i-Pr3P)2]](/img/tmb/4/310107/05f7b5bc4bd79d0608f339043dd855d4-800x.jpg)

![Водород [Cl–H….Cl]-1,37 Å 1,85 Å [F….H….F]- 1,13 Å [Cl–H….Cl]-1,37 Å 1,85 Å [F….H….F]- 1,13 Å](/img/tmb/4/310107/b0e1f97e47bed08de4f0aefaff1bbb2c-800x.jpg)