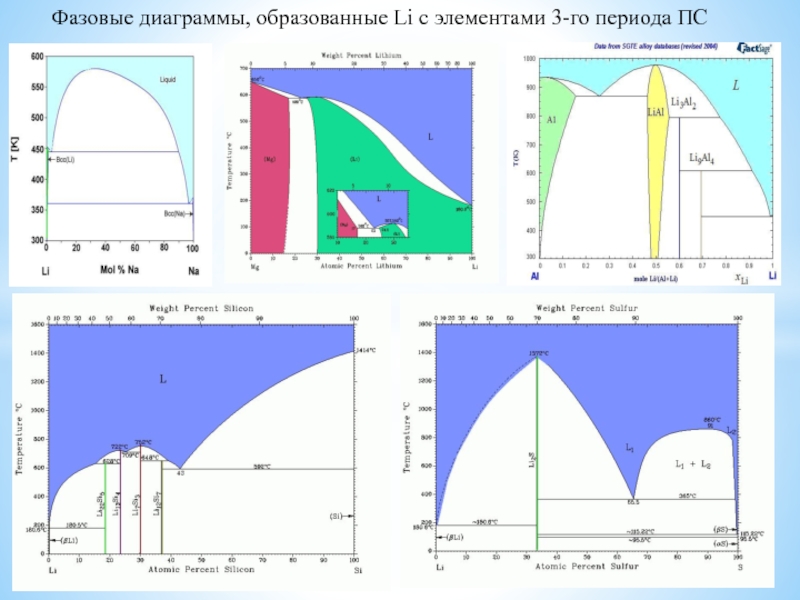
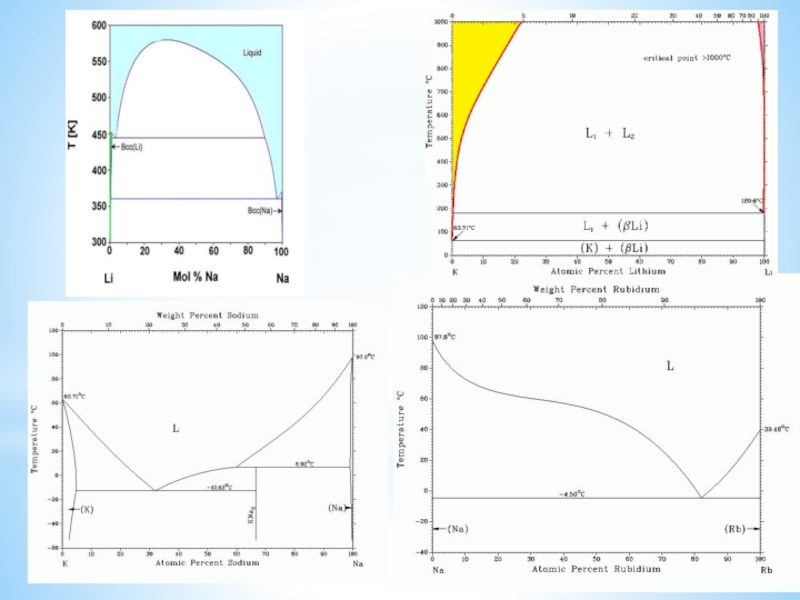
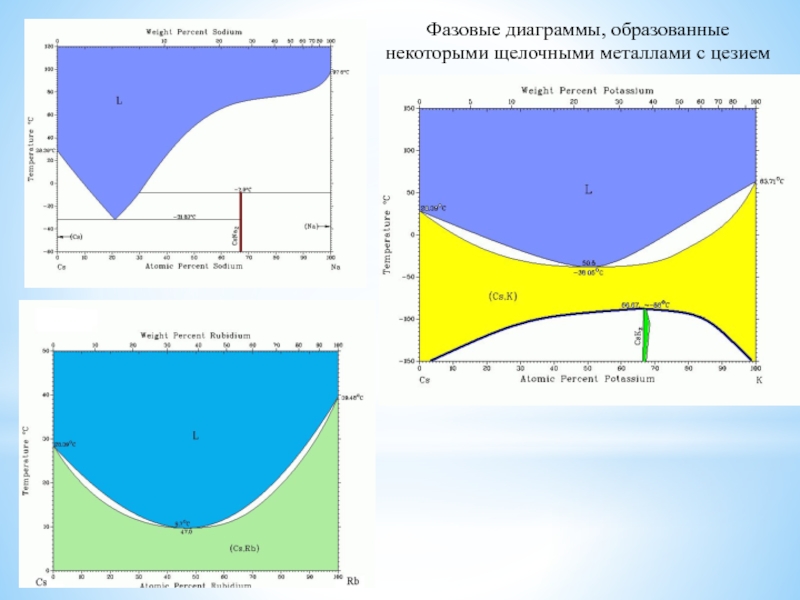
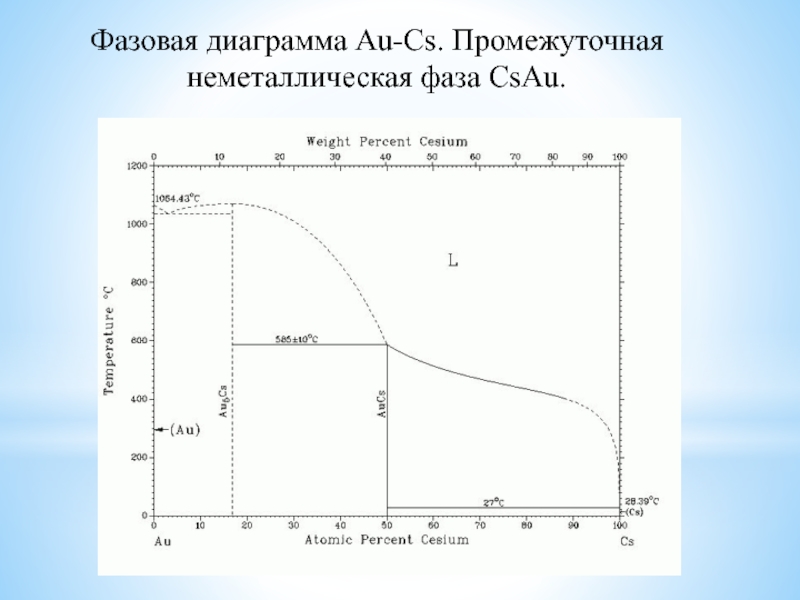
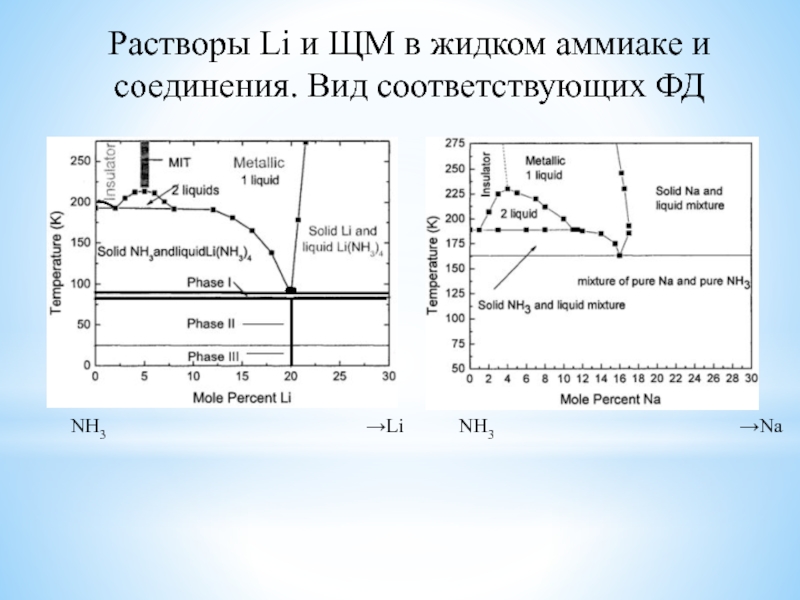
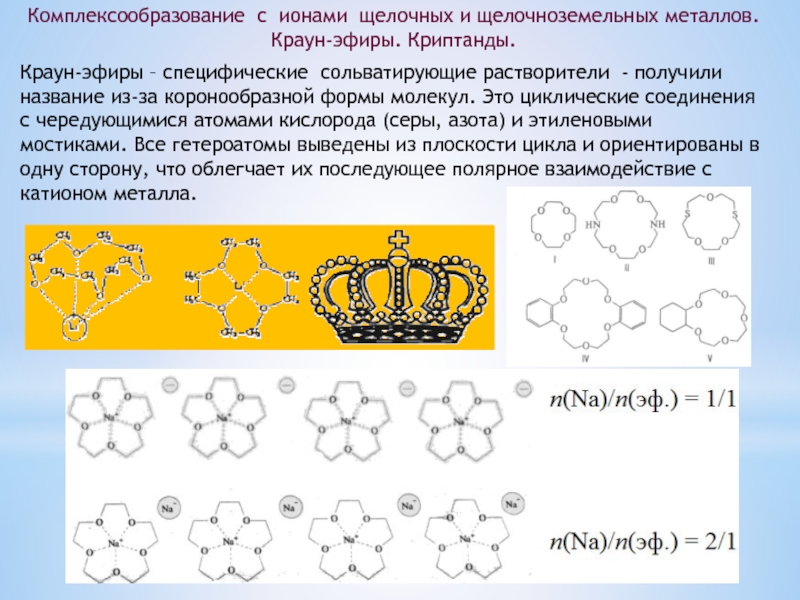
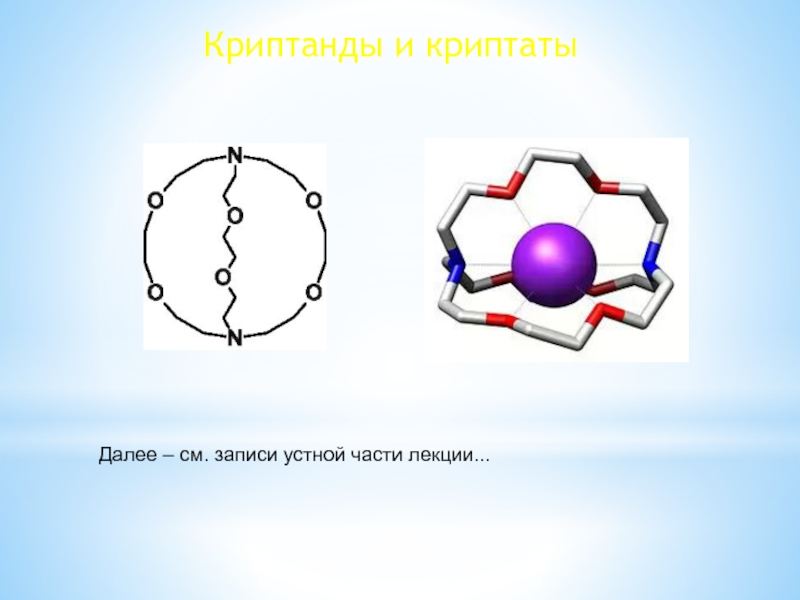
изотопов, очень малый размер атома, наличие единственного е в атоме,
наименьшая величина главного квантового числа для валентного электрона;следствия из этих особенностей: неметаллическая природа простого вещества (H2), прочность связи H-H, возможность существования водородной связи, двойственное положение водорода в ПС (с.о. -1 и +1), комплексные соединения с участием лиганда H;
получение и свойства молекулярного водорода и водорода “в момент выделения” (in statu nascendi).