Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Водород, нахождение в природе, применение и свойства. Начало расчётных задач в
Содержание
- 1. Водород, нахождение в природе, применение и свойства. Начало расчётных задач в
- 2. Слайд 2
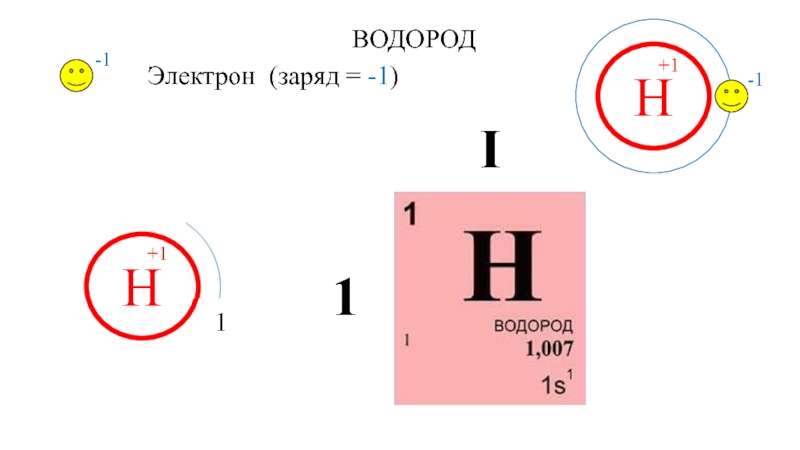
- 3. Н+1-1-1Электрон (заряд = -1)Н+1ВОДОРОДI1
- 4. Водород — самый распространённый элемент во Вселенной – 88,6 %
- 5. Слайд 5
- 6. Слайд 6
- 7. Слайд 7
- 8. Слайд 8
- 9. Слайд 9
- 10. Слайд 10
- 11. Слайд 11
- 12. Массовая доля водорода в земной коре составляет 1 %, но по числу атомов водород составляет 17 %
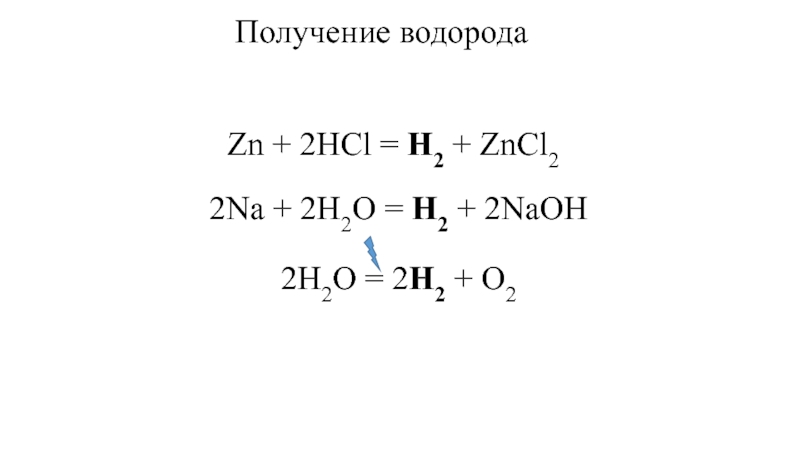
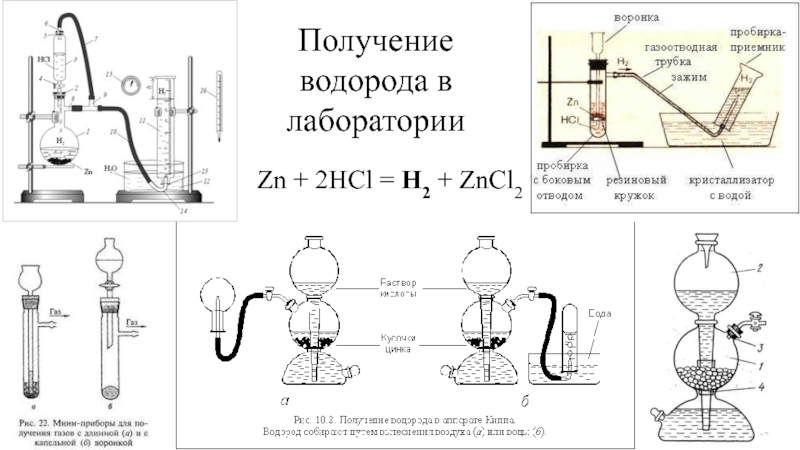
- 13. Получение водородаZn + 2HCl = H2 +
- 14. Соединения с водородомГидриды – NaH, H2O, HCl,
- 15. Получение водорода в лабораторииZn + 2HCl = H2 + ZnCl2
- 16. Химические свойства водорода и его соединенийВодород самый
- 17. Однако некоторые элементы водород может сам вытеснять
- 18. Водород реагирует со многими веществами с образованием
- 19. Начало расчётных задач в химииКак посчитать количество песчинок?Атомы можно считать также
- 20. Количество атомов обозначается буквой – N Количество
- 21. Основная формула:
- 22. Задача:Рассчитать количество вещества NaOH если его масса равна 200 г.Дано:mNaOH = 200 гnNaOH = ?Решение:
- 23. Задача:Рассчитать массу СaSO4 если его количество вещества равно 0,5 моль. mNaOH = ?Решение:
- 24. Слайд 24
- 25. Скачать презентанцию
Н+1-1-1Электрон (заряд = -1)Н+1ВОДОРОДI1
Слайды и текст этой презентации
Слайд 4Водород — самый распространённый элемент во Вселенной – 88,6 % всех атомов.
(11,3 %
– атомы He (гелий), а остальные менее 0,1% )
Водород –
топливо для звёзд.При сгорании водорода в ходе ядерных реакций выделяется гелий.
Слайд 12Массовая доля водорода в земной коре составляет 1 %, но по
числу атомов водород составляет 17 %
Слайд 14Соединения с водородом
Гидриды – NaH, H2O, HCl, HF, SiH4
Гидроксиды –
NaOH, Ca(OH)2, KOH
Кислоты – H2SO4, H3PO4, HNO3
Кислые соли – KHCO3,
Ca(HSO4)2Слайд 16Химические свойства водорода и его соединений
Водород самый маленький элемент, поэтому
его может заместить
практически любой другой элемент.
Zn + 2HCl =
H2 + ZnCl22Na + 2H2O = H2 + 2NaOH
Сa + H2S = H2 + СaS
Слайд 17Однако некоторые элементы водород может сам вытеснять из их соединений
СuO
+ H2 = Сu + H2O
Fe2O3 + 3H2 = 2Fe
+ 3H2OСлайд 18Водород реагирует со многими веществами с образованием гидридов
Сa + H2
= СaH2
2Na + H2 = 2NaH
2K + H2 = 2KH
F2
+ H2 = 2HFC + 2H2 = CH4
Слайд 20Количество атомов
обозначается буквой – N
Количество атомов в одной
порции обозначается – NA = 6,02∙1023 = 1 моль
Количество
порций атомов обозначается – n [моль]
Масса одной порции
атомов обозначается – M [г/моль]
Условные обозначения: