Слайд 1Водородный показатель
Выполнили: Александров Сергей,
Елиневский Владислав,
Жигун Борис (гр. 60-105Б)
Слайд 2Водородный показатель, pH (лат. pondus Hydrogenii — «вес водорода») — мера активности ионов водорода в растворе, количественно выражающая его кислотность.
Слайд 3Показатель pH ввел датский химик Сорен Петр Лауриц Соренсен в
лаборатории Карлсберг в 1909 году, но утверждения о некой силе
воды мы встречаем и у его предшественников. Соренсен обозначил ее как potentia hydrogeni (сила водорода, лат.), или pondus hydrogenii (вес водорода, лат.)
Слайд 4Водородный показатель равен по модулю отрицательному десятичному логарифму активности водородных ионов,
выраженной в молях на один литр:
Простым языком величина рН определяется количественным соотношением
в воде ионов Н+ и ОН-, образующихся при диссоциации воды. Если в воде пониженное содержание свободных ионов водорода (рН>7) по сравнению с ионами ОН-, то вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н+ (рН<7) - кислую. В идеально чистой дистиллированной воде эти ионы будут уравновешивать друг друга. В таких случаях вода нейтральна и рН=7. При растворении в воде различных химических веществ этот баланс может быть нарушен, что приводит к изменению уровня рН.
В водных растворах рН принимает значения от 1 до 14.
Так же применяется обратная рН величина pOH - показатель основности раствора, равная вычитанию из максимального значение рН – 14 данное рН раствора.
Слайд 5Не следует путать рН с такими параметрами, как кислотность и
щелочность воды. рН - это показатель интенсивности, но не количества,
т.е. отражает степень кислотности или щелочности среды, в то время как кислотность и щелочность характеризуют количественное содержание в воде веществ, способных нейтрализовывать соответственно щелочи и кислоты.
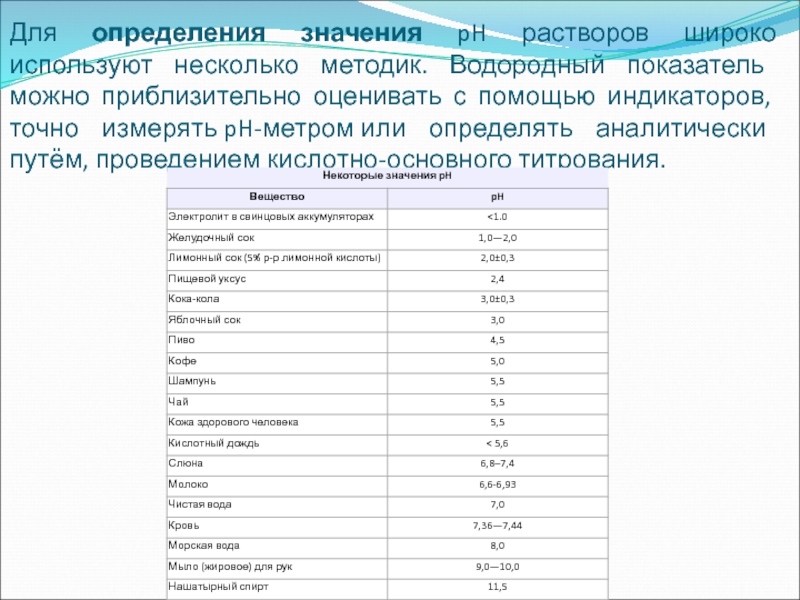
Слайд 6Для определения значения pH растворов широко используют несколько методик. Водородный
показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять
аналитически путём, проведением кислотно-основного титрования.
Слайд 7Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы — органические
вещества-красители, цвет которых зависит от pH среды. К наиболее известным
индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах — либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1–2 единицы.
Слайд 8Для расширения рабочего интервала измерения pH используют так называемый универсальный
индикатор, представляющий собой смесь из нескольких индикаторов. Универсальный индикатор последовательно
меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислой области в щелочную. Определения pH индикаторным методом затруднено для мутных или окрашенных растворов
Слайд 9Использование специального прибора — pH-метра — позволяет измерять pH в более широком диапазоне
и более точно (до 0,01 единицы pH), чем с помощью
индикаторов. Ионометрический метод определения pH основывается на измерении милливольтметром-ионометром ЭДС гальванической цепи, включающей специальный стеклянный электрод, потенциал которого зависит от концентрации ионов H+ в окружающем растворе. Способ отличается удобством и высокой точностью, особенно после калибровки индикаторного электрода в избранном диапазоне рН, позволяет измерять pH непрозрачных и цветных растворов и потому широко используется
Слайд 10Аналитический объёмный метод — кислотно-основное титрование — также даёт точные результаты определения кислотности
растворов. Раствор известной концентрации (титрант) по каплям добавляется к исследуемому
раствору. При их смешивании протекает химическая реакция. Точка эквивалентности — момент, когда титранта точно хватает, чтобы полностью завершить реакцию, — фиксируется с помощью индикатора. Далее, зная концентрацию и объём добавленного раствора титранта, вычисляется кислотность раствора
Слайд 11pH воды - один из важнейших рабочих показателей качества воды,
во многом определяющих характер химических и биологических процессов, происходящих в
воде. В зависимости от величины pH может изменяться скорость протекания химических реакций, степень коррозионной агрессивности воды, токсичность загрязняющих веществ и т.д.
Слайд 12Контроль за уровнем рН особенно важен на всех стадиях водоочистки,
так как его "уход" в ту или иную сторону может
не только существенно сказаться на запахе, привкусе и внешнем виде воды, но и повлиять на эффективность водоочистных мероприятий. Оптимальная требуемая величина рН варьируется для различных систем водоочистки в соответствии с составом воды, характером материалов, применяемых в системе распределения, а также в зависимости от применяемых методов водообработки.
Слайд 13Источники
https://ru.wikipedia.org/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4%D0%BD%D1%8B%D0%B9_%D0%BF%D0%BE%D0%BA%D0%B0%D0%B7%D0%B0%D1%82%D0%B5%D0%BB%D1%8C
http://www.water.ru/bz/param/h-index.shtml