Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Врожденный иммунитет
Содержание
- 1. Врожденный иммунитет
- 2. Защитные механизмы организма. Факторы естественной резистентности:химические, физические, биологическиемеханические барьеры,видовая невосприимчивость. Иммунитет. Воспаление.
- 3. Воспаление как защитный механизм. Единичная бактериальная
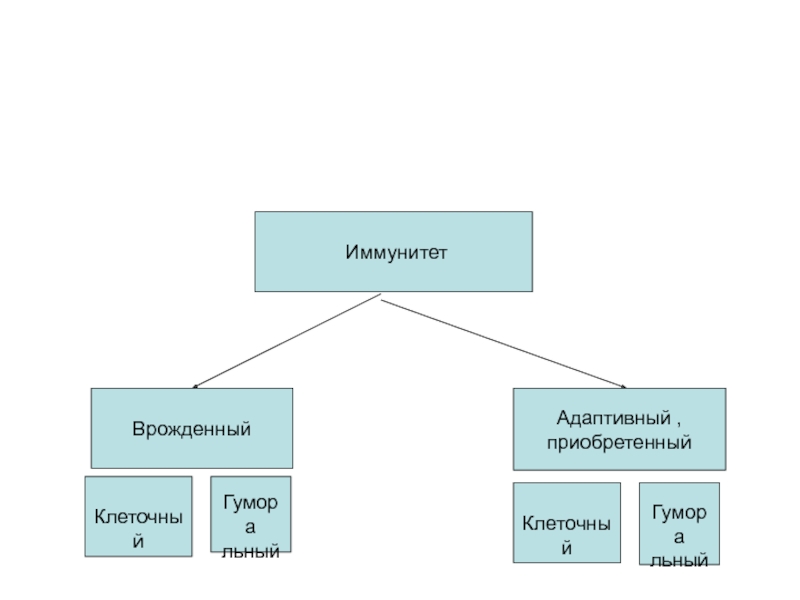
- 4. ИммунитетВрожденныйАдаптивный , приобретенный Клеточный Гуморальный Клеточный Гуморальный
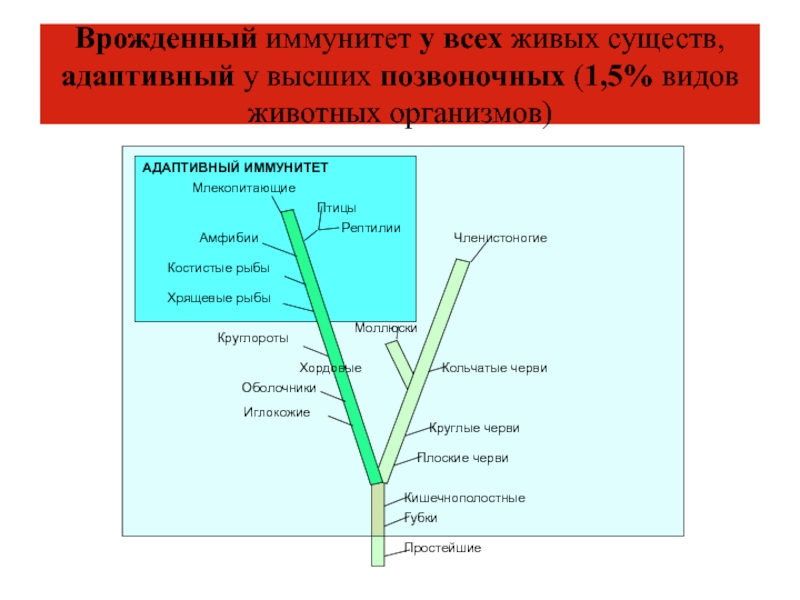
- 5. Врожденный иммунитет у всех живых существ, адаптивный у высших позвоночных (1,5% видов животных организмов)
- 6. Именно врожденный иммунитет является главной силой в
- 7. Врожденный иммунитетПервая линия защиты – быстрореагирующие (мин-часы),
- 8. Передаются от родителей потомкам по наследству, т.е. генетически детерминирован.
- 9. Неспецифические ?????
- 10. Клеточные факторы врожденного иммунитета. Иммунные клетки:МФ, нейтрофилы,эозинофилы,базофилы,
- 11. Воспаление развивается, когда организм получает сигнал об
- 12. РАМРы –Это – группы молекул, отсутствующие
- 13. Рецепторы, распознающие РАМРы. Патогенраспознающие рецепторы РRRимеются у
- 14. Сигнальные рецепторы.TLR, NLR, RIG-LR и др.
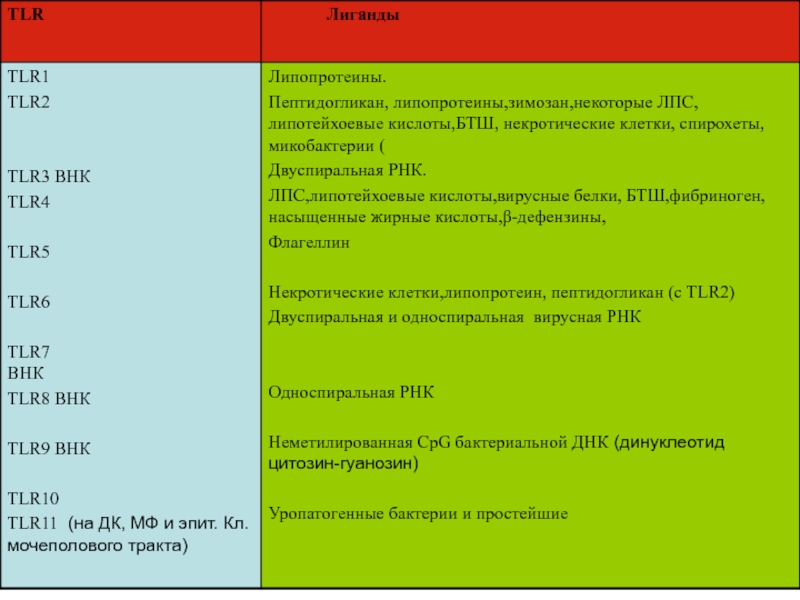
- 15. TLR1. ТLR (Toll like receptоr) – рецепторы
- 16. Чарльз Джэнуэй (1943—2003). .Джэнуэй предположил, что
- 17. Жюль Хоффманн
- 18. Дрозофилла, мутантная по гену Toll, заросла грибами
- 19. Руслан МеджитовРуслан Меджитов окончил Ташкентский университет, аспирантуру
- 20. За открытия, касающиеся «Активации врожденного иммунитета» и
- 21. Нобелевская премия 2011 года. Премию делят Брюс
- 22. Слайд 22
- 23. TLR могут кооперироваться для связывания с РАМР-амиTLR
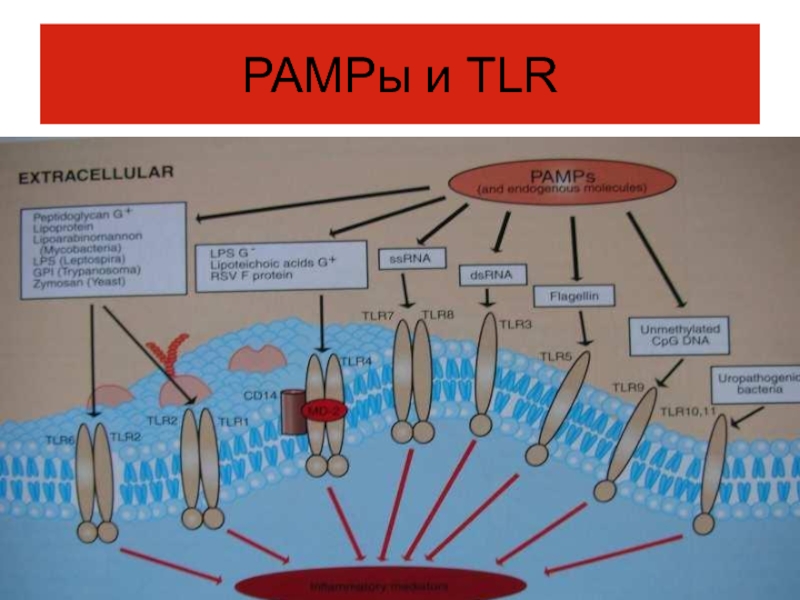
- 24. РАМРы и TLR
- 25. Слайд 25
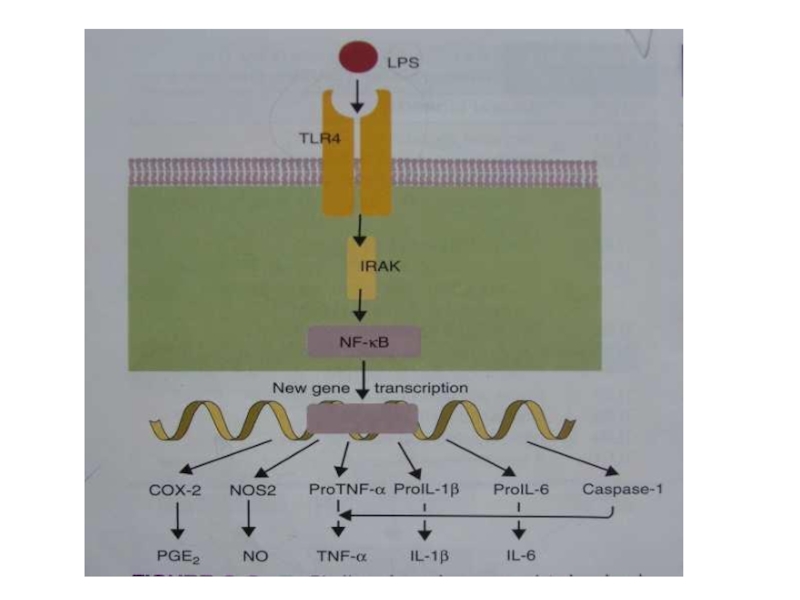
- 26. Сигнальные пути.Активирующий сигнал поступает в клетку.Это приводит
- 27. РАМРы +TLR запускают продукцию различных смесей цитокинов.TLR
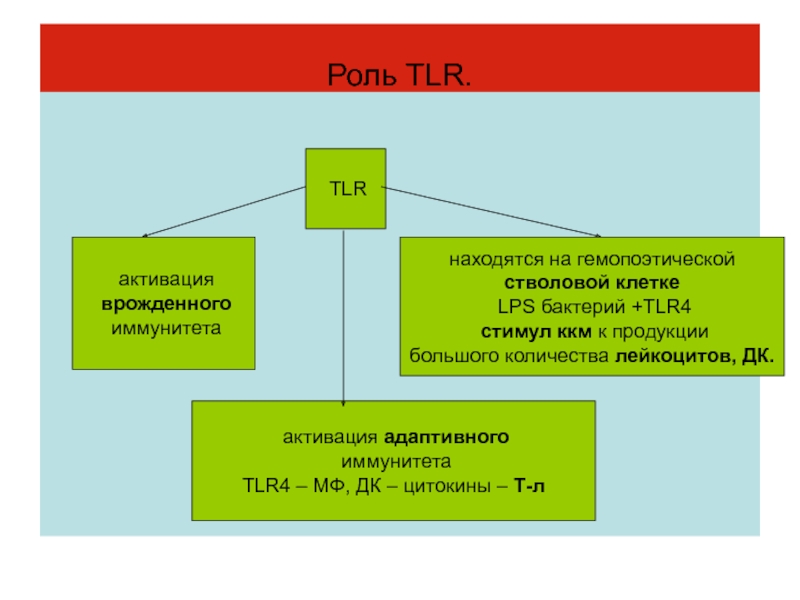
- 28. Роль TLR. TLR активация врожденного иммунитета активация
- 29. Другие РRR млекопитающих.NLR (NOD – like receptor)-
- 30. RIG - like receptor.Находится в цитоплазме клеток, связывает вирусную РНК.Инициируют продукцию антивирусных цитокинов – интерферонов ИФα,ИФβ
- 31. Другие РRR на поверхности клеток CD14 –бактериальные
- 32. Слайд 32
- 33. Эндоцитозные рецепторы1.Рецепторы для уборки мусора2. Маннозные рецепторы
- 34. Рецепторы для уборки мусора SR (Scavenger receptors).Лиганды:
- 35. Маннозный рецептор – MR.Распознает маннозу некоторых бактерий и вирусов.Подвергаются эндоцитозу, расщепляются внутриклеточными лизосомальными ферментами.
- 36. Секретируемые, растворимые PRR метят АГ для разрушения.Опсонины.
- 37. Опсонины – связываются с микробами и
- 38. PGRP –пептидогликан распознающий протеин.Обнаружен в гранулах нейтрофилов
- 39. DAMP (Damage associated molecular
- 40. Стресс - молекулы собственного организма.Продукты
- 41. Распознавание стресс-молекул собственного организма.Взаимодействуют с TLR
- 42. Врожденный иммунитет.Распознавание Разрушение
- 43. Слайд 43
- 44. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Защитные механизмы организма.
Факторы
естественной
резистентности:
химические,
физические,
биологические
механические барьеры,
видовая невосприимчивость.
Иммунитет.
Слайд 3Воспаление как защитный механизм.
Единичная бактериальная клетка – бинарное деление
пополам каждые 50 мин. – 500 млн. клеток за 24
часа.Живой организм должен защитить себя от микробной агрессии.
Время защиты играет ключевое значение.
Слайд 5Врожденный иммунитет у всех живых существ, адаптивный у высших позвоночных
(1,5% видов животных организмов)
Слайд 6Именно врожденный иммунитет является главной силой в борьбе с болезнями
у всех живых существ. Приобретенный (адаптивный) иммунитет есть лишь у
высших организмов, в том числе у человека, но его работа все же контролируется иммунитетом врожденным.Слайд 7Врожденный иммунитет
Первая линия защиты – быстрореагирующие (мин-часы), адаптивный 3-4 сут.
Предсуществующие
иммунные механизмы.
Это самые древние механизмы защиты (1,5 млрд. лет; адаптивный
500 млн. лет) Механизмы врожденного иммунитета, существуют у всех живых существ
Всю жизнь .
Слайд 10Клеточные факторы врожденного иммунитета.
Иммунные клетки:
МФ,
нейтрофилы,
эозинофилы,
базофилы,
ДК,
НК,
НКТ,
тучные клетки,
В1,
Т-γδ
Неиммунные клетки:
Эпителиальные, эндотелиальные, клетки эпидермиса.
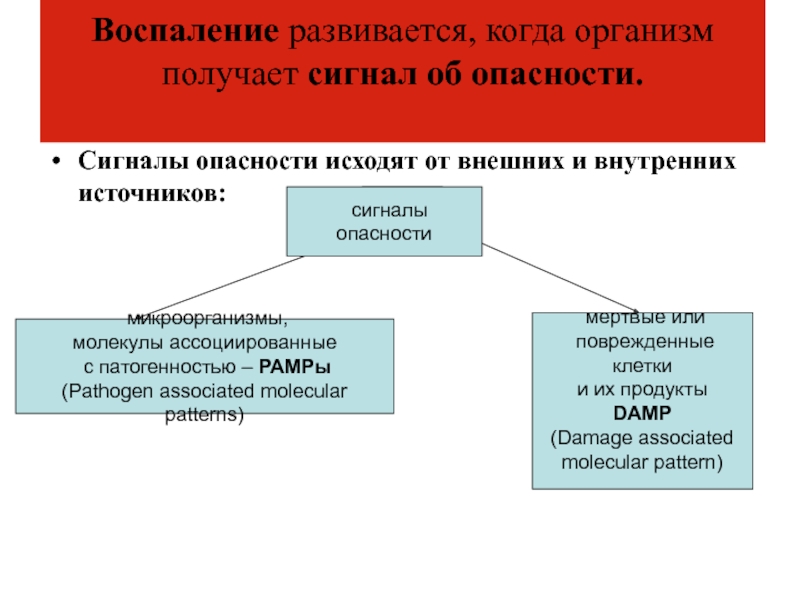
Слайд 11Воспаление развивается, когда организм получает сигнал об опасности.
Сигналы опасности исходят
от внешних и внутренних источников:
микроорганизмы,
молекулы ассоциированные
с
патогенностью – РАМРы (Pathogen associated molecular patterns)
мертвые или
поврежденные клетки
и их продукты
DAMP
(Damage associated
molecular pattern)
сигналы опасности
Слайд 12РАМРы –
Это – группы молекул, отсутствующие в организме -
хозяина, характерны для возбудителей, связаны с патогенностью, это сигнал
о проникновении в организмне просто чужеродного, а биологически агрессивного агента.
Слайд 13Рецепторы, распознающие РАМРы. Патогенраспознающие рецепторы РRR
имеются у всех многоклеточных, включая
животных и растения.
Узнавание образов патогенности в большей степени функция
врожденного иммунитета.Слайд 15TLR
1. ТLR (Toll like receptоr) – рецепторы для РАМР-ов преимущественно
на клетках или в клетках врожденного иммунитета.
Рецепторы на клетках распознают
внеклеточные патогены.Рецепторы в клетках на ЭР распознают внутриклеточные патогены (вирусы).
14 различных ТLR
Слайд 16Чарльз Джэнуэй (1943—2003).
.
Джэнуэй предположил, что рецепторы будут распознавать
какие-то химические структуры, характерные для целого класса патогенов.
Иначе
просто не хватит генов!Слайд 17Жюль Хоффманн
три важнейших вывода:
Во-первых, примитивная мушка-дрозофила наделена мощным и эффективным врождённым
иммунитетом. Во-вторых, её клетки обладают рецепторами, распознающими возбудителей инфекции.
В-третьих, рецептор специфичен к определённым структурам.
Слайд 18Дрозофилла, мутантная по гену Toll, заросла грибами и погибла, так
как у неё нет иммунных рецепторов, распознающих возбудителей микозов.
Слайд 19Руслан Меджитов
Руслан Меджитов окончил Ташкентский университет, аспирантуру в МГУ, стал
профессором Йельского университета (США) и восходящей звездой мировой иммунологии, первым
обнаружил эти рецепторы на клетках человека.Слайд 20За открытия, касающиеся «Активации врожденного иммунитета» и «За открытие дендритных
клеток и изучение их роли в адаптивном иммунитете»
Слайд 21Нобелевская премия 2011 года.
Премию делят Брюс Ботлер, профессор Университета
Техаса в Далласе, и Жюль Хоффман из Института молекулярной и
клеточной биологии в Страсбурге.Вторая половина присуждена Ральфу Штейнману, профессору Рокфеллеровского университета в Нью-Йорке.
Штейнман скончался за три дня до объявления его нобелевским лауреатом.
Жюль Хоффман проводил серию опытов с мухами-дрозофилами.
Несколькими годами позднее подобный эксперимент, только на мышах, провели в лаборатории Брюса Ботлера.
Слайд 23TLR могут кооперироваться для связывания с РАМР-ами
TLR 2 +TLR6
TLR1+ TLR2
Есть
основания предполагать, что TLR могут распознать все возможные инфекционные агенты.
Липопептиды
бактерийЛипопротеин микобактерий.
Слайд 26Сигнальные пути.
Активирующий сигнал поступает в клетку.
Это приводит к активации ядерного
фактора транскрипции каппа В – NF-ĸВ.
NF-ĸВ активирует гены, кодирующие провоспалительные
цитокины ФНОα, ИЛ1, ИЛ6, ферменты для синтеза NO и простогландина Е2Цитокины- это белки, регулирующие активность клеток иммунной системы.
Слайд 27РАМРы +TLR запускают продукцию различных смесей цитокинов.
TLR , распознающие молекулы
бактерий, сигнализируют о синтезе цитокинов, оптимальных для защиты против большинства
бактерийTLR, распознающие вирусные молекулы, продуцируют антивирусные цитокины.
Слайд 28Роль TLR.
TLR
активация
врожденного
иммунитета
активация адаптивного
иммунитета
TLR4 – МФ, ДК – цитокины – Т-л
находятся на гемопоэтической
стволовой клетке
LPS бактерий +TLR4
стимул ккм к продукции
большого количества лейкоцитов, ДК.
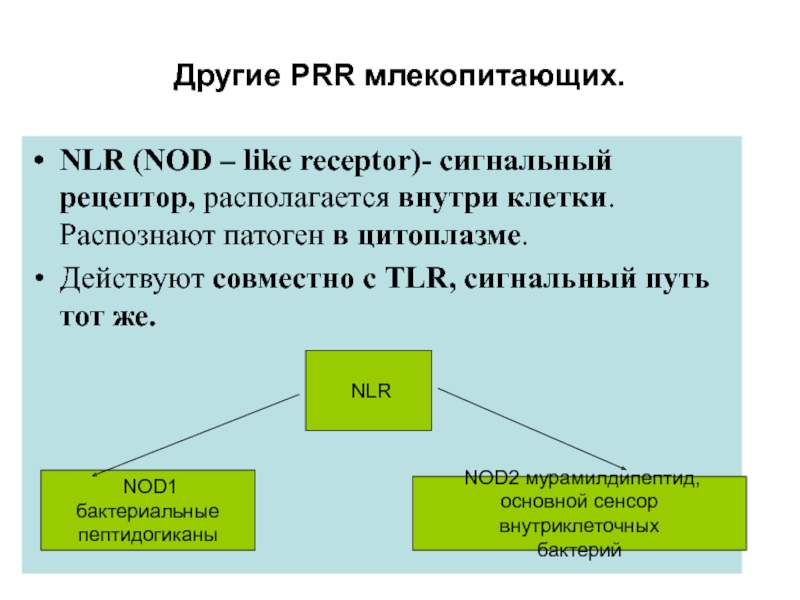
Слайд 29Другие РRR млекопитающих.
NLR (NOD – like receptor)- сигнальный рецептор, располагается
внутри клетки. Распознают патоген в цитоплазме.
Действуют совместно с TLR, сигнальный
путь тот же. NLR
NOD1 бактериальные
пептидогиканы
NOD2 мурамилдипептид,
основной сенсор внутриклеточных
бактерий
Слайд 30RIG - like receptor.
Находится в цитоплазме клеток, связывает вирусную РНК.
Инициируют
продукцию антивирусных цитокинов – интерферонов ИФα,ИФβ
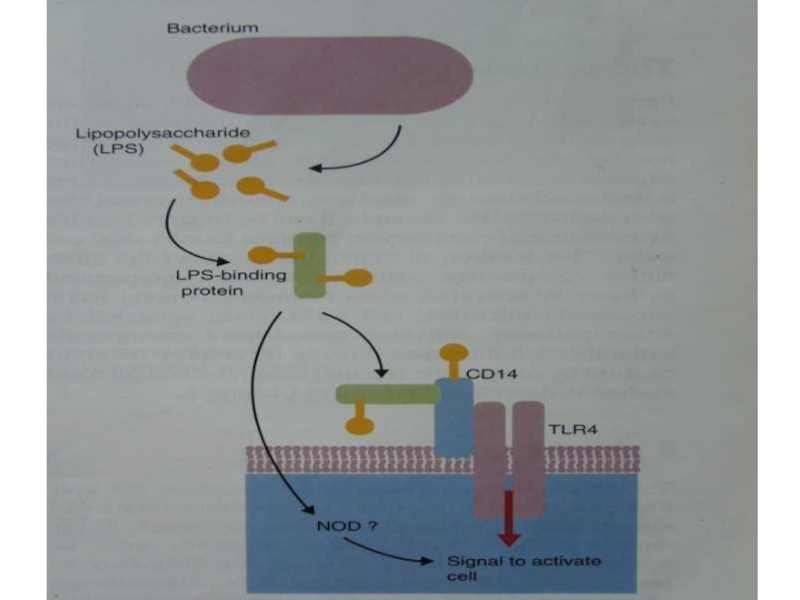
Слайд 31Другие РRR на поверхности клеток
CD14 –бактериальные ЛПС
CD1 – бактериальные
гликолипиды.
CD36 – бактериальные липопротеины, апоптотические клетки.
CD 48 – белок фимбрий.
Слайд 34Рецепторы для уборки мусора SR (Scavenger receptors).
Лиганды: липотейхоевые кислоты ГР+
бактерий, пептидогликан, ЛПС, частицы кремнезема, латекса, апоптотические клетки и др.
Слайд 35Маннозный рецептор – MR.
Распознает маннозу некоторых бактерий и вирусов.
Подвергаются эндоцитозу,
расщепляются внутриклеточными лизосомальными ферментами.
Слайд 37
Опсонины – связываются с микробами и усиливают эндоцитоз (фагоцитоз):
Комплемент
С
- реактивный белок (сем. пентраксинов)
МСЛ – маннозосвязывающий лектин (сем. коллектинов)
связывается с углеводами, белками и липидами патогенов.ЛПС - связывающий белок.
Слайд 38PGRP –пептидогликан распознающий протеин.
Обнаружен в гранулах нейтрофилов у человека, мышей,
жвачных и свиней.
Выходит из них при фагоцитозе.
Связывает пептидогликаны
бактерий и индуцирует продукцию антимикробных веществ – дефензинов.У жвачных связывает пептидогликан, липотейхоевые кислоты и ЛПС.
Слайд 39
DAMP (Damage associated molecular pattern)
Гипотеза опасности – ответ клетки
на какое-либо воздействие стресс-продуктами.
Слайд 40 Стресс - молекулы собственного организма.
Продукты стрессированных клеток в
норме отсутствуют
Остатки клеток при повреждении и гибели, стресс-молекулы: БТШ, мембранные
фосфолипиды, молекулы, подобные МНС 1, пуриновые метаболиты, кальций связывающее семейство S100 – эндогенные эквиваленты РАМР.Продукты синтеза клеток врожденного иммунитета при активации – антимикробные белки (кателицидины, дефензины, нейротоксин эозинофилов, ИЛ-1, БТШ, гистон HMGB1 и др.)
Слайд 41Распознавание стресс-молекул собственного организма.
Взаимодействуют с TLR 2,4, синтез провоспалительных
цитокинов, активация клеток врожденного иммунитета, развитие воспаления.
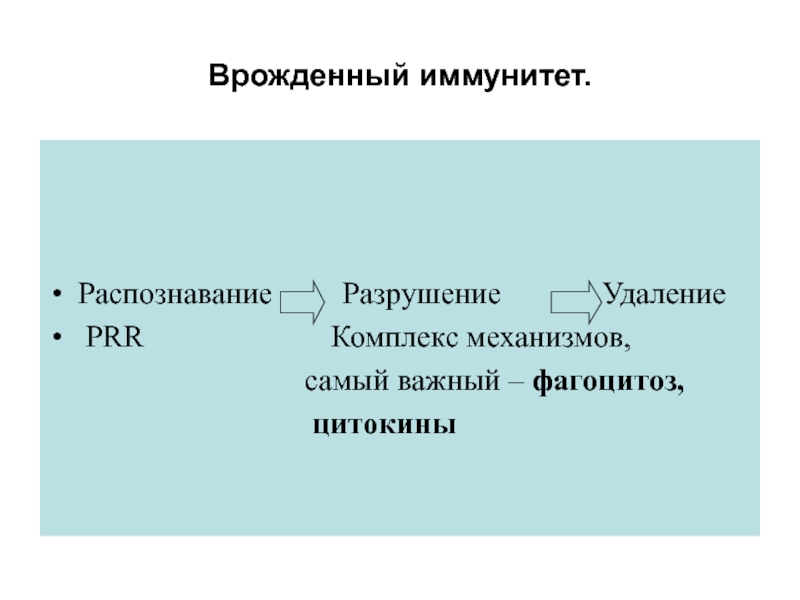
Слайд 42Врожденный иммунитет.
Распознавание Разрушение
Удаление
PRR
Комплекс механизмов,самый важный – фагоцитоз,
цитокины