Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Второе начала термодинамики и его применимость к биосистемам
Содержание
- 1. Второе начала термодинамики и его применимость к биосистемам
- 2. Второе начала термодинамики и его применимость к
- 3. I закон термодинамики позволяет определить ΔΗреакции, но
- 4. Второе начало термодинамики Энтропия (S) − мера рассеянной
- 5. Второе начало термодинамики В самопроизвольном процессе В равновесном
- 6. Статистическая природа S W – число различных состояний
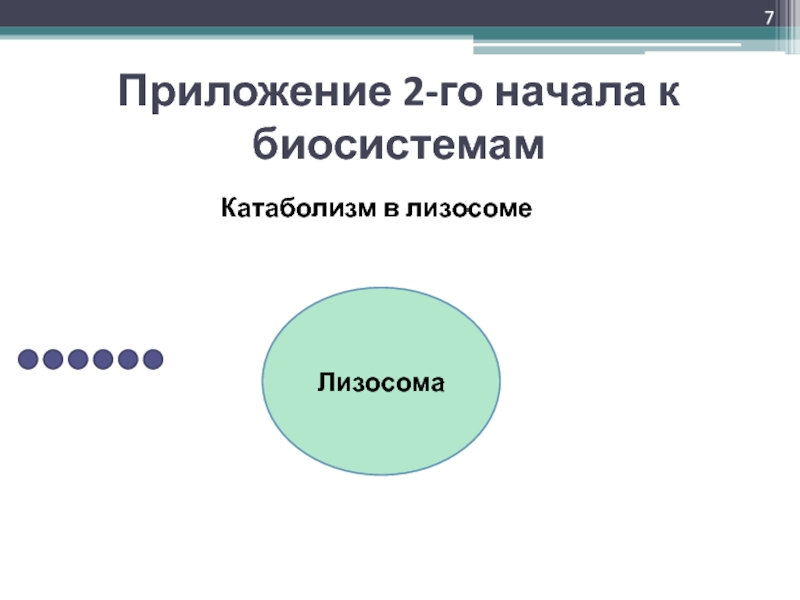
- 7. ЛизосомаПриложение 2-го начала к биосистемамКатаболизм в лизосоме
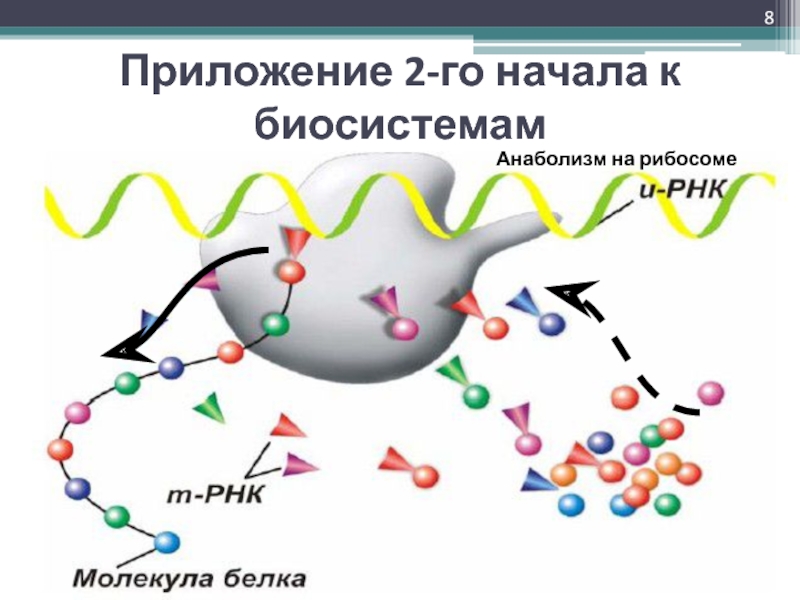
- 8. Приложение 2-го начала к биосистемамАнаболизм на рибосоме
- 9. Уравнение Гиббса… … является объединённым выражением I и
- 10. Соотношение энтальпийного и энтропийного факторов
- 11. Реакции обменаЭкзэргонические − реакции обмена, идущие с
- 12. Макроэрги
- 13. Критерии равновесияДля обратимой реакции: aA + bB
- 14. Уравнение изотермы химической реакцииДля процесса в общем
- 15. Соотношение Пс и Кр
- 16. Уравнение изобары химической реакцииОграничение: ΔТ − должна быть небольшой.
- 17. Влияние давления на смещение равновесияΔn = (x
- 18. Принцип подвижного равновесияПри изменении одного из условий
- 19. Спасибо за внимание!
- 20. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3 I закон термодинамики позволяет определить ΔΗреакции, но не даёт ответа
на вопрос о её направлении. Ответ на этот вопрос даёт
II закон термодинамики, который выделяет теплоту в особый вид энергии и вводит понятие энтропии.Слайд 4Второе начало термодинамики
Энтропия (S) − мера рассеянной или обесцененной энергии.
“Теплота
сама по себе не может перейти от более холодного тела
к более теплому” [Р.Клаузиус (1850)]“В природе невозможен процесс, единственным результатом которого была бы механическая работа, совершенная за счет охлаждения теплового резервуара” [У.Томсон (1851)]
Рудольф Юлиус Эмануэль Клаузиус (1822-1888)
Слайд 5
Второе начало термодинамики
В самопроизвольном процессе
В равновесном процессе
Для изолированной системы,
где Q = 0:
В самопроизвольном процессе ΔS > 0
В
равновесном процессе ΔS = 0В общем случае в изолированной системе
ΔS ≥ 0
Слайд 6Статистическая природа S
W – число различных состояний системы, доступное ей
при данных условиях, или термодинамическая вероятность макросостояния системы.
kБ =
R/NА = 1,38⋅10-16 [эрг/град] – постоянная БольцманаВ 1872 г. Л.Больцман предложил статистическую формулировку второго закона термодинамики:
«Изолированная система эволюционирует преимущественно в направлении большей термодинамическоой вероятности»
S = kБ lnW
Слайд 9
Уравнение Гиббса…
… является объединённым выражением I и II начал термодинамики.
Для
данной температуры
ΔG = ΔH − TΔS
При Δ G < 0
реакция возможна;При Δ G > 0 реакция невозможна;
При Δ G = 0 система находится в равновесии
Джозайя Уиллард Гиббс
(1839-1903)
Слайд 11Реакции обмена
Экзэргонические − реакции обмена, идущие с выделением энергии (ΔG
− реакции обмена, идущие с потреблением энергии (ΔG>0).
Сопряжение – процесс
передачи энергии от экзэргонических к эндэргоническим реакциям, а две реакции, одна из которых без другой идти не может, называются сопряжёнными.Слайд 13Критерии равновесия
Для обратимой реакции:
aA + bB ↔ xX +
yY
при постоянном давлении и температуре:
ΔH = TΔS, тогда Δ
G = 0.С точки зрения кинетики состояние равновесия характеризуется величиной константы равновесия:
(при Т=const)
Слайд 14Уравнение изотермы химической реакции
Для процесса в общем виде:
В положении равновесия:
Якоб
Хендрик Вант-Гофф
(1852-1911)
ΔG = 0
Δ G° = −RTlnKр
Слайд 17Влияние давления на смещение равновесия
Δn = (x + y) −
(a + b)
Δn − изменение числа моль газов в реакции.
Слайд 18Принцип подвижного равновесия
При изменении одного из условий химического равновесия оно
смещается в сторону той реакции, которая уменьшает произведённое изменение.
Принцип адаптивных
перестроекЛюбая живая система при воздействии на неё перестраивается так, чтобы уменьшить это воздействие.
Анри-Луи Ле Шателье
(1850-1936)