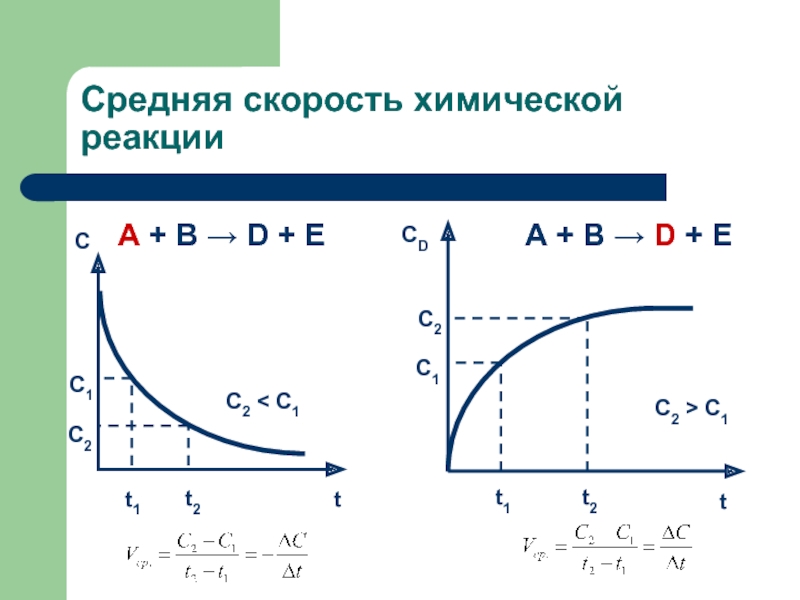
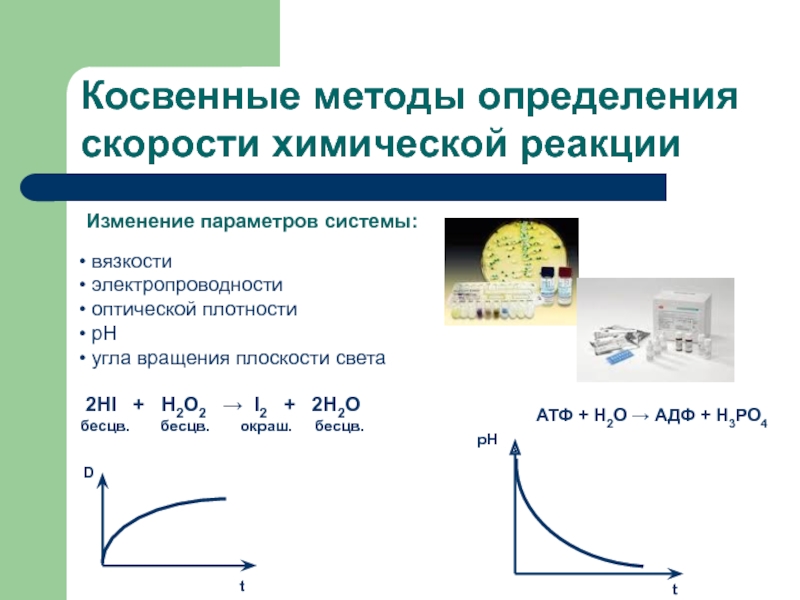
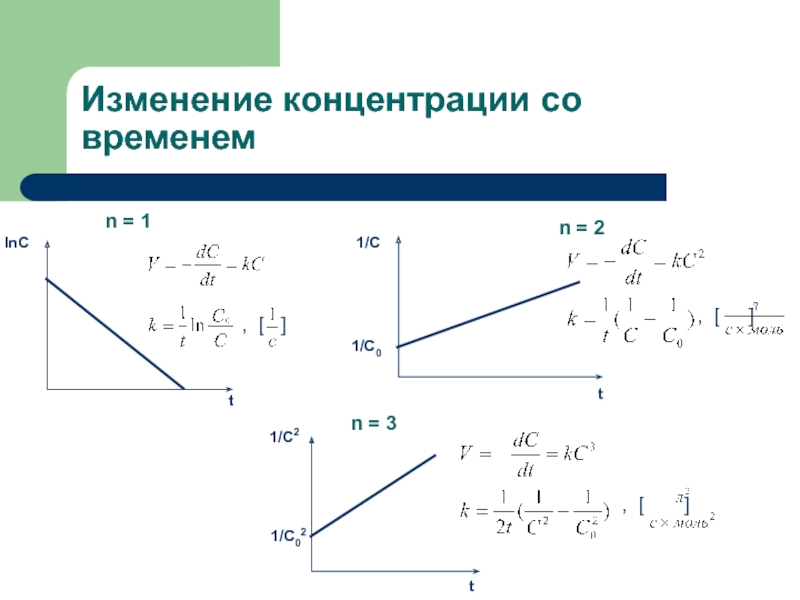
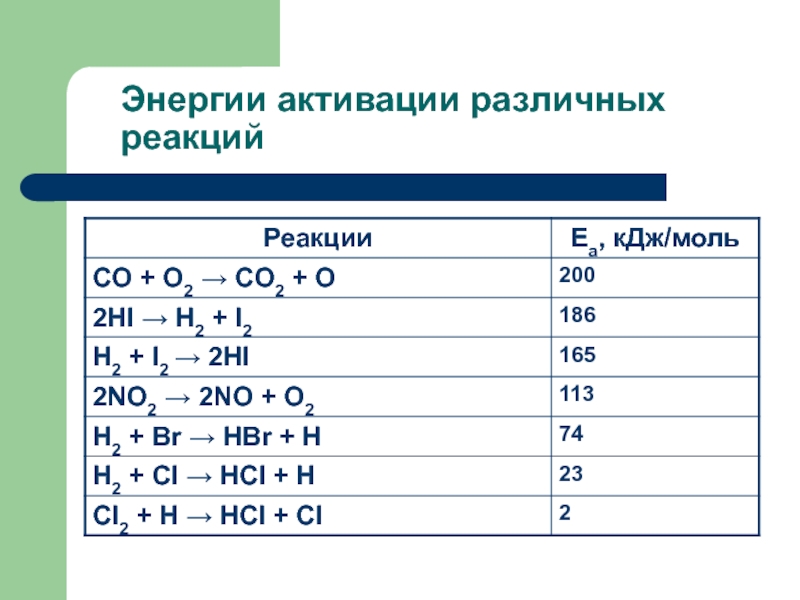
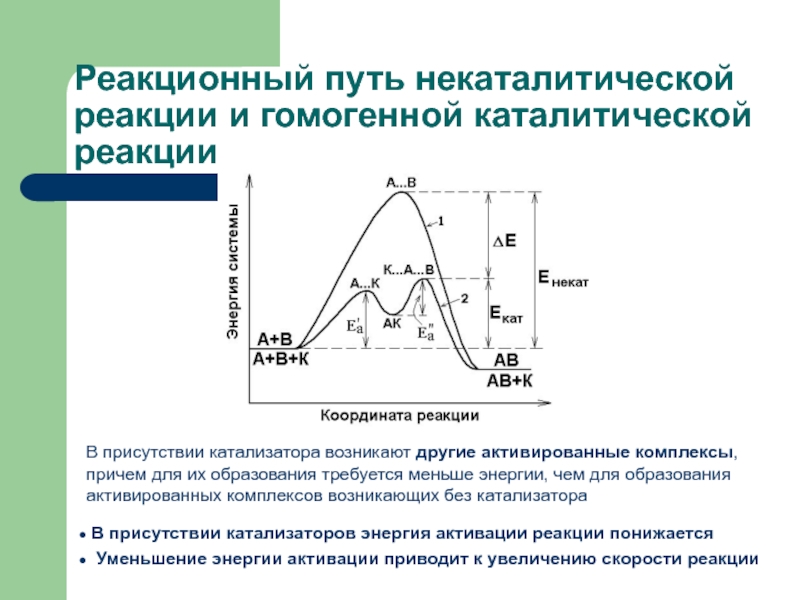
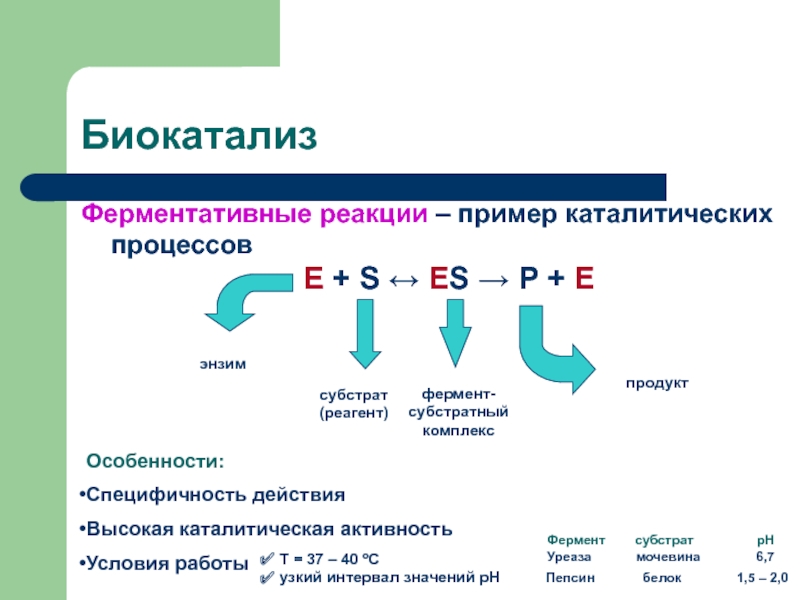
секунды, с взрывом, т.е. мгновенно, другие – медленно (десятилетия, столетия,
например, образование пород, минералов).Знание скорости и механизма протекания реакций очень важно в науке и производстве. Скорость и механизм химических превращений изучает особый раздел химии – химическая кинетика (наука о скорости химических реакций).
Выяснение кинетики реакции позволяет осуществить математическое моделирование реакций, происходящих в химических аппаратах, и с помощью ЭВМ решать задачи оптимизации и автоматизации химико-технологических процессов.