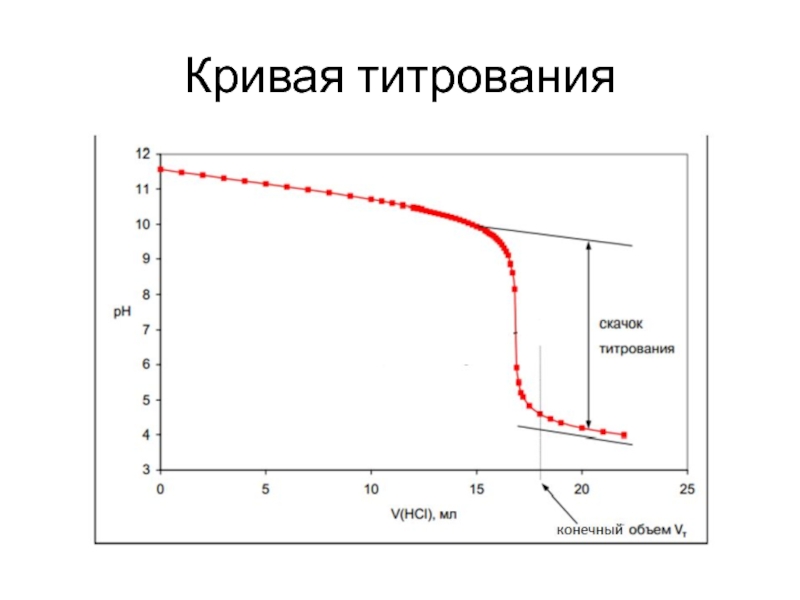
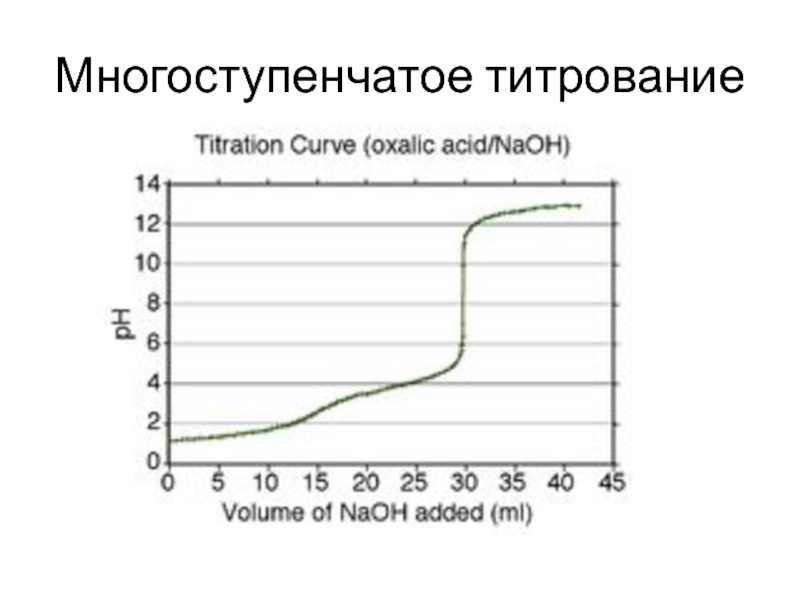
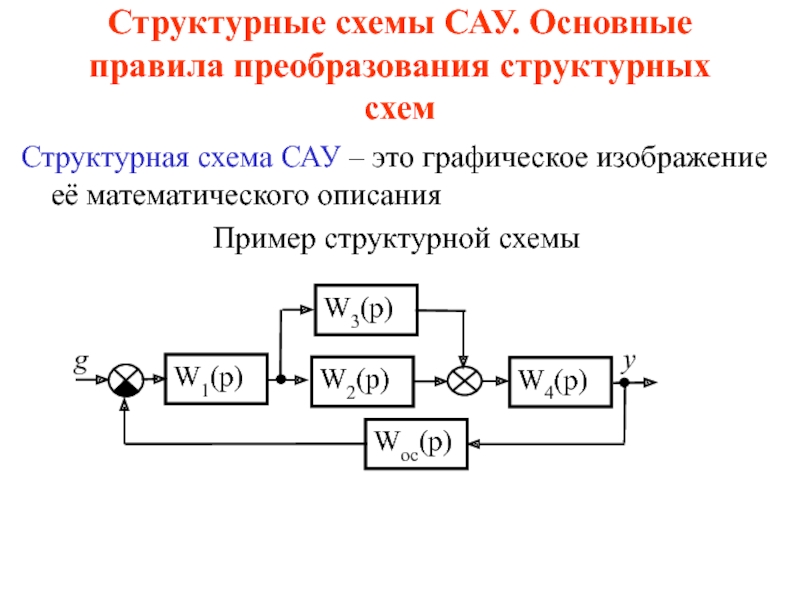
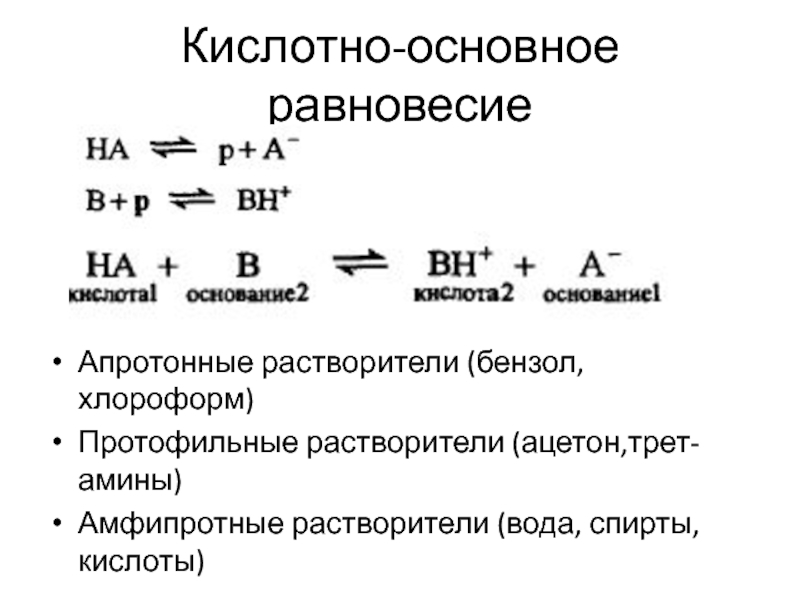
и более компонентов и продуктов их взаимодействия
Растворитель – вещество, чье
агрегатное состояние остается прежним при растворенииРастворяемое вещество – вещество, которое взаимодействует с растворителем, меняя или не меняя свое агрегатное состояние







![Введение в аналитическую химию Титрование Автопротолиз воды и pHH2O + H2O = H3O+ + OH-H2O = Автопротолиз воды и pHH2O + H2O = H3O+ + OH-H2O = H+ + OH-Kw=[H+][OH-]=10-14 при 250С[H+]=[OH-]=10-7pH= -lg[H+]](/img/thumbs/e592fd26d41a6d2340dd5673bf661811-800x.jpg)
![Введение в аналитическую химию Титрование Диссоциация кислот или основанийH2A = H+ + HA- Ka1 = Диссоциация кислот или основанийH2A = H+ + HA- Ka1 = [H+][HA-]/[H2A]HA- = H+ + A2-](/img/thumbs/3aaf6d783083bcb20fd4ae3f7081a95c-800x.jpg)
![Введение в аналитическую химию Титрование ГидролизPO43- + H2O = HPO42- + OH-Kг=[HPO42-][OH-]/[PO43-][H2O] = = ([HPO42-]/[H+][PO43-]) * ГидролизPO43- + H2O = HPO42- + OH-Kг=[HPO42-][OH-]/[PO43-][H2O] = = ([HPO42-]/[H+][PO43-]) * ([H+][OH-]/[H2O]) = Kw/Ka3NH4+ + H2O =](/img/tmb/3/279318/39af536a7eeedcf75cc9ab7c5988f020-800x.jpg)
![Введение в аналитическую химию Титрование Буферные системыс1 – концентрация кислоты, с2 - соли HA = A- Буферные системыс1 – концентрация кислоты, с2 - соли HA = A- + H+Ka=[H+][A-]/[HA] [H+] = Ka*[HA]/[A-] =](/img/thumbs/c98ba8a737a3331091a508bf2f3b060e-800x.jpg)