Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химические реакции
Содержание
- 1. Химические реакции
- 2. План:Типы химических реакций2. Скорость химической реакции. Факторы,
- 3. Химические реакции - процессы, в результате которых
- 4. По числу и составу реагирующих веществРеакции соединения
- 5. Реакции обмена – реакции, протекающие между двумя
- 6. Не окислительно-восстановительные - реакции, идущие без изменения
- 7. По тепловому эффектуЭкзотермические реакции - протекают с
- 8. Гетерогенные – реакции, в которых реагирующие вещества
- 9. Некаталитические – реакции, идущие без участия катализатора.Например,
- 10. Необратимые – протекают в данных условиях только
- 11. Скорость гомогенной реакции (υгомог.) определяется изменением количества
- 12. Скорость гомогенной реакции (υгомог.) определяется изменением концентрации одного из веществ в единицу времени
- 13. Скорость гетерогенной реакции (υгетер.) определяется изменением количества
- 14. Энергия активации Еакт - минимальный избыток энергии,
- 15. Природа реагирующих веществ: их состав, строение => энергия активации ▪ чем меньше Еакт, тем больше υ;
- 16. Якоб Хендрик Вант-Гофф1852 – 1911г.г.Голландский химик. Один
- 17. 3. Концентрация: чем ↑ С, тем чаще
- 18. Для реакции mA + nB =
- 19. Для газообразных веществ скорость химической реакции зависит
- 20. Катализаторы – вещества, которые изменяют механизм реакции,
- 21. Для гетерогенных реакций υ зависит:▪ от состояния поверхности соприкосновения реагирующих веществ.
- 22. Обратимые реакции при одних и тех же
- 23. Химическое равновесие Состояние обратимой реакции, при котором
- 24. Анри Луи Ле Шателье1850 – 1936 г.г.Французский
- 25. Слайд 25
- 26. Влияние концентрации на смещение химического равновесия Равновесие
- 27. Равновесие смещается при ↑ p (для газов)
- 28. Равновесие смещается при ↑ t – в
- 29. Окислительно-восстановительные реакции (ОВР) – химические реакции,
- 30. Основные понятия теории окислительно-восстановительных реакций.Окисление - процесс
- 31. Степень окисления (с.о.) – это условная величина,
- 32. Алгоритм вычисления степени окисления В молекулах простых
- 33. 4. С.о.водорода в соединениях = +1, (исключение:
- 34. Высшая (максимальная) с.о. элемента, как правило, =
- 35. Вещества, содержащие элементы в высшей степени окисления,
- 36. Важнейшие окислители1. Простые вещества –неметаллы с наибольшими
- 37. Важнейшие восстановители1. Простые вещества – металлы (например,
- 38. NH3 + O2→ NO + H2O1. Проставьте
- 39. N-3 - 5е- → N+2
- 40. Контрольные вопросы для закрепления:В 2 пробирки налили
- 41. Рекомендуемая литератураОбязательнаяПустовалова Л.М., Никанорова И.Е.Неорганическая химия. Ростов-на-Дону.
- 42. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Лекция № 7
Химические реакции
Преподаватель Ростовцева Л.В., 2011 г.
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ
ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
И СОЦИАЛЬНОГО РАЗВИТИЯ РОССИЙСКОЙ ФЕДЕРАЦИИСлайд 2План:
Типы химических реакций
2. Скорость химической реакции. Факторы, влияющие на скорость
химической реакции.
3. Химическое равновесие. Факторы, влияющие на смещение равновесия.
4.
Окислительно-восстановительные реакции. Метод электронного баланса.Слайд 3Химические реакции - процессы, в результате которых
из одних веществ
образуются другие,
отличающиеся по составу и (или) строению.
Типы химических реакций
Слайд 4
По числу и составу реагирующих веществ
Реакции соединения - реакции, в
результате которых из двух или более простых или сложных веществ
образуется одно более сложноеА + В = АВ
Например,
S + O2 = SO2
BaO + H2O = Ba(OH)2
Реакции разложения - реакции, в результате которых из одного сложного
Вещества получается два или более простых или сложных веществ
АВ = А + В
Например,
2HgO = 2Hg + O2 (t0)
2KMnO4 = K2MnO4 + MnO2 + O2 ↑ (t0)
Слайд 5Реакции обмена – реакции, протекающие между двумя сложными веществами, при
которых они обмениваются своими составными частями
АВ + СД = СВ
+ АДРеакции замещения - реакции, протекающие между простым и сложным веществом, при которых атомы простого вещества замещают атомы одного из элементов в сложном веществе
АВ + С = СВ + А
Например,
Zn + 2HCl = ZnCl2 + H2↑
Fe + CuSO4 = Cu + FeSO4
Например,
NaOH + HCl = NaCl + H2O
CuSO4 + 2NaOH = Na2SO4 + H2O
Слайд 6Не окислительно-восстановительные - реакции, идущие без изменения степеней
окисления химических
элементов
По изменению степеней окисления химических элементов
Окислительно-восстановительные - реакции, идущие с
изменением степеней окисления химических элементов.все реакции замещения, а также реакции соединения и разложения, в которых участвует хотя бы одно простое вещество
WO3 + 3H2 = W + 3H2O
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
Слайд 7
По тепловому эффекту
Экзотермические реакции - протекают с выделением энергии (+Q)
почти
все реакции соединения
Например, С + О2 +Q
искл. N2
+ O2 =2NO – QH2 + I2 = 2HI – Q
Эндотермические реакции - протекают с поглощением энергии
почти все реакции разложения
Например,
СаСО3 = СаО + СО2↑ – Q
Слайд 8Гетерогенные – реакции, в которых реагирующие вещества и продукты реакции
находятся в разных агрегатных состояниях.
Например,
Zn + 2HCl = ZnCl2
+ H2↑С (тв) + О2 (газ) = СО2 + Q
4. По агрегатному состоянию реагирующих веществ
(фазовому составу)
Гомогенные реакции - реакции, в которых реагирующие веществ аи продукты реакции находятся в одном агрегатном состоянии.
Например,
H2 (газ) + Cl2 (газ) = 2HCl (газ)
NaOH + HCl = NaCl + H2O
Слайд 9Некаталитические – реакции, идущие без участия катализатора.
Например,
CuSO4 + 2NaOH
= Na2SO4 + Cu(OH)2↓
5. По участию катализатора
Каталитические - реакции, идущие
с участием катализатора.Например,
2Н2О2 = 2Н2О + О2 (kat – MnO2)
Слайд 10Необратимые – протекают в данных условиях только в одном направлении.
Например,
реакции ионного обмена, сопровождающиеся образованием осадка,
выделением газа или малодиссоцииирующего
вещества (воды)
По направлению протекания реакции
Обратимые реакции - в данных условиях протекают одновременно в двух противоположных направлениях.
Например,
N2 + 3H2 ↔ 2NH3
Слайд 11Скорость гомогенной реакции (υгомог.) определяется изменением количества вещества в единицу
времени в единице объёма
υгомог. =где Δ n – изменение числа молей одного из веществ, (моль);
Δt – интервал времени (с, мин);
V – объем газа или раствора (л)
Δ n
Δt ∙V
ΔC
ΔC – изменение концентрации
2. Скорость химической реакции. Факторы, влияющие на скорость химической реакции.
Слайд 12
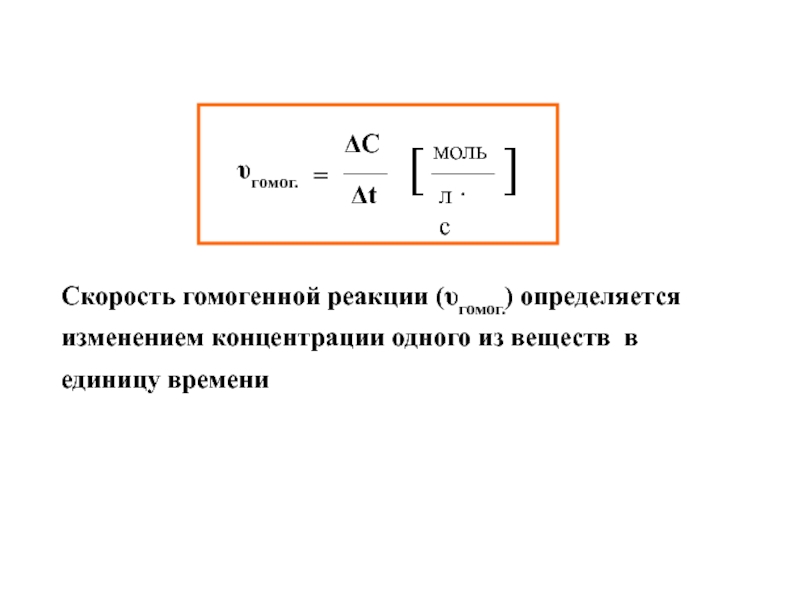
Скорость гомогенной реакции (υгомог.) определяется изменением концентрации одного из веществ
в единицу времени
Слайд 13Скорость гетерогенной реакции (υгетер.) определяется изменением количества вещества в единицу
времени на единице поверхности соприкосновения веществ
υгетер.
Δt ∙ S
Δ n
=
где
Δ n – изменение количества вещества (реагента или продукта), (моль);Δt – интервал времени (с, мин);
S – площадь поверхности соприкосновения веществ (см2, м2)
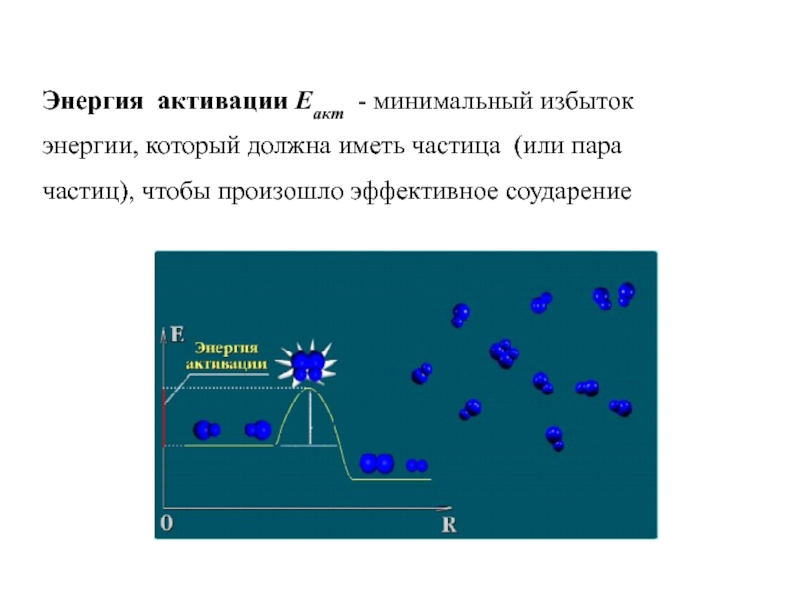
Слайд 14Энергия активации Еакт - минимальный избыток энергии, который должна иметь
частица (или пара частиц), чтобы произошло эффективное соударение
Слайд 15Природа реагирующих веществ: их состав, строение => энергия активации
▪
чем меньше Еакт, тем больше υ;
Слайд 16Якоб Хендрик Вант-Гофф
1852 – 1911г.г.
Голландский химик. Один из основателей физической
химии и стереохимии. Предложил классификацию химических реакций.
Установил, что повышении
температуры на каждые 100С скорость реакции увеличивается в 2-4 раза.2. Температура: при ↑ t на каждые 100 С, υ ↑ в 2-4 раза (правило Вант-Гоффа)
При ↑ t, ↑ количество активных частиц (с Еакт) и их активных соударений.
Слайд 173. Концентрация: чем ↑ С, тем чаще происходят соударения и
υ ↑.
Закон действующих масс (з. д. м.):
Скорость химической реакции
(υх.р.) прямо пропорциональна произведению концентраций реагирующих веществ,
взятых в степенях их коэффициентов в уравнении реакции
Слайд 18Для реакции mA + nB = C по закону
действующих масс:
υ = k ∙ СAm ∙ CBnгде k – константа скорости;
С – концентрация (моль/л)
* З.д.м. не учитывает концентрации реагирующих веществ, находящихся в твердом состоянии, т.к. они реагируют на поверхности и их концентрации обычно остаются постоянными.
Слайд 19Для газообразных веществ скорость химической реакции
зависит от давления (что
аналогично изменению концентрации
реагирующих веществ)
Чем ↑ р, тем ↑ υ
Слайд 20Катализаторы – вещества, которые изменяют механизм реакции, уменьшают Еакт =>
υ ↑.
▪ Катализаторы остаются неизменными по окончании
реакции▪ Ферменты – биологические катализаторы, по природе
белки
▪ Ингибиторы – вещества, которые ↓ υ
Слайд 21Для гетерогенных реакций υ зависит:
▪ от состояния поверхности соприкосновения
реагирующих веществ.
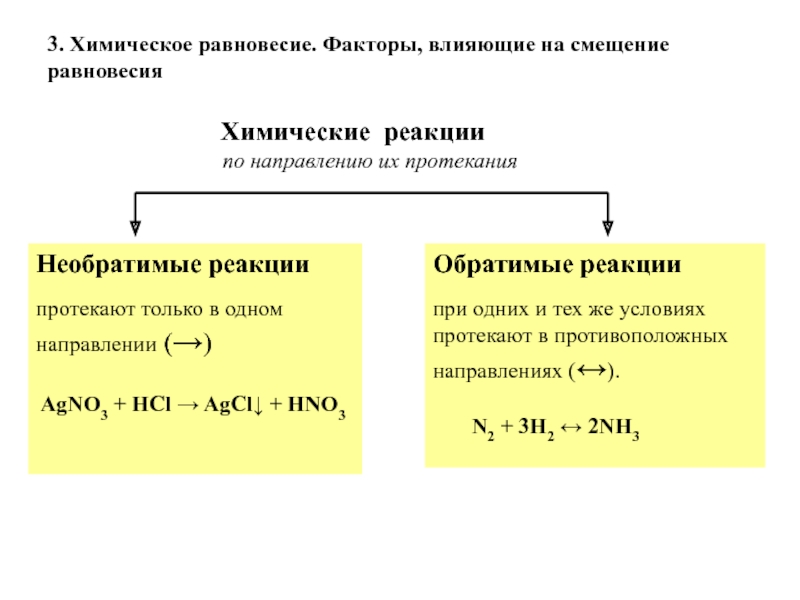
Слайд 22Обратимые реакции
при одних и тех же условиях протекают в
противоположных направлениях (↔).
N2 + 3H2 ↔
2NH3 Химические реакции
по направлению их протекания
Необратимые реакции
протекают только в одном направлении (→)
AgNO3 + HCl → AgCl↓ + HNO3
3. Химическое равновесие. Факторы, влияющие на смещение равновесия
Слайд 23Химическое равновесие
Состояние обратимой реакции, при котором
υпр. = υ обр.
называется химическим равновесием
→
←
аА + bB ↔ cC + dD
Кравн.= [С] с · / ·
[D ]d
[B]b
[A]a
Слайд 24Анри Луи Ле Шателье
1850 – 1936 г.г.
Французский физико-химик.
Член парижской
Академии наук,
почетный член Петербургской академии наук
(с 1913г.) и Академии
наук СССР (с 1926г.)В 1884 г. сформулировал принцип смещения
равновесия, названный его именем.
Слайд 25 Принцип Ле
Шателье (1844 г.)
Если на систему, находящуюся в состоянии равновесия, оказать
внешнее воздействие (изменить t, р, С), то равновесие сместится в ту сторону, которая ослабит это воздействиеСлайд 26
Влияние концентрации на смещение химического равновесия
Равновесие смещается
при ↑
Среаг.в-в. →
при ↑ Спрод .р-ции ←
Слайд 27Равновесие смещается
при ↑ p (для газов) - в сторону
уменьшения объема (V) газообразных веществ
при ↓ р –
в сторону увеличения V;* если реакция протекает без изменения числа молекул газообразных веществ, то давление не влияет на равновесие в данной системе
Влияние давления на смещение химического равновесия
Слайд 28Равновесие смещается
при ↑ t – в сторону эндотермической реакции
(- Q)
при ↓ t – в сторону экзотермической
реакции (+ Q)Влияние температуры на смещение химического равновесия
Слайд 29Окислительно-восстановительные реакции (ОВР) – химические реакции, сопровождающиеся переходом электронов
от одного атома к другому, что ведёт к изменению степени
окисления атомов элементов, участвующих в реакции.Восстановитель + Окислитель = Продукты реакции
ne-
4. Окислительно-восстановительные реакции. Метод электронного баланса.
Слайд 30Основные понятия теории окислительно-восстановительных реакций.
Окисление - процесс отдачи электронов,
степень
окисления при этом повышается Al0 -
3ē → Al+32. Восстановление - процесс присоединения электронов,
степень окисления при этом понижается S0 +2ē → S-2
3. Окислитель – вещество, в состав которого входит элемент,
способный принимать электроны.
4. Восстановитель – вещество, в состав которого входит элемент,
отдающий электроны.
5. Окисление всегда сопровождается восстановлением,
восстановление всегда связано с окислением.
Слайд 31
Степень окисления (с.о.) – это условная величина, которая показывает заряд
того или иного элемента в соединении при условии, что все
составляющие его частицы представляют собой ионы.Слайд 32Алгоритм вычисления степени окисления
В молекулах простых веществ степень окисления
атомов всегда = 0
2. С.о. кислорода в соединениях =
– 2 (исключение: фторид кислорода ОF2, где с.о. +2
пероксиды Н2О2, Nа2О2, где с.о. – 1
3. С.о. фтора во всех соединениях = – 1
Слайд 33
4. С.о.водорода в соединениях = +1,
(исключение: гидриды активных металлов
NаН, СаН2 с.о. – 1;
5. С. о. металлов всегда положительная
и численно = валентности металла в соединении.6. Алгебраическая сумма степеней окисления атомов в молекуле = 0, а в ионе – заряду иона.
Слайд 34
Высшая (максимальная) с.о. элемента, как правило, = номеру
группы, в которой
находится элемент в периодической системе
Низшая (минимальная) с.о. металлов = 0.
Низшая
(минимальная) с.о. неметаллов обычно = (номер группы - 8)Значения с.о. элемента между высшей и низшей с.о. называются
промежуточными
Слайд 35Вещества, содержащие элементы в высшей степени окисления,
могут быть только
окислителями, (атомы элементов могут только принимать электроны).
Вещества, содержащие элементы низшей
степени окисления,могут быть только восстановителями, (атомы элементов могут только отдавать электроны).
Вещества, содержащие элементы в промежуточных степенях окисления, обладают
окислительно-восстановительной двойственностью, они могут быть как окислителями,
так и восстановителями, в зависимости от партнера реакции.
Например,
Н2S+6 О4 – высшая с.о., окислитель
Н2S-2 – низшая с.о., восстановитель;
Н2S+4О3 - промежуточная с.о., восстановитель и окислитель
Слайд 36Важнейшие окислители
1. Простые вещества –неметаллы с наибольшими значениями электроотрицательности –
кислород О2, фтор F2
2. Сложные вещества, молекулы которых содержат элемент
в высшей с.о.KMnO4, HNO3, H2SO4, K2Cr2O4
Слайд 37Важнейшие восстановители
1. Простые вещества – металлы (например, Na, Mg, Al
и др.)
2. Сложные вещества, молекулы которых содержат элемент в низшей
с.о. NH3, CH4, H2S, HCl
3. К широко применяемым в промышленности
восстановителям относятся водород Н2,
углерод С (в виде угля или кокса)
и оксид углерода (II)СО.
Слайд 38NH3 + O2→ NO + H2O
1. Проставьте с. о. над
химическим знаком каждого элемента в формулах веществ
+1
0
-3
-2
+2
-2
+1
2. Подчеркните символы
элементов, у которых степень окисленияизменяется в процессе реакции
__
__
3. Составьте электронные уравнения процессов окисления и
восстановления
N-3 → N+2
О20 → 2О-2
- 5ē
+ 4ē
Метод электронного баланса
Слайд 39N-3 - 5е- → N+2
О20 + 4е-→
2О-2 4. Найдите наименьшее общее кратное и основные коэффициенты
5
4
20
4
5
5. Расставьте основные коэффициенты в схеме реакции перед
восстановителем и окислителем в левой части и, соответственно,
перед окисленной и восстановленной формами в правой части.
окисление, восстановитель
восстановление, окислитель
NH3+ O2 → NO + H2O
4
4
5
6
6. Уравняйте числа атомов элементов, которые не изменили с.о.
Слайд 40Контрольные вопросы для закрепления:
В 2 пробирки налили одинаковые объёмы раствора
серной кислоты
и одновременно опустили в одну – железный гвоздь,
в другую – железные опилки.
Сравните скорости реакций в обеих пробирках и объясните причину
их различия.
2. Как сместиться химическое равновесие реакции 2СО + О2 ↔ 2СО2 + Q при
а) повышении температуры;
б) повышении давлении
3. Определите высшую и низшую степень окисления
а) азота
б) хлора
Слайд 41Рекомендуемая литература
Обязательная
Пустовалова Л.М., Никанорова И.Е.Неорганическая химия.
Ростов-на-Дону. Феникс. 2005. –352с.
гл. 1.5. с. 104-127
Дополнительная
Ахметов Н.С. Общая и неорганическая химия. М.:
Высшая школа, 2009.- 368с.Глинка Н.Л. Общая химия. КноРус, 2009.-436 с.
Ерохин Ю.М. Химия. Учебник для студ. Сред проф.образ.-М.: Академия, 2006.- 384с.