Слайд 2Опредение:
Хронический миелолейкоз — миелоидная опухоль, развивающаяся из полипотентной клетки-предшественницы. Её
пролиферация и дифференцировка приводят к расширению ростков кроветворения, представленных (в
отличие от острых лейкозов) преимущественно зрелыми и промежуточными формами лейкозных клеток. В большинстве случаев закономерным исходом болезни является бластный криз, характеризующийся появлением большого количества бластных клеток и рефрактерностью к терапии и заканчивающийся летально.
Хронический миелобластный лейкоз (ХМЛ, хронический миелолейкоз, хронический миелоидный лейкоз) — форма лейкоза, которая характеризуется усиленным и нерегулируемым ростом преимущественно миелоидных клеток в костном мозге с их накоплением в крови. ХМЛ — гемопоэтическое клоновое заболевание, основным проявлением которого является пролиферация зрелых гранулоцитов (нейтрофилов, эозинофилов и базофилов) и их предшественников; вариант миелопролиферативного заболевания, ассоциированный с характерной хромосомной транслокацией (филадельфийской хромосомой)
Слайд 3Причины и патогенез хронического миелолейкоза
На уровне клетки-предшественницы происходит транслокация t(9;22),
что приводит к появлению так называемой филадельфийской хромосомы и экспресии
мутантного гена bcr-abl, кодирующего белок р210, обладающий свойствами тирозинкиназы. Экспансия Рп-позитивных клеток в костном мозге, периферической крови и экстрамедуллярных областях объяснима не столько их высокой пролиферативной активностью, сколько расширением пула гранулоцитарных предшественников, утерявших чувствительность к регуляторным стимулам и изменениям микроокружения. Это приводит к их диссеминации, нарушению продукции цитокинов и подавлению нормального гемопоэза. Период полужизни гранулоцита при ХМЛ превышает таковой нормального гранулоцита в 10 раз. Транслокация t(9;22) является диагностической для ХМЛ. При её отсутствии заболевание, характеризующееся клиническими, морфологическими и цитохимическими признаками ХМЛ, определяется как атипичный хронический миелолейкоз.
Слайд 4Клиника:
На ранних этапах хронической стадии заболевания больные могут жаловаться на
утомляемость и снижение работоспособности. Прогрессирующая стадия иногда развивается через 2—10
и более лет с момента установления диагноза. Она характеризуется значительным нарастанием количества лейкоцитов в основном за счет миелоцитов и промиелоцитов, увеличением размеров печени и селезенки, возможным развитием инфарктов селезенки и периспленита.
У больных в стадии властного криза отмечаются резкое ухудшение общего состояния, признаки интоксикации, лихорадка, боли в костях, анемия, геморрагии. В гемограмме и/или в костном мозге обнаруживается значительное количество миелобластов. В единичных случаях выявляются лимфобласты, что свидетельствует о поражении кроветворения на уровне полипотентной стволовой клетки.
Тяжесть течения заболевания усугубляется присоединяющимися бактериальными инфекциями на фоне снижения фагоцитарной активности гранулоцитов, содержания лизоцима и уровня бета-лизинов в сыворотке крови, угнетения продукции комплемента и антителообразования.
Предвидеть приближение властного криза помогают появление признаков резистентности к химиотерапии и изменение кариологического профиля лейкозных клеток (анеуплоидия преимущественно в виде гипердиплоидных клонов, большие уродливые ядра клеток). Моноклоновая популяция клеток с Ph'-хромосомой заменяется поликлоновой, отличающейся резкой анаплазией клеток (уродливость и увеличение диаметра клеток и др.), они выходят за пределы костного мозга, метастазируют в селезенку, лимфатические узлы, печень, кости, другие органы и ткани. При этом значительно увеличиваются отдельные группы лимфоузлов, меняется гемограмма: она нормализуется или в ней обнаруживают резко анаплазировапные элементы, трудно идентифицируемые морфологически и цитохимически. В пунктатах, отпечатках и биоптатах лимфатических узлов выявляются аналогичные клетки. Подобное течение хронического миелолейкоза рассматривается как эквивалент опухолевой прогрессии.

Слайд 5Стадии:
Развёрнутая стадия хронического миелолейкоза-у больного отсутствуют жалобы, не увеличена или
незначительно увеличена селезёнка, состав периферической крови изменён. На этой стадии
диагноз можно установить на основании наличия «немотивированной» природы нейтрофильного лейкоцитоза со сдвигом формулы до ми-елоцитов и промиелоцитов, существенно повышенного соотношения лейкоциты/эритроциты в костном мозге, филадельфийской хромосомы в грануло-цитах крови и клетках костного мозга. В трепанате костного мозга уже в этот период, как правило, наблюдается почти полное вытеснение жира миелоидной тканью. Развёрнутая стадия хронического миелолейкоза может продолжаться в среднем 4 года. При правильной терапии состояние больных остаётся удовлетворительным, они сохраняют трудоспособность, ведут обычный образ жизни при амбулаторном наблюдении и лечении
Терминальная стадия хронического миелолейкоза- течение приобретает черты злокачественности: высокая лихорадка, быстро прогрессирующее истощение, боль в костях, значительная слабость, быстрое увеличение селезёнки, печени, иногда — лимфатических узлов. Для этой стадии характерны появление и интенсивное нарастание признаков подавления нормальных ростков кроветворения — анемия, тромбоцитопения с геморрагическим синдромом; гранулоцитопения, осложняющаяся инфекцией; некрозами слизистых оболочек. Важнейшим гематологическим признаком терминальной стадии ХМЛ является бластный криз — увеличение содержания бластных клеток в костном мозге и крови (сначала миелобластов, затем — морфологически не дифференцируемых бластов). На терминальной стадии более чем в 80% случаев появляются анеуплоидные клоны клеток — кроветворные клетки, содержащие ненормальное число хромосом. Продолжительность жизни больных на этой стадии чаще не превышает 6—12 мес.
Бластный криз — финальная стадия развития ХМЛ, протекающая подобно острому лейкозу, с быстрой прогрессией и непродолжительной выживаемостью. диагностируется на основе одного из следующих признаков у пациента с ХМЛ:>20 % миелобластов или лимфобластов в крови или костном мозге; Крупные группы бластов в костном мозге при биопсии; Развитие хлоромы (солидного фокуса лейкемии вне костного мозга)

Слайд 6
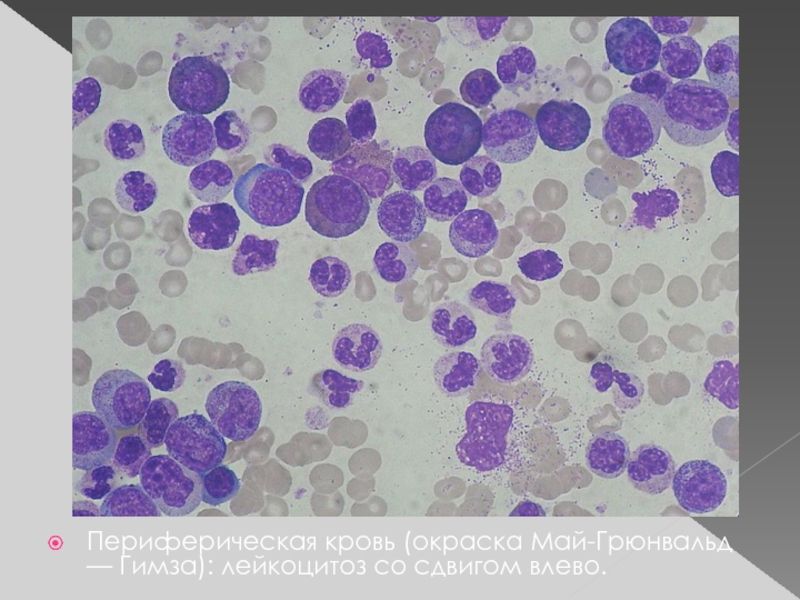
Периферическая кровь (окраска Май-Грюнвальд — Гимза): лейкоцитоз со сдвигом влево.
Слайд 7Диагноз
ХМЛ часто предполагается на основании общего анализа крови, демонстрирующего повышение
количества гранулоцитов всех типов, включая зрелые миелоидные клетки. Базофилы и
эозинофилы повышены практически всегда, это позволяет дифференцировать ХМЛ от лейкемоидной реакции. Для оценки ХМЛ часто проводится пункция костного мозга, однако одной лишь морфологической оценки костного мозга недостаточно для диагностики ХМЛ.
В конечном счёте, ХМЛ диагностируется посредством выявления Филадельфийской хромосомы. Эта характерная хромосомная аномалия может быть выявлена цитогенетически, при помощи флюоресцентной гибридизации in situ или определения гена BCR/ABL методом ПЦР.
Существуют разногласия в отношении так называемого Ph-негативного ХМЛ, или случаев предполагаемого ХМЛ, при котором Филадельфийская хромосома не обнаруживается. У многих таких пациентов в действительности имеют место комплексные хромосомные аномалии, маскирующие (9;22) транслокацию, либо имеются свидетельства транслокации при флюоресцентной гибридизации или ПЦР с обратной транскрипцией, несмотря на «нормальное» рутинное кариотипирование. Небольшую подгруппу пациентов с отсутствием молекулярных свидетельств bcr-abl транслокации относят к недифференцированному миелодиспластическому/миелопролиферативнму расстройству, так как отмечается тенденция к отличию в его клиническом течении от ХМЛ.

Слайд 8Лечение
Лечение хронического миелолейкоза определяется стадией заболевания. В случаях слабо
выраженных клинико-гематологических проявлений хронической стадии рекомендуют общеукрепляющую терапию, полноценное питание,
богатое витаминами, регулярное диспансерное наблюдение. Имеются сведения о благоприятном влиянии на течение заболевания а-интерферона.
Слайд 9При лейкоцитозе 30—50*109/л назначают миелосан по 2—4 мг/сут, при лейкоцитозе
до 60— 150*109/л и доза его повышается до 6 мг/сут,
при более высоком лейкоцитозе суточная доза препарата может быть увеличена до 8 мг. Цитопенический эффект начинает проявляться не ранее чем на 10-й день после начала приема миелосана. Нормализация гемограммы и уменьшение размеров селезенки обычно наступают на 3—6-й неделе лечения при общей дозе препарата 250—300 мг. В дальнейшем назначается поддерживающая терапия в виде приема 2—4 мг миелосана 1 раз в неделю или периодически проводят курсы миелосанотерапии при появлении первых признаков обострения процесса (повышение количества лейкоцитов до 20—25*109/л, увеличение размеров селезенки) число тромбоцитов уменьшается до 100*109/л, прием миелосана временно прекращают.
Слайд 10Лучевая терапия может быть назначена в качестве первичного лечения главным
образом в тех случаях, когда основным клиническим симптомом является спленомегалия.
При этом уровень лейкоцитов должен быть не ниже 100* 109/л. Лучевую терапию прекращают при снижении количества лейкоцитов до 7—20*109/л. Дальнейшее поддерживающее лечение миелосаном назначают не ранее чем через 1 мес. после отмены лучевой терапии.
В прогрессирующей стадии хронического миелолейкоза применяют моно- и полихимиотерапию.
Миелобромол назначают при значительном лейкоцитозе, в случаях недостаточной эффективности миелосана по 125—250 мг в день под строгим контролем показателей периферической крови. Нормализация гемограммы обычно наступает через 2—3 нед от начала лечения. Для поддерживающей терапии применяют миелобромол в дозах 125—250 мг 1 раз в 5—7—10 дней.
Допан используют при значительной спленомегалии, когда другие противолейкозные средства малоэффективны, его назначают по 6— 10 мг/сут однократно, 1 раз в 4—6—10 и более дней. Интервалы между отдельными приемами зависят от скорости и степени уменьшения числа лейкоцитов и размеров селезенки. Лечение допаном прекращают при снижении количества лейкоцитов до 5—7*109/л. Поскольку возможно появление диспепсических явлений, препарат назначают после ужина. с последующим приемом снотворного средства. Допан может быть рекомендован и для поддерживающего лечения по 6— 10 мг 1 раз в 2—4 нед под контролем данных гемограммы.
Гексафосфамид показан в основном в случаях развившейся резистентности к миелосану, допану, миелобромолу и лучевой терапии. При числе лейкоцитов в крови более 100*109/л его назначают по 20 мг в день, а при 40—60*109/л — по 10—20 мг 2 раза в неделю. Дозу уменьшают в зависимости от темпа снижения количества лейкоцитов. При их снижении до 10—15*109/л препарат отменяют. Курсовая доза составляет в среднем 140—600 мг, курс лечения 10—30 дней. Положительная динамика в ответ на лечение гексафосфамидом появляется, как правило, через 1—2 нед. Поддерживающую терапию гексафосфамидом проводят в дозах 10 и 20 мг 1 раз в 5, 7, 10 или 15 дней.