Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Алгоритм решения задач на нахождение массы и количества вещества по уравнениям реакций
Содержание
- 1. Алгоритм решения задач на нахождение массы и количества вещества по уравнениям реакций
- 2. Стехиометрия – раздел химии, изучающий массовые и
- 3. Алгоритм решения задач на нахождение массы и количества вещества по уравнениям реакций
- 4. Пример. Определить массу оксида магния, образующегося при
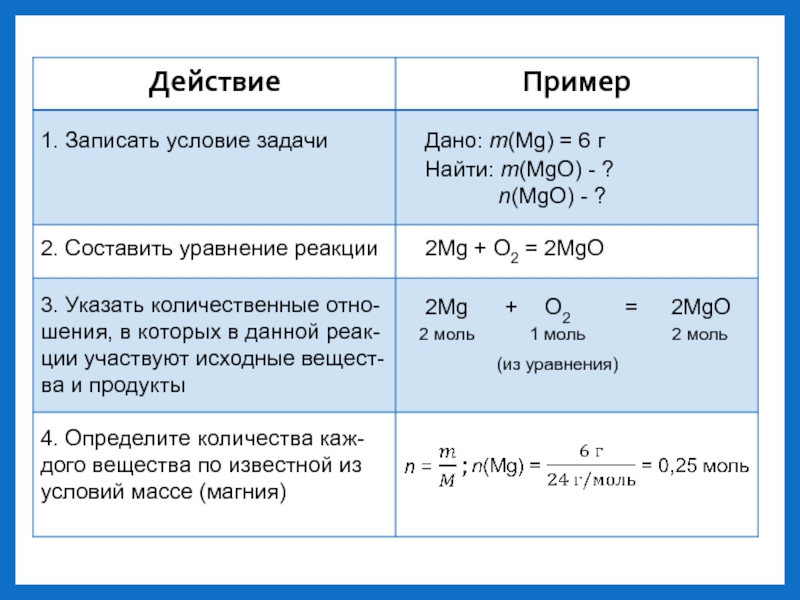
- 5. 1. Записать условие задачиДано: m(Mg) = 6
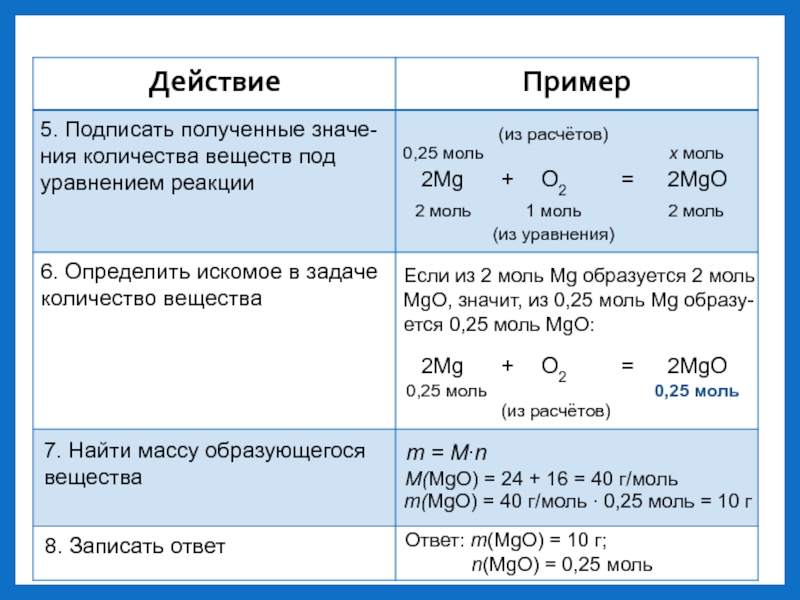
- 6. 5. Подписать полученные значе-ния количества веществ под
- 7. Задачи1. Вычислите массу оксида алюминия, который можно
- 8. Домашнее заданиеЗадачник: №8-7, 5-28, 5-31.
- 9. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Стехиометрия – раздел химии, изучающий массовые и объемные отношения между
реагентами.
стехиометрическими.Слайд 4Пример. Определить массу оксида магния, образующегося при взаимодействии 6 г
магния с кислородом. Какое количество вещества оксида магния получилось в
результате реакции?Слайд 51. Записать условие задачи
Дано: m(Mg) = 6 г
Найти: m(MgO) -
?
n(MgO) - ?
2. Составить
уравнение реакции2Mg + O2 = 2MgO
3. Указать количественные отно-
шения, в которых в данной реак-
ции участвуют исходные вещест-
ва и продукты
2Mg + O2 = 2MgO
2 моль
2 моль
1 моль
(из уравнения)
4. Определите количества каж-
дого вещества по известной из
условий массе (магния)
Слайд 65. Подписать полученные значе-
ния количества веществ под
уравнением реакции
2Mg +
O2 = 2MgO
2 моль
2 моль
1 моль
(из уравнения)
0,25 моль
x моль
(из расчётов)
6.
Определить искомое в задаче количество вещества
Если из 2 моль Mg образуется 2 моль
MgO, значит, из 0,25 моль Mg образу-
ется 0,25 моль MgO:
2Mg + O2 = 2MgO
0,25 моль
0,25 моль
(из расчётов)
7. Найти массу образующегося
вещества
m = M∙n
M(MgO) = 24 + 16 = 40 г/моль
m(MgO) = 40 г/моль ∙ 0,25 моль = 10 г
8. Записать ответ
Ответ: m(MgO) = 10 г;
n(MgO) = 0,25 моль
Слайд 7Задачи
1. Вычислите массу оксида алюминия, который можно получить при сгорании
135 г порошка алюминия.
2. Рассчитайте массу перманганата калия, необходимого для
получения кислорода массой 80 г. 3. Вычислите массу и объем (н.у.) водорода, который можно получить при растворении 19,5 г цинка в избытке разбавленной серной кислоты.
4. Вычислите массу и объем (н.у.) водорода, необходимого для получения 56 о (н.у.) сероводорода. Рассчитайте массу серы, которая потребуется для реакции.
№8-8
№8-5
№5-27
№4-44