Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Аллотропия 9 класс
Содержание
- 1. Аллотропия 9 класс
- 2. Содержание
- 3. Простых веществ существует больше, чем
- 4. Понятие «аллотропия» введено в науку
- 5. Аллотропия кислорода
- 6. Слайд 6
- 7. Аллотропия фосфораАллотропное превращение красного фосфора в белый
- 8. Существует несколько форм красного фосфора. Их структуры
- 9. Белый фосфор имеет молекулярное строение P4 и
- 10. Аллотропное превращение красного фосфора в белый
- 11. Черный фосфор имеет слоистую атомную кристаллическую решетку,
- 12. Аллотропия оловаЭкспедиция Р. Скотта к Южному Полюсу
- 13. Белое олово — это серебристо-белый, мягкий,
- 14. Серое олово — аллотропная модификация,
- 15. Экспедиция Скотта к Южному полюсуСкотт Роберт Фалкон(1868
- 16. Экспедиция Скотта к Южному полюсу В
- 17. Экспедиция Скотта к Южному полюсуВ чём же
- 18. Аллотропия серыПревращение аллотропных модификаций серы
- 19. Кристаллическая сера имеет две модификации; одну из
- 20. Моноклинная модификация серы представляет собой длинные прозрачные
- 21. Коричневая, пластичная, вязко-эластичная масса. Пластическая сера образуется
- 22. Взаимопревращение аллотропных модификаций серы
- 23. Аллотропия кремния
- 24. Кристаллический кремний – темно-серое вещество, имеющее кубические кристаллы.
- 25. Аморфный кремний – бурый порошок, не имеющий
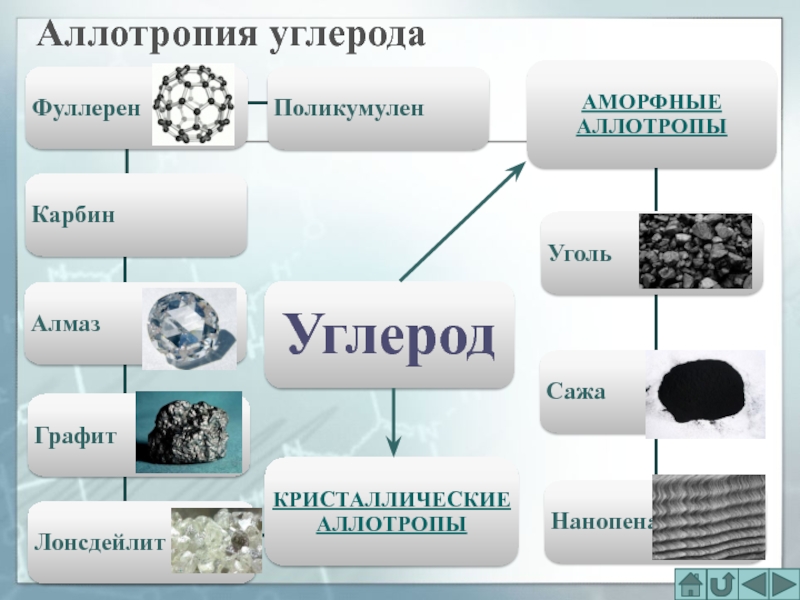
- 26. Аллотропия углеродаАМОРФНЫЕ АЛЛОТРОПЫКРИСТАЛЛИЧЕСКИЕ АЛЛОТРОПЫУглеродКарбинПоликумулен
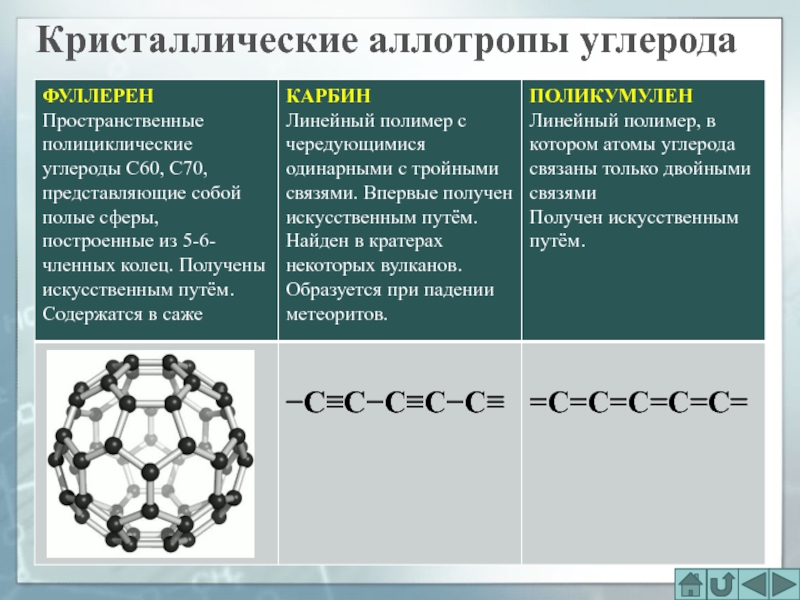
- 27. Кристаллические аллотропы углерода
- 28. Кристаллические аллотропы углерода
- 29. Аморфные аллотропы углерода
- 30. Источники Федеральный центр информационно-образовательных ресурсов http://www.eor.edu.ru/ Взаимопревращения
- 31. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3 Простых веществ существует больше, чем химических элементов, т.к.
для некоторых из них характерно явление аллотропии.
АЛЛОТРОПИЯ - способность атомов
одного элемента образовывать несколько простых веществ. Явление аллотропии обусловлено в одних случаях тем, что молекулы простого вещества состоят из различного числа атомов (О, О2, О3), в других - тем, что их кристаллы имеют различное строение (алмаз, графит, карбин).
Название «аллотропия» происходит от гречеких слов állos — «иной», «другой» и trópos — «поворот», «свойство».
Образование кристаллов различных модификаций – частный случай полиморфизма.
ПОЛИМОРФИ́ЗМ (от поли... - «много» и греч. morphe — форма), свойство некоторых веществ существовать в нескольких кристаллических фазах, отличающихся по симметрии структуры и по свойствам.
Понятие аллотропии
Слайд 4 Понятие «аллотропия» введено в науку Й.Я. Берцелиусом для
обозначения изомерных видоизменений элементов
(1841 г.).
Причинами аллотропии он
считал:Различное число атомов в молекуле;
Различное относительное положение атомов в кристалле.
Йёнс Якоб Берцелиус
(1779-1848)
шведский химик
Введение термина «аллотропия» в науку
Слайд 8 Существует несколько форм красного фосфора. Их структуры окончательно не установлены.
Известно, что они являются атомными веществами с полимерной кристаллической решеткой.
Их плотность колеблется в интервале 2,0-2,4 г/см3, Тпл.=585-600о С, цвет от темного - коричневого до красного и фиолетово. Химическая активность красного фосфора значительно меньше, чем у белого, поэтому его хранят в обычных склянках с хорошо притертыми пробками. Красный фосфор гигроскопичен, не ядовит.Красный фосфор
Слайд 9 Белый фосфор имеет молекулярное строение P4 и представляет собой мягкую,
внешне похожую на воск, бесцветную массу, на счету быстро желтеющую
и утрачивающую прозрачность. Белый фосфор ядовит, смертельная доза для человека составляет 0,15 г. Белый фосфор легко испаряется, его пары окисляются, а энергия переходит в светлую. Поэтому в темноте белый фосфор светится. Был открыт в 1669 году немецким алхимиком Хеннингом Брандом (первое в истории химии датированное открытие элемента).Белый фосфор
Слайд 11 Черный фосфор имеет слоистую атомную кристаллическую решетку, по внешнему виду
похож на графит, но является полупроводником, не ядовит.
Чёрный фосфор
Слайд 13 Белое олово — это серебристо-белый, мягкий, пластичный металл. Координационное
окружение каждого атома олова в нем — октаэдр. ρ =
7,228 г/см3.Тпл. = 231,9°C
Ткип. = 2270°C.
Белое олово
Слайд 14 Серое олово — аллотропная модификация, кристаллизующаяся в кубической
структуре типа алмаза и имеющая меньшую плотность, чем металлическое «белое» олово. При
температуре ниже -13,2°C белое олово переходит в серое, происходит увеличение удельного объема на 25,6%, и металл рассыпается в серый порошок. Это превращение называется «оловянной чумой». Серое олово является узкозонным полупроводником.Серое олово
Слайд 15Экспедиция Скотта к Южному полюсу
Скотт Роберт Фалкон
(1868 – 1912)
один из
первооткрывателей Южного Полюса
Явление аллотропии сыграло роковую роль в
судьбе покорителей Южного Полюса. В 1910 году английский полярный исследователь Роберт Скотт снарядил экспедицию, целью которой было достичь Южного Полюса. Много трудных месяцев передвигались отважные путешественники по снежным пустыням антарктического материка, оставляя на своём пути небольшие склады с продуктами и керосином – запасы на обратную дорогу.
Слайд 16Экспедиция Скотта к Южному полюсу
В начале 1912 г.
экспедиция наконец достигла Южного Полюса. Но оказалось, что на месяц
раньше здесь побывал норвежский путешественник Р. Амудсен.Однако главная беда поджидала Р. Скотта на обратном пути. На складах, которые они оставили, не осталось керосина, он весь вытек. Продрогшим людям нечем было согреться и не на чем приготовить пищу. Вскоре Роберт Скотт и его друзья погибли.
Участники экспедиции к Южному Полюсу. 1912 г.
Слайд 17Экспедиция Скотта к Южному полюсу
В чём же крылась причина исчезновения
керосина? Почему тщательно подготовленная экспедиция закончилась трагически?
Причина оказалась простой: жестяные
банки с керосином были запаены оловом, а на морозе олово «заболевает» «оловянной чумой»: блестящее белое олово превращается в хрупкий белый порошок (серое олово). Слайд 19 Кристаллическая сера имеет две модификации; одну из них, ромбическую, получают
из раствора серы в сероуглероде (CS2) испарением растворителя при комнатной
температуре. При этом образуются ромбовидные просвечивающие кристаллы светло-желтого цвета, легко растворимые в CS2. Эта модификация устойчива до 960С, при более высокой температуре стабильна моноклинная форма.Ромбическая сера
Слайд 20 Моноклинная модификация серы представляет собой длинные прозрачные темножелтые игольчатые кристаллы,
также растворимые в CS2. При охлаждении моноклинной серы образуется более
стабильная желтая ромбическая сера. Моноклинная сера плавится при 1190С. Расплавленная сера состоит главным образом из циклических молекул S8 и представляет собой подвижную желтую жидкость. При нагревании расплава до температур выше 1600С циклы S8 размыкаются, образуя длинные многоатомные цепи, расплав постепенно теряет текучесть и меняет цвет: из желтого становится темно-коричневым.Моноклинная сера
Слайд 21 Коричневая, пластичная, вязко-эластичная масса. Пластическая сера образуется при быстром охлаждении
расплавленной серы. Чистую серу нагрейте в термостойкой пробирке до 250-350°С.
Затем расплав вылейте тонкой струей в цилиндр с холодной водой. В нижней части цилиндра собираются нити пластической серы.Пластическая сера
Слайд 24 Кристаллический кремний – темно-серое вещество, имеющее кубические кристаллы.
Основная форма, в
которой используется кремний при производстве фотоэлектрических преобразователей и твердотельных электронных приборов. Активно
развивается использование кремния в виде тонких плёнок кристаллической и аморфной структуры на различных подложках.Кристаллический кремний
Слайд 25
Аморфный кремний – бурый порошок, не имеющий постоянной температуры плавления.
В
солнечных батареях обычно используются солнечные элементы из аморфного кремния и
микрокристаллические кремниевые клеткиВ составе солнечной батареи – аморфный кремний
Аморфный кремний
Слайд 30Источники
Федеральный центр информационно-образовательных ресурсов http://www.eor.edu.ru/
Взаимопревращения аллотропных модификаций серы
http://files.school-collection.edu.ru/dlrstore/bed068ab-8cff-11db-b606-0800200c9a66/ch09_22_06.swf
Видеоролик «Превращение аллотропных модификаций фосфора. СD
1С Репетитор. Химия
http://glossword.info/http://ru.wikipedia.org/