Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Атомы химических элементов. Структура Периодической системы
Содержание
- 1. Атомы химических элементов. Структура Периодической системы
- 2. Цель урока: Цель урока: Обобщение знаний о
- 3. Учебный Элемент – 1. РАЗМИНКА «Знаки
- 4. Карточка Задание:Выявите соответствие сведений в 1, 2
- 5. Учебный Элемент – 2. Строение атома
- 6. Заполните таблицу: «Элементарные частицы атома»
- 7. Задание 2. Выполните тест. В ядре атома
- 8. Учебный Элемент – 3. Изотопы Относительная атомная
- 9. Задание 2 (индивидуальная работа)Найдите среди элементов изотопы
- 10. Задание 4 Заполнить пропуски Изотопы имеют
- 11. Проверяем 4 –е задание Выводы:Изотопы
- 12. Учебный элемент -4 «Строение электронных оболочек атомов»Задание -1. (работаем вместе) + 13+ 11+ 1+ 8+ 6
- 13. Задание -2. (индивидуальная работа)А) Выпишите схему, отражающую
- 14. Задание -3. (Работа по парам) Опросите друг
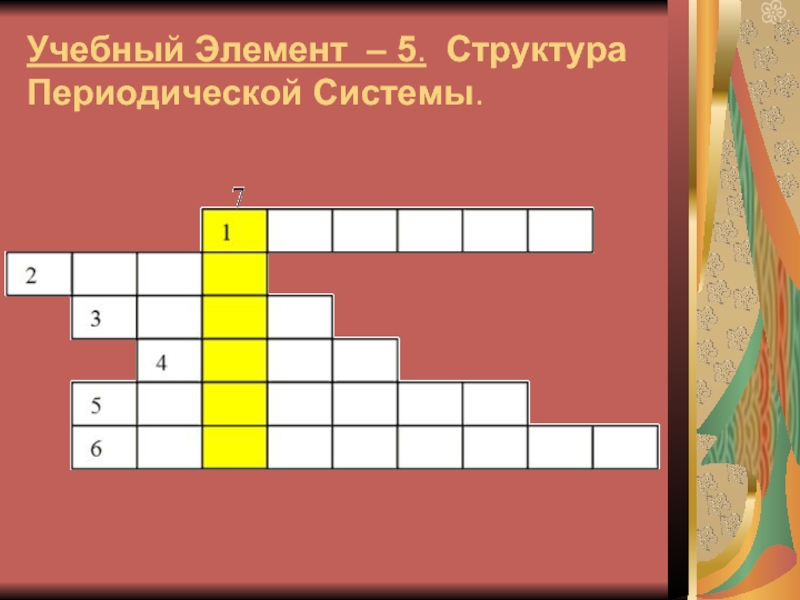
- 15. Учебный Элемент – 5. Структура Периодической Системы.
- 16. Вопросы кроссворда 1. Горизонтальный ряд элементов, расположенных
- 17. Тест 2.1.Распределение электронов по энергетическим уровням для
- 18. Учебный Элемент – 6. Изменение свойствЗадание
- 19. Задание 2 (индивидуальная работа)Вставить пропущенные слова:1.Сложная
- 20. Подведение итогов урока.
- 21. Скачать презентанцию
Цель урока: Цель урока: Обобщение знаний о строении атома, изотопах, формирование понятия «химический элемент», закрепление знаний о структуре Периодической Системы и изменении свойств элементов в периодах и группах.
Слайды и текст этой презентации
Слайд 1Модульный урок
«Атомы химических элементов.
Структура Периодической системы»
Акименко Г.В.
Борискина С.А.
Слайд 3Учебный Элемент – 1.
РАЗМИНКА «Знаки химических элементов»
Задание 1. (работаем вместе)
- Под диктовку учителя запишите в строчку
знаки химических элементовЗадание 2. (индивидуальная работа)
Выполняем задание по карточке
Слайд 4Карточка
Задание:
Выявите соответствие сведений в 1, 2 и 3 столбцах;
Допишите
недостающие цифры.
Например: 1 - 9 – 5
Слайд 5Учебный Элемент – 2.
Строение атома
Задание 1 Ответьте на
вопросы учителя и заполните таблицу:
Вопросы:
Что такое элементарные частицы атома?
Что называется
протоном, нейтроном, электроном?Что такое нуклоны?
Чему равен заряд протона, нейтрона, электрона?
Как обозначают протоны, нейтроны, электроны?
Где находятся эти частицы в атоме?
Слайд 7Задание 2. Выполните тест.
В ядре атома алюминия протонов …
а) 26; б) 13; в) 27.
Масса атома алюминия …
а)
26; б) 13; в) 27.Электронов в атоме алюминия …
а) 26; б) 13; в) 14.
Нейтронов в атоме алюминия …
а) 27; б) 13; в) 14.
Энергетических уровней в атоме алюминия … а) три; б) два; в) четыре.
Слайд 8Учебный Элемент – 3. Изотопы Относительная атомная масса.
1.Что общего в
строении этих атомов?
2.Чем данные атомы отличаются друг от друга?
3.Атомы одного
или разных химических элементов показаны на рисунке?
4. Что такое изотопы?
Слайд 9Задание 2 (индивидуальная работа)
Найдите среди элементов изотопы 17 Э
14 Э 18 Э
7 Э 16 Э8 6 8 3 8
Изотопы какого химического элемента даны?
Задание 3 (работа с таблицей, работаем все вместе)
По таблице найдите относительную атомную массу для следующих химических элементов: азот, сера, магний, углерод, алюминий, фосфор.
Слайд 10Задание 4 Заполнить пропуски
Изотопы имеют ______________ число протонов
в ядре и ____________ число нейтронов, поэтому у них разная
_____________;Химический элемент – совокупность атомов с __________________ зарядом ядра, т.е. совокупность ______________;
Химические свойства изотопов одного и того же элемента________________, т.к. они имеют ______________ заряд ядра (число протонов), _________________ число электронов, в том числе и на _________________ уровне.
Слайд 11Проверяем 4 –е задание
Выводы:
Изотопы имеют одинаковое число протонов
в ядре и разное число нейтронов, поэтому у них разная
масса;Химический элемент – совокупность атомов с одинаковым зарядом ядра, т.е совокупность изотопов;
Химические свойства изотопов одного и того же элемента одинаковые, т.к. они имеют один и тот же заряд ядра (число протонов), одинаковое число электронов, в том числе и на внешнем уровне.
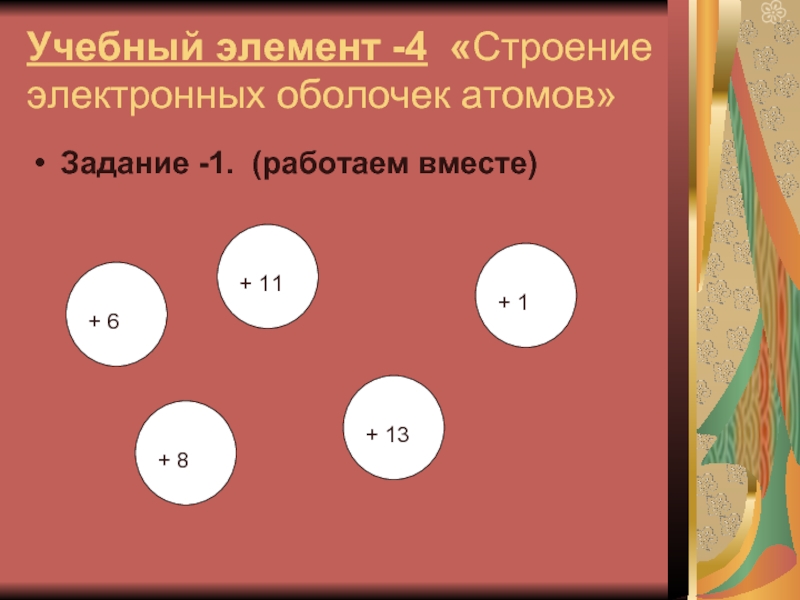
Слайд 12Учебный элемент -4 «Строение электронных оболочек атомов»
Задание -1. (работаем вместе)
+ 13
+ 11
+ 1
+ 8
+ 6
Слайд 13Задание -2. (индивидуальная работа)
А) Выпишите схему, отражающую правильное расположение электронов
в атоме элементов:
2е, 8е, 18е
3е, 8е, 4е
2е, 9е
1е 2е, 8е, 3е
3е, 8е, 2е.
Б) Соотнесите название элемента и число электронов на внешнем уровне.
Элементы: 1) азот 2) углерод 3) магний
Число электронов на внешнем уровне:
А) 2 Б) 5 В) 4
Слайд 14Задание -3. (Работа по парам)
Опросите друг друга по вопросам:
какие химические элементы относятся к
металлам, 2)неметаллам, 3)благородным газам?
Запишите по 3 примера в таблицу (знаки химических элементов).
Проверьте друг друга.
Слайд 16Вопросы кроссворда
1. Горизонтальный ряд элементов, расположенных в порядке возрастания
заряда ядер атомов.
2. Самый активный неметалл в периодической системе.
3. Элемент
под № 10 в периодической системе.4. Мельчайшая, химически неделимая частица.
5. Разновидности атомов одного химического элемента с одинаковыми зарядами ядер, но разной массой.
6. Ученый, создавший периодическую систему химических элементов.
7.------?
Слайд 17Тест 2.
1.Распределение электронов по энергетическим уровням для атома кремния :
1)2,8,2 2)2,8,4
3)2,8,3 4)2,8,52.В атоме алюминия число энергетических уровней равно:
1)2 2)3 3)4 4)1
3.Число энергетических уровней, по которым распределены электроны в атоме, равно
1)порядковому номеру элемента 2)номеру периода
3)номеру группы 4)заряду ядра
4Число полностью заполненных энергетических уровней в атоме кальция равно:
1)1 2)2 3)3 4)4
5. Элементу с атомным номером 17 соответствует электронная схема атома
1)2,7 2)2,8,3 3)2,8,7 4)2,8,8
6.Электронная схема 2,8,8,2 соответствует атому:
1)алюминия 2)магния 3)аргона 4)кальция
Слайд 18Учебный Элемент – 6.
Изменение свойств
Задание 1
Укажите знаком «→» ослабление
металлических свойств в следующих тройках элементов.
Na- Mg-
Al Li- Na-K Укажите знаком «→» усиление неметаллических свойств в следующих тройках элементов
S – P – Si F – Cl- Br
Слайд 19Задание 2 (индивидуальная работа)
Вставить пропущенные слова:
1.Сложная электронейтральная система, состоящая
из протонов, нейтронов, электронов называется …………
2.В пределах одной и той
же группы П.С.(в главной подгруппе) сверху вниз ……………. свойства усиливаются.3.В пределах одного и того же периода слева направо металлические свойства ………………, а неметаллические …………………..
4.Совокупность атомов с одинаковым зарядом ядра называется …………………………
5.В пределах одного и того же периода слева направо заряд ядра …………………, число электронов на внешнем уровне ……………………, радиус атома ……………….
Слова: (увеличивается, растет, атом , металлические, химический элемент, уменьшаются, не изменяется, усиливаются, ослабевают, уменьшается)
Слайд 20Подведение итогов урока.
Рефлексивный тест
Я повторил(ла)
весь изученный материал
Мне это пригодится в жизни
На уроке было над
чем подуматьНа все возникшие у меня вопросы я получил(ла) ответы
На уроке я поработал(ла) добросовестно
Теги