Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Белки
Содержание
- 1. Белки
- 2. Содержание белков в различных тканях человека неодинаково.
- 3. Белки или Протеины – это высокомолекулярные
- 4. В состав белков входят:
- 5. Строение белков В начале 20
- 6. Слайд 6
- 7. ■ Вторичная структура – форма полипептидной
- 8. Третичная структура – реальная трехмерная конфигурация, которую
- 9. Четвертичная структура – соединенные друг с другом макромолекулы белков образуют комплекс, (несколько цепей)
- 10. Слайд 10
- 11. Функции белков ►
- 12. Превращения белков в организме
- 13. Химические свойства белков 1. Гидролиз белков Гидролиз белков сводится к расщеплению полипептидных связей:
- 14. 2. Денатурация белков Денатурация
- 15. 3. Цветные качественные реакции белков
- 16. Значение белковОтдельные белки находят применение в народном
- 17. Скачать презентанцию
Содержание белков в различных тканях человека неодинаково. Так, мышцы содержат до 80% белка, селезенка, кровь, легкие – 72%, кожа – 63%, печень – 57%,
Слайды и текст этой презентации
Слайд 1 БЕЛКИ
Жизнь – это форма существования белка.
Слайд 2Содержание белков в различных тканях человека неодинаково.
Так, мышцы содержат до 80% белка,
селезенка,
кровь, легкие – 72%, кожа – 63%,
печень – 57%,
мозг – 15%,
жировая ткань, костная и ткань зубов – 14-28%.
Слайд 3 Белки или Протеины – это высокомолекулярные азотсодержащие органические вещества,
структурным компонентом которых являются α-аминокислоты, связанные пептидными связями.
В состав белков
входит 20 различных аминокислот.Кроме понятия «белок», в химии встречается термины «Пептид» и «Полипептид».
Слайд 4В состав белков входят:
Гемоглобин – С3032H4816O872N780S8Fe4
железо другие элементы
фосфор
сера
азот
кислород
водород
углерод
Слайд 5Строение белков
В начале 20 века Э.Фишер в
результате гидролиза белковых молекул получил смесь аминокислот и выдвинул полипептидную
теорию.H2N – CH – C – O ОН + Н – N – CH – COOH →
│ │ │
CH3 H CH3
аланин аланин
H2N – CH – C – N – CH – COOH + Н2О
│ ║ ║ │
CH3 О Н CH3
дипептид
Слайд 6 Структура
белков
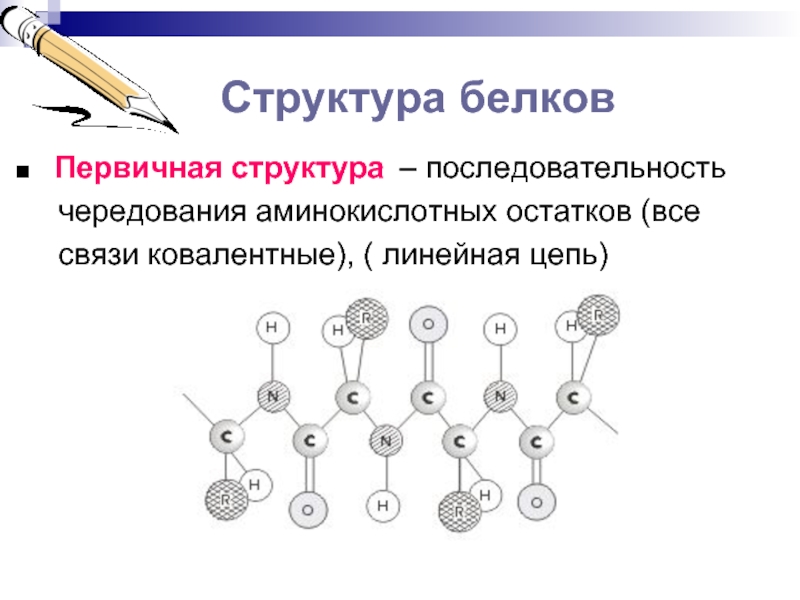
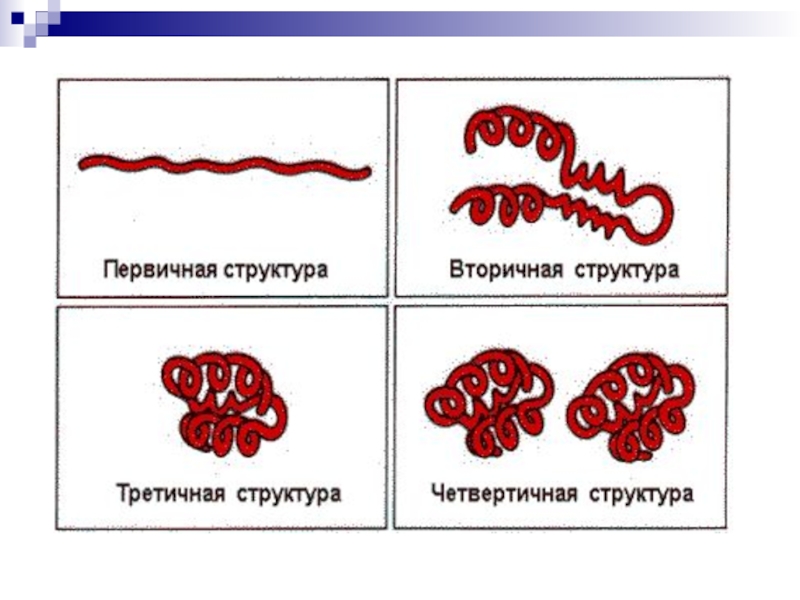
■ Первичная структура – последовательность
чередования аминокислотных
остатков (всесвязи ковалентные), ( линейная цепь)
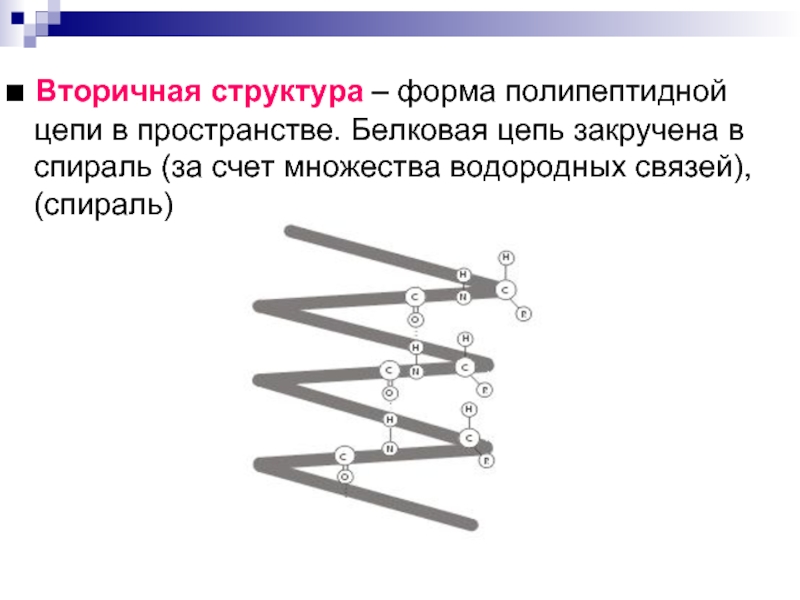
Слайд 7■ Вторичная структура – форма полипептидной цепи в пространстве.
Белковая цепь закручена в спираль (за счет множества водородных связей),
(спираль)Слайд 8Третичная структура – реальная трехмерная конфигурация, которую принимает в пространстве
закрученная спираль (за счет гидрофобных связей), у некоторых белков –
S–S-связи (бисульфидные связи), (клубок)Слайд 9Четвертичная структура – соединенные друг с другом макромолекулы белков образуют
комплекс, (несколько цепей)
Слайд 11 Функции белков
► Строительная –
белки участвуют в образовании оболочки клетки, органоидов и мембран клетки.
Из белков построены кровеносные сосуды, сухожилия, волосы.► Каталитическая – все клеточные катализаторы –
белки (активные центры фермента).
► Двигательная – сократительные белки вызывают всякое
движение.
► Транспортная – белок крови гемоглобин присоединяет кислород и разносит его по всем тканям.
► Защитная – выработка белковых тел и антител для обезвреживания чужеродных веществ.
► Энергетическая – 1 г белка эквивалентен 17,6 кДж.
► Рецепторная – реакция на внешний раздражитель.
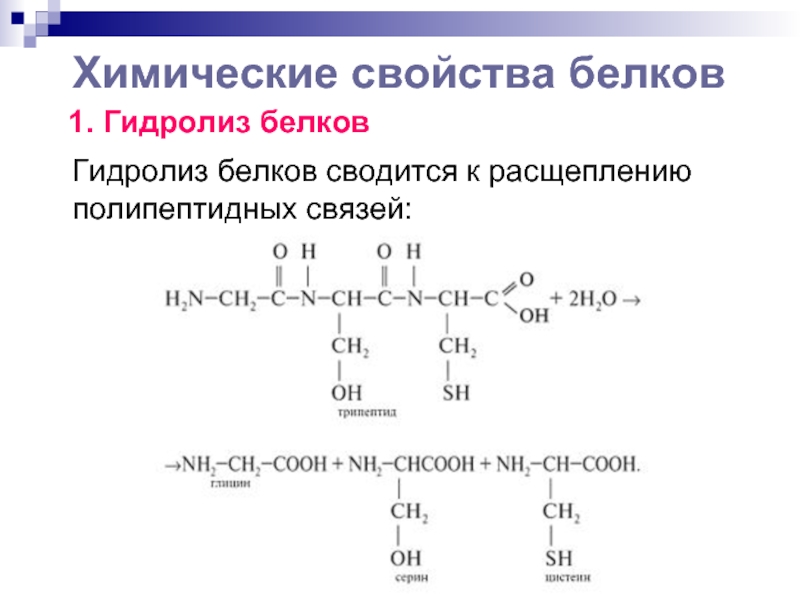
Слайд 13Химические свойства белков
1. Гидролиз белков
Гидролиз белков
сводится к расщеплению полипептидных связей:
Слайд 14 2. Денатурация белков
Денатурация – нарушение природной
структуры белка под действием нагревания и химических реагентов.
а) Высокая или низкая температура;б) механическое воздействие;
в) облучение;
г) яды;
д) действие спирта;
б) действие солей тяжелых металлов (Pb, Hg и др..
Слайд 153. Цветные качественные реакции белков
а) Биуретовая реакция
(NaOH + Cu(OH)2);
б) ксантопротеиновая реакция(HNO3 конц.);
в) взаимодействие белка с ацетатом свинца при нагревании.Слайд 16Значение белков
Отдельные белки находят применение в народном хозяйстве, например белки
шерсти, шелка, кожи и рогов животных.
Выяснение структуры белков, их многообразных
функций в организме позволяет понять механизм наследственности, что в свою очередь, имеет большое значение для выведения высокопродуктивных пород животных и сортов растений.Изучение белков важно и для выяснения природы заболеваний, наблюдаемых у человека и животных
Теги