Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Бериллий, магний и щелочноземельные металлы 9 класс
Содержание
- 1. Бериллий, магний и щелочноземельные металлы 9 класс
- 2. Общая характеристика элементов главной подгруппы
- 3. Ве - амфотерный металл, Mg – металл, Сa, Sr,Ba - щёлочноземельные металлы Ra –радиоактивный элемент
- 4. Общая характеристика элементов главной подгруппы II группыОдинаковое
- 5. Be – светло-серый, твердый, хрупкийCa – твердый, пластичныйMg – относительно мягкий, пластичный, ковкийSr – ковкий
- 6. Химические свойства элементов II группы главной подгруппы
- 7. Химические свойства элементов II группы главной подгруппы
- 8. Химические свойства оксидовBeO – амфотерный оксид MgOCaOSrO
- 9. Взаимодействие оксида кальция с водой ( гашение извести)
- 10. Химические свойства гидроксидовВе(ОН)2 – амфотерный гидроксидMg(OH)2 –
- 11. Слайд 11
- 12. Слайд 12
- 13. Напишите уравнения реакций с помощью которых можно
- 14. Домашнее задание §12 упр 5
- 15. Скачать презентанцию
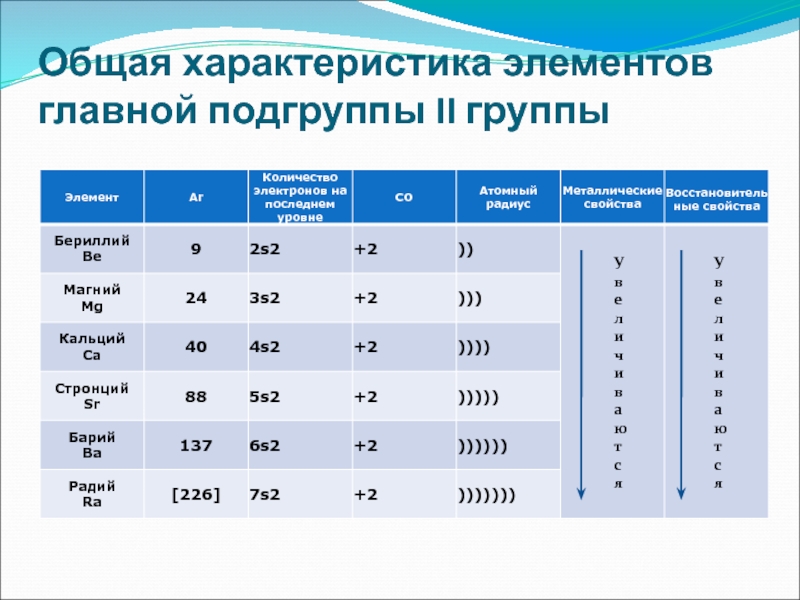
Общая характеристика элементов главной подгруппы II группы У в е л и ч и в а ю т с яУ в е л и ч и в а ю
Слайды и текст этой презентации
Слайд 2
Общая характеристика элементов главной подгруппы II группы
У в е л
и ч и в а ю т с я
е л и ч и в а ю т с яСлайд 3
Ве - амфотерный металл,
Mg – металл,
Сa, Sr,Ba -
щёлочноземельные металлы
Ra –радиоактивный элемент
Слайд 4Общая характеристика элементов главной подгруппы II группы
Одинаковое строение внешнего электронного
слоя
Элементы проявляют СО +2
Атомы элементов являются сильными восстановителями, т.к
содержат 2 электрона на внешнем энергетическом уровне, которые отдают при взаимодействиями с другими элементами.С увеличением № элементов увеличивается атомный радиус, увеличивается число электронных слоев, следовательно возрастает легкость отдачи электронов. Восстановительные свойства увеличиваются в группе сверху вниз.