Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Дисперсные системы и растворы
Содержание
- 1. Дисперсные системы и растворы
- 2. 1. Понятие дисперсной системыа) Примеры дисперсных системб)
- 3. Дисперсными называют гетерогенные системы, в которых одно
- 4. Примеры дисперсных систем
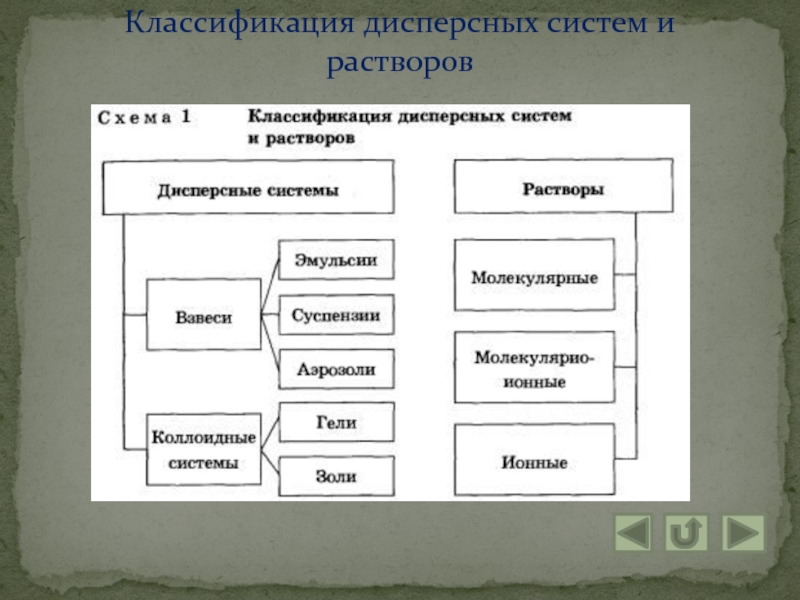
- 5. Классификация дисперсных систем и растворов
- 6. Взвеси – это дисперсные системы, в которых
- 7. Коллоидные системы – это такие дисперсные системы,
- 8. Раствором называют гомогенную систему, состоящую из двух
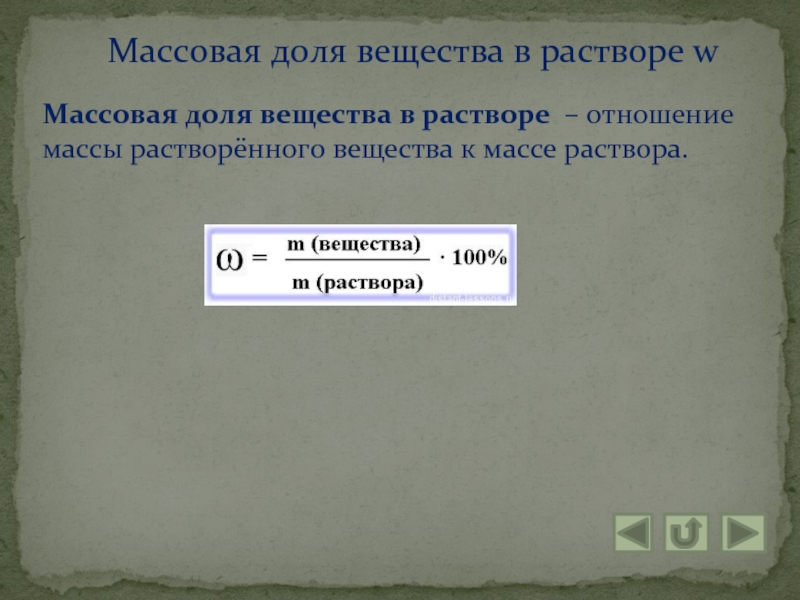
- 9. Массовая доля вещества в растворе – отношение
- 10. Молярная концентрация – отношение количества вещества растворённого вещества к объёму раствора.Молярная концентрация С
- 11. Моляльная концентрация – отношение количества растворённого вещества к массе растворителя. Моляльная концентрация
- 12. Раствор – гомогенная (однородная) система, состоящая из
- 13. Источники информацииhttps://ru.wikipedia.orgХИМИЯ. 11 класс: учеб. для общеобразоват. учреждений/ О. С. Габриелян, Г. Г. Лысова.-М.: Дрофа, 2013
- 14. Скачать презентанцию
1. Понятие дисперсной системыа) Примеры дисперсных системб) Классификация дисперсных систем и растворов2. Понятие взвеси3. Понятие коллоидной системы4. Понятие раствора5. Массовая доля вещества в растворе w6. Молярная концентрация7. Моляльная концентрация 8. Группы
Слайды и текст этой презентации
Слайд 1Дисперсные системы и растворы
МБОУ Белоберезковская СОШ № 1
п.г.т. Белая Берёзка,
Трубчевский район, Брянская область
Слайд 21. Понятие дисперсной системы
а) Примеры дисперсных систем
б) Классификация дисперсных систем
и растворов
2. Понятие взвеси
3. Понятие коллоидной системы
4. Понятие раствора
5. Массовая
доля вещества в растворе w6. Молярная концентрация
7. Моляльная концентрация
8. Группы растворов
Оглавление
Слайд 3Дисперсными называют гетерогенные системы, в которых одно вещество в виде
очень мелких частиц равномерно распределено в объёме другого.
То вещество, которое
присутствует в меньшем количестве и распределено в объёме другого, называют дисперсной фазой.Вещество, присутствующее в большем количестве, в объёме которого распределена дисперсная фаза, называют дисперсионной средой.
Понятие дисперсной системы
Слайд 6Взвеси – это дисперсные системы, в которых размер частиц фазы
более 100 нм.
1. Эмульсии (и среда, и фаза – нерастворимые
друг в друге жидкости). Примеры: молоко, лимфа, водоэмульсионные краски.2. Суспензии (среда – жидкость, а фаза – нерастворимое в ней твёрдое вещество). Примеры: “известковое молоко”, взвешенный в воде речной и морской ил, живая взвесь микроскопических живых организмов в морской воде.
3. Аэрозоли – взвеси в газе. Мелких частиц жидкостей или твёрдых веществ. Различают пыли, дымы, туманы.
Понятие взвеси
Слайд 7Коллоидные системы – это такие дисперсные системы, в которых размер
частиц фазы от 100 до 1 нм.
1. Коллоидные растворы, или
золи: большинство жидкостей живой клетки (цитоплазма, ядерный сок – кариоплазма и т. д.) и живого организма в целом (кровь, лимфа, тканевая жидкость и т. д.).
Эффект Тиндаля: раствор отличают по образующейся “светящейся дорожке” – конусу при пропускании через них луча света.
Коагуляция – явление слипания коллоидных частиц и выпадения их в осадок – наблюдается при нейтрализации зарядов этих частиц, когда в коллоидный раствор добавляют электролит.
2. Гели или студни: представляют собой студенистые осадки, образующиеся при коагуляции золей.
Понятие коллоидной системы
Слайд 8Раствором называют гомогенную систему, состоящую из двух и более веществ.
Растворы
называют истинными, если требуется подчеркнуть их отличие от коллоидных растворов.
Растворителем
считают вещество, агрегатное состояние которого не изменяется при образовании раствора.Понятие раствора
Слайд 9Массовая доля вещества в растворе – отношение массы растворённого вещества
к массе раствора.
Массовая доля вещества в растворе w
Слайд 10Молярная концентрация – отношение количества вещества растворённого вещества к объёму
раствора.
Молярная концентрация С
Слайд 11Моляльная концентрация – отношение количества растворённого вещества к массе растворителя.
Моляльная концентрация
Слайд 12Раствор – гомогенная (однородная) система, состоящая из частиц растворённого вещества,
растворителя и продуктов их взаимодействия.
1. Молекулярные – это водные растворы
неэлектролитов – органических веществ.2. Молекулярно – ионные – это растворы слабых электролитов.
3. Ионные – это растворы сильных электролитов.
Группы растворов
Слайд 13Источники информации
https://ru.wikipedia.org
ХИМИЯ. 11 класс: учеб. для общеобразоват. учреждений/ О. С.
Габриелян, Г. Г. Лысова.-М.: Дрофа, 2013
Теги