Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электролиз
Содержание
- 1. Электролиз
- 2. Как наша прожила б планета?Как люди жили
- 3. Проблемный вопрос. Что произойдёт, если
- 4. Электролиз – дословно: «лизис» – разложение, «электро»
- 5. Электролиз – это окислительно- -восстановительный процесс, протекающий
- 6. ЭлектролизПланЭлектролиз расплава.Электролиз раствора.Сущность электролиза.Применение. Выводы.
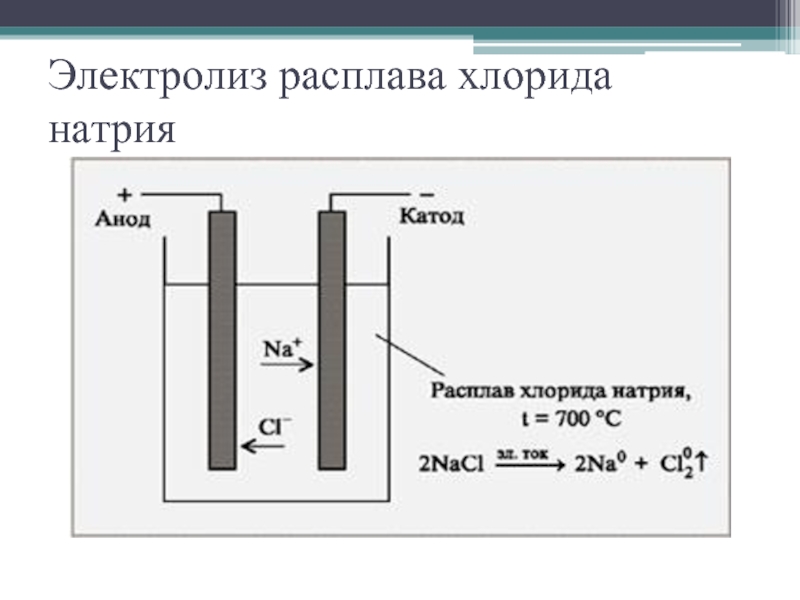
- 7. Электролиз расплава хлорида натрия
- 8. Электролиз является окислительно –
- 9. Для определения результатов электролиза водных растворов существуют
- 10. Процесс на аноде зависит от материала анода
- 11. Электрическая энергияХимическая энергияЭлектролиз
- 12. Работа с учебником (стр. 109-110)Проанализируйте процесс электролиза
- 13. Сущность электролиза состоит в том, что за
- 14. Внимательно наблюдайте за результатами электролиза сульфата меди.1.
- 15. Проверь себя!
- 16. Применение электролизаКатодные процессыАнодные процессыВ гальваностегии
- 17. Гальванопластика политехнического государственного музея«Георгий Победоносец»Барельеф «Портрет Б.С.Якоби»
- 18. Применение электролизаПроцесс очищения предметов электролизомРезультат процесса
- 19. Установите правильную последовательность.окислительно-восстановительные реакцииесли через раствор или
- 20. Ответьте на вопросы.1. При электролизе к аноду
- 21. Рефлексия. Если вы согласны с утверждениями,
- 22. Домашнее заданиеЗаписи в тетради.Учебник «Химия – 10», стр. 107 - 111 (читать). Выполнить упр. 7, 21Т(письменно).
- 23. Спасибо за внимание!Использованные ресурсы:http://www.reviewdetector.ru/index.php?act=Print&client=wordr&f=6&t=4456 http://energobelarus.by/index.php?section=news&new http://sc.uriit.ru/catalog/rubr/8f5d7210-86a6-11da-a72b-0800200c9a66/21364/ rus.polymus.ru›index.php…himikatus.ru›art/nvideo_neorg/elektrolzq.php
- 24. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Тема «Электролиз»
МУНИЦИПАЛЬНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «КУЛУНДИНСКАЯ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №1» ,
учитель химии высшей квалификационной категории Бабичева Валентина Николаевна.
Слайд 2Как наша прожила б планета?
Как люди жили бы на ней
Без
теплоты, магнита, света
И электрических лучей?
Адам Мицкевич
Эпиграф урока
Слайд 3
Проблемный вопрос.
Что произойдёт, если в раствор или
расплав электролита опустить электроды, которые присоединены к источнику электрического тока?
Слайд 4Электролиз – дословно:
«лизис» – разложение,
«электро» – электрическим током.
Цель урока:
изучить сущность и применение процесса электролиза.
Слайд 5Электролиз – это окислительно- -восстановительный процесс, протекающий на электродах при
прохождении постоянного электрического тока через расплав или раствор электролита.
Слайд 6Электролиз
План
Электролиз расплава.
Электролиз раствора.
Сущность электролиза.
Применение.
Выводы.
Слайд 8Электролиз является
окислительно –
- восстановительным процессом:
на катоде всегда идёт процесс восстановления,
на аноде всегда идёт процесс окисления.
Слайд 9Для определения результатов электролиза водных растворов существуют следующие правила:
Процесс
на катоде не зависит от материала катода, а зависит от
положения металла в электрохимическом ряду напряжений.( работа с инструкцией)
Слайд 10Процесс на аноде зависит от материала анода и от природы
аниона.
Если анод нерастворимый, т.е. инертный (уголь, графит, платина, золото), то
результаты зависят от анионов кислотных остатков.Если анод растворимый ( железо, медь, цинк, серебро и все металлы, которые окисляются в процессе электролиза), то независимо от природы аниона всегда идёт окисление металла анода.
Слайд 11Электрическая энергия
Химическая энергия
Электролиз
Раствор
NaClКатод(-) <- Na+ + Cl- -> Анод(+)
H2О
Расплав
NaCl
Катод(-) <- Na+ + Cl- -> Анод(+)
Na+ + e => Na0
2Cl- => Cl20 + 2e
Восстановление Окисление
2H2 О + 2e => H2 +
2Na+
2OH-
2 Cl- => Cl2 + 2e
Восстановление Окисление
Основные положения электродных процессов
1. На катоде:
Li, K+, Ca2+, Na+, Mg2+, Al3+
Zn2+, Cr3+, Fe2+, Ni2+, Sn2+, Pb2+
Cu2+, Ag+, Hg2+, Pt2+, Au3+
H+
Не восстанавливаются, выделяется H2
Возможно выделение Me и H2
Восстанавливаются, выделяется Me
2. Анодные процессы
а) Растворимый анод (Cu, Ag, Ni, Cd) подвергается окислению Me =>Men+ +ne
б) На нерастворимом аноде (графит, платина) обычно окисляются анионы S -, J-, Br-, Cl-, OH- и молекулы H20:
2J- =>J20 + 2e; 4OH- =>O2 +2H2O +4e; 2H2O =>O2 +4H+ +4e
Слайд 12Работа с учебником (стр. 109-110)
Проанализируйте процесс электролиза водного раствора сульфата
натрия.
Используя инструкции, запишите катодный и анодный процессы.
Почему данный процесс
сводится к электролизу воды?Слайд 13Сущность электролиза состоит в том, что за счёт электрической энергии
осуществляется химическая реакция, которая не может протекать самопроизвольно.
Слайд 14Внимательно наблюдайте за результатами электролиза сульфата меди.
1. Запишите катодный и
анодный процессы, суммарное уравнение процесса.
2. Объясните сходство и различие
процессов электролиза сульфата натрия и сульфата меди.Слайд 15Проверь себя!
CuSO4
→ Cu2+ + SO42-
H2O Катод (-) Cu2+ SO42- Анод (+)
Cu2+ + 2e = Cu0 2H2O – 4e = O2↑ + 4H+
восстановление окисление
Суммарное уравнение:
2CuSO4 + 2H2O = 2Cu0 + O2↑ + 2H2SO4
Слайд 16Применение электролиза
Катодные процессы
Анодные процессы
В гальваностегии
( никелирование, серебрение).
В гальванопластике (изготовление копий).
Получение чистых металлов ( медь, алюминий).
Электрометаллургия расплавов. Очистка металлов, полученных при выплавке из руды, от посторонних примесей.
Промышленный способ получения кислорода и водорода.
Оксидирование алюминия.
Электрополировка поверхностей (электроискровая обработка, электрозаточка).
Электрогравировка.
Слайд 17Гальванопластика политехнического государственного музея
«Георгий Победоносец»
Барельеф
«Портрет Б.С.Якоби»
Слайд 19Установите правильную последовательность.
окислительно-восстановительные реакции
если через раствор или расплав
Электролиз – это
протекающие
на электродах
пропускают
электролита
постоянный ток
3, 1, 4, 2, 6, 5, 7
Слайд 20Ответьте на вопросы.
1. При электролизе к аноду движутся:
а) катионы
б) анионы в) все ионы г) электроны
2. При электролизе расплава
хлорида меди на катоде выделится: а) медь, б) водород в) хлор г) кислород3. На аноде выделится кислород при электролизе растворов: а) CuBr2 б) NaNO3 в) FeCl3
Слайд 21 Рефлексия. Если вы согласны с утверждениями, поставьте плюс, а если
нет, то минус.
1. Я узнал много нового и интересного.
2.
На все возникшие в ходе урока вопросы я получил ответы.3. Мне было интересно и комфортно.
4. Считаю, что работал добросовестно и достиг цели урока.