Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Гидролиз солей
Содержание
- 1. Гидролиз солей
- 2. Содержание*Аринова Н.И.Источники информацииW
- 3. Эксперимент*Аринова Н.И.Изменение окраски лакмусав растворах солей NaClК2CO3ZnSO4
- 4. Теоретические основы*Аринова Н.И.Вода – слабый электролитН2О ⇄
- 5. Теоретические основы*Аринова Н.И.Диссоциация солей+-+-+-+-+- +-
- 6. Теоретические основы*Аринова Н.И.ОпределениеГидролизот греческих слов«hydro» - вода«lysis»-
- 7. Типы солей*Аринова Н.И.Любую соль можно представить как
- 8. Соль образована сильным основанием и сильной кислотой
- 9. Гидролиз по аниону*Аринова Н.И.К2CO3 KOH – сильное
- 10. 6. Написать молекулярное уравнение гидролиза Гидролиз по
- 11. По катиону и аниону*Аринова Н.И.1. Определить состав
- 12. По таблице растворимости можноопределить соли, которые«в водной
- 13. Соли, образованныесильным основанием и сильной кислотой4. Определить
- 14. 5. Если в пробирку с раствором хлорида
- 15. Источники информации*Аринова Н.И.Whttp://hydorlysis.narod.ru/pages/teoria.htmhttp://ru.wikipedia.org/wiki/http://ru.wikipedia.org/wiki/Гидролиз
- 16. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Гидролиз
солей
Выполнила:
учитель химии высшей
квалификационной категории
Аринова Нелли Ивановна
МКОУ СОШ № 2 с
УИОП п.Восточный
Слайд 3Эксперимент
*
Аринова Н.И.
Изменение окраски лакмуса
в растворах солей
NaCl
К2CO3
ZnSO4
Что наблюдаете?
В чем причина изменения
окраски индикатора?
Слайд 4Теоретические основы
*
Аринова Н.И.
Вода – слабый электролит
Н2О ⇄ Н+ + ОН-
[Н+
] = [ОН- ] – среда нейтральная, рН = 7
[Н+
] > [ОН- ] – среда кислая, рН < 7[Н+ ] < [ОН- ] – среда щелочная, рН > 7
Почему в водных растворах солей
появляются избытки свободных
ионов Н+ или ОН- ?
Слайд 5
Теоретические основы
*
Аринова Н.И.
Диссоциация солей
+
-
+
-
+
-
+
-
+
- +
- +
- +
-
+
- +
- +
- +
- +
Ориентация
«ионы – диполи воды»Ион – дипольное взаимодействие,
образование гидратированных ионов
+
- +
- +
- +
- +
- +
- +
-
- +
- +
- +
- +
- +
- +
В гидратированных ионах возможно взаимодействие ионов соли
со своей гидратной оболочкой
Слайд 6Теоретические основы
*
Аринова Н.И.
Определение
Гидро
лиз
от греческих слов
«hydro» - вода
«lysis»- разложение
Гидролиз – «разложение
водой»
Гидролиз солей – это взаимодействие ионов соли с водой с
образованием малодиссоциирующего вещества (слабого электролита)
Слайд 7
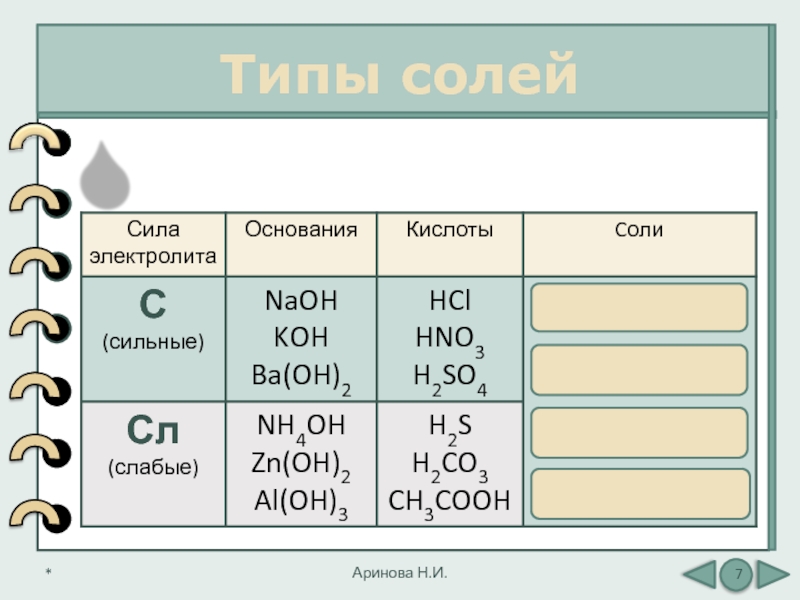
Типы солей
*
Аринова Н.И.
Любую соль можно представить
как продукт взаимодействия основания
с кислотой
Соль = основание + кислота
Na
Cl
K
2CO3
Zn
SO4
CH3COO
NH4
С + С
С + Сл
Сл
+ ССл + Сл
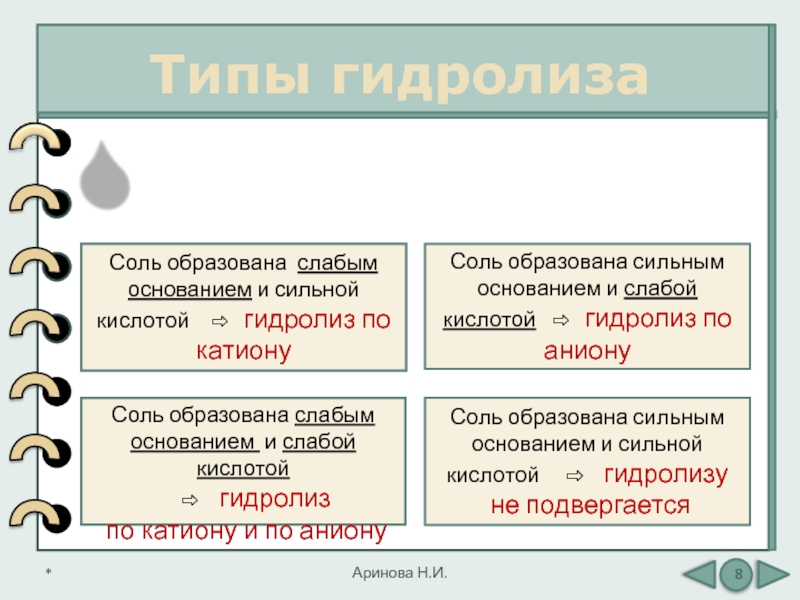
Слайд 8Соль образована сильным основанием и сильной кислотой ⇨
гидролизу
не подвергается
Соль образована сильным основанием и слабой кислотой
⇨ гидролиз по анионуСоль образована слабым основанием и сильной кислотой ⇨ гидролиз по катиону
Типы гидролиза
*
Аринова Н.И.
Соль образована слабым основанием и слабой кислотой
⇨ гидролиз
по катиону и по аниону
Тип гидролиза зависит от наличия
в составе соли «слабого» иона
Слайд 9
Гидролиз по аниону
*
Аринова Н.И.
К2CO3
KOH – сильное основание
H2CO3 – слабая
кислота
К2CO3 = 2К+ + CО32-
Н2О ⇄ ОН- + Н+
Слабый
электролит ⇨ подвергается
гидролизу по аниону
CО32- + Н+ОН- ⇄ НCО3- + ОН- - 1 ступень
[Н+ ] < [ОН- ] – среда щелочная, рН > 7
лакмус синий
К2CО3 + Н2О ⇄ КНCО3 + КОН
6. Написать молекулярное уравнение гидролиза
5. Определить среду раствора
4. Написать сокращенное ионное уравнение между слабым ионом и водой
3. Определить возможность образования слабого электролита и тип гидролиза
2. Написать уравнения диссоциации
1. Определить состав соли
Соли, образованные
сильным основанием и слабой кислотой
ОН-
Слайд 106. Написать молекулярное уравнение гидролиза
Гидролиз по катиону
*
Аринова Н.И.
[Н+ ]
> [ОН- ] – среда кислая, рН < 7
лакмус красный ZnSO4
Zn(OH)2 – слабое основание
H2SO4 – сильная кислота
ZnSO4 = Zn2+ + SO42-
Н2О ⇄ ОН- + Н+
Слабый электролит ⇨
подвергается
гидролизу по катиону
Zn2+ + Н+ОН- ⇄ ZnOH+ + Н+ - 1 ступень
5. Определить среду раствора
2ZnSO4 + 2Н2О ⇄ (ZnOH)2SO4 + H2SO4
4. Написать сокращенное ионное уравнение между слабым ионом и водой
3. Определить возможность образования слабого электролита и тип гидролиза
2. Написать уравнения диссоциации
1. Определить состав соли
Соли, образованные
слабым основанием и сильной кислотой
Н+
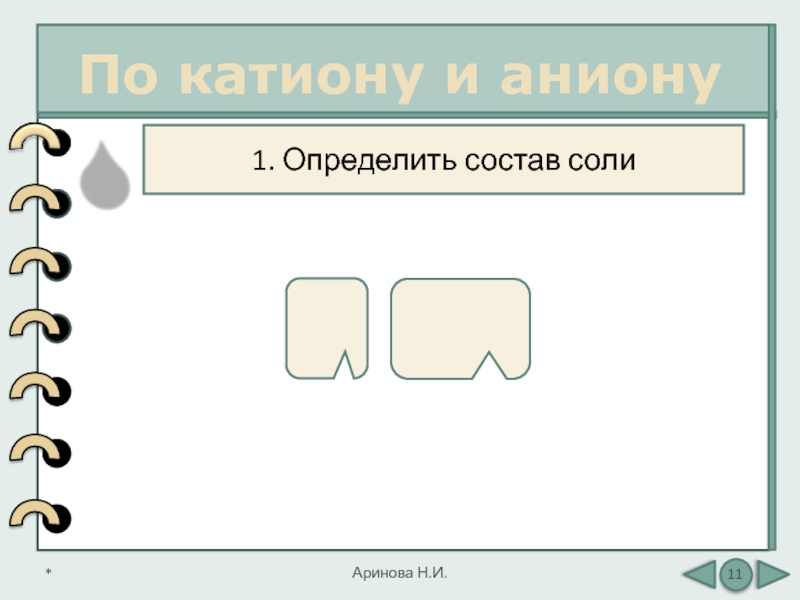
Слайд 11
По катиону и аниону
*
Аринова Н.И.
1. Определить состав соли
CH3COONH4
NH4OH –
слабое основание
CH3COOH – слабая кислота
CH3COONН4 = NН4+ + CH3COO -
Н2О ⇄ ОН- + Н+ Слабые электролиты ⇨
подвергается
гидролизу по катиону
и по аниону
CH3COO -+NН4+ +Н+ОН- ⇄ CH3COOH + NH4OH
5. Определить среду раствора, сравнив значения Кдис (кислоты) и Кдис (основания)
Кдис(CH3COOH) =1,75 · 10-5 < Кдис(NH4OH)= 6,3 · 10-5
⇨ [Н+ ] < [ОН- ] – среда слабощелочная, рН > 7
лакмус синий
4. Написать сокращенное ионное уравнение между слабыми ионами и водой
3. Определить возможность образования слабого электролита и тип гидролиза
2. Написать уравнения диссоциации
Соли, образованные
слабым основанием и слабой кислотой
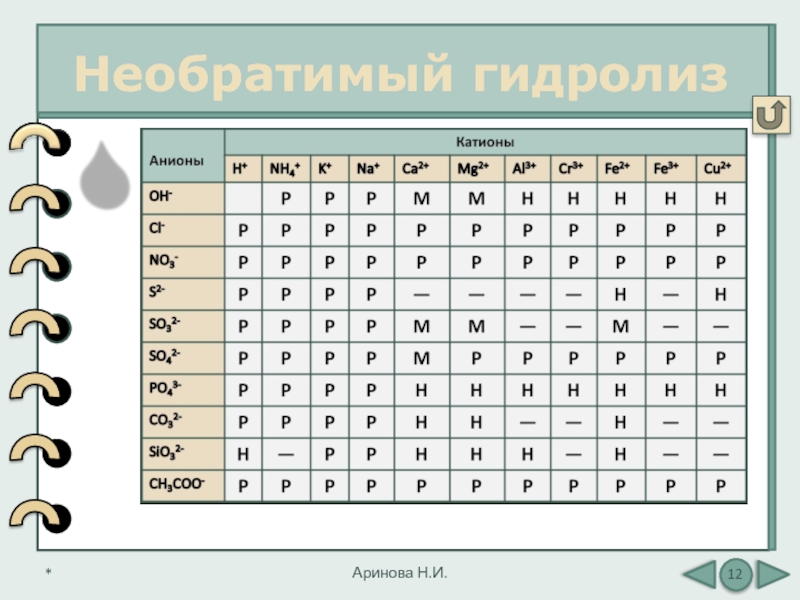
Слайд 12По таблице растворимости можно
определить соли, которые
«в водной среде разлагаются», т.е.
подвергаются
необратимому
гидролизу
Необратимый гидролиз
*
Аринова Н.И.
Al2S3 + 6H2O = 2Al(OH)3 ↓ +
3H2S↑Слайд 13Соли, образованные
сильным основанием и сильной кислотой
4. Определить среду раствора
3. Определить
возможность образования слабого электролита и тип гидролиза
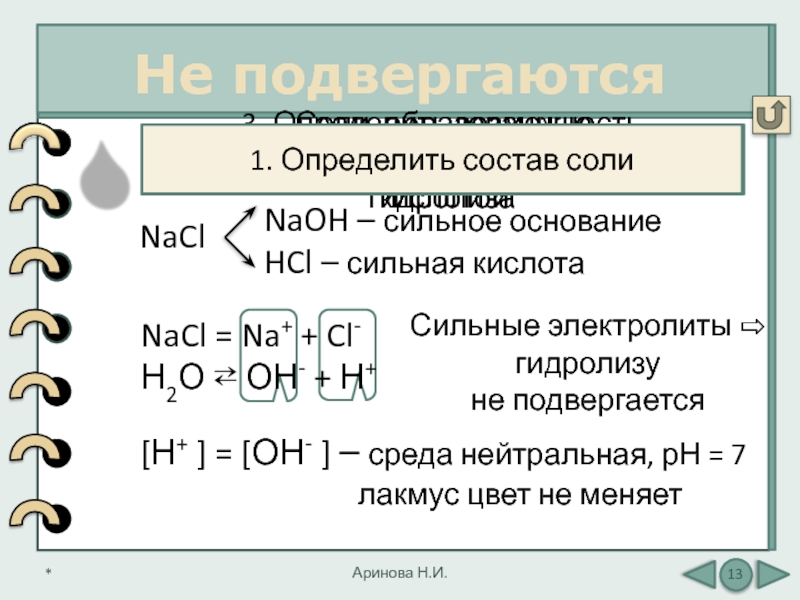
Не подвергаются
*
Аринова Н.И.
2. Написать
уравнения диссоциации NaCl
NaOH – сильное основание
HCl – сильная кислота
1. Определить состав соли
NaCl = Na+ + Cl-
Н2О ⇄ ОН- + Н+
Сильные электролиты ⇨
гидролизу
не подвергается
[Н+ ] = [ОН- ] – среда нейтральная, рН = 7
лакмус цвет не меняет
Соли, образованные
сильным основанием и сильной кислотой
Слайд 145. Если в пробирку с раствором хлорида цинка поместить цинк
- выделится газ:
4. Необратимому гидролизу подвергается соль:
3. Как изменится окраска
лакмуса в растворе нитрата цинка? 1. 2. 3. 4. 5.
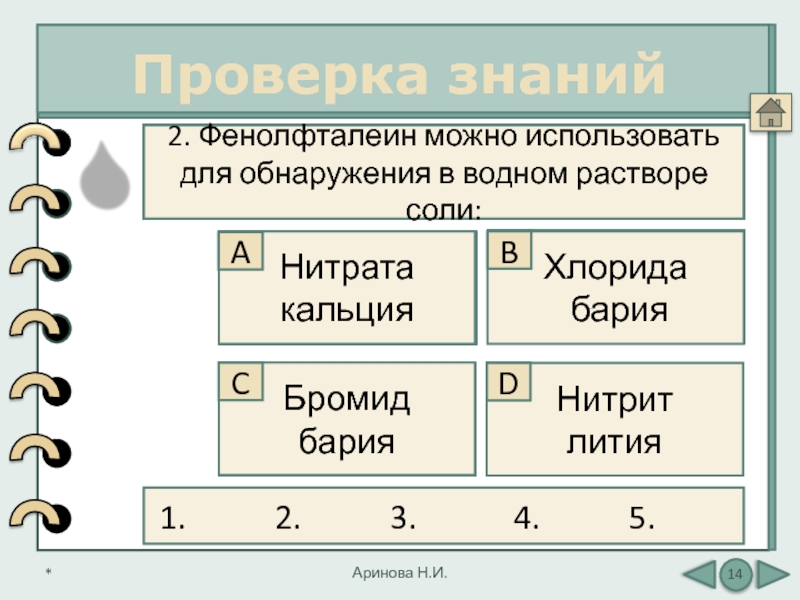
2. Фенолфталеин можно использовать для обнаружения в водном растворе соли:
Проверка знаний
*
Аринова Н.И.
1. В составе какой соли нет «слабого» иона?
Вопрос 1
Вопрос 2
Вопрос 3
Вопрос 4
Вопрос 5
Последовательно ответьте на вопросы 1 - 5



![Гидролиз солей Теоретические основы*Аринова Н.И.Вода – слабый электролитН2О ⇄ Н+ + ОН-[Н+ ] Теоретические основы*Аринова Н.И.Вода – слабый электролитН2О ⇄ Н+ + ОН-[Н+ ] = [ОН- ] – среда нейтральная,](/img/thumbs/b29873b471626ae6618320e3f8ff26cd-800x.jpg)



![Гидролиз солей 6. Написать молекулярное уравнение гидролиза Гидролиз по катиону*Аринова Н.И.[Н+ ] > 6. Написать молекулярное уравнение гидролиза Гидролиз по катиону*Аринова Н.И.[Н+ ] > [ОН- ] – среда кислая, рН](/img/thumbs/9f0efca148080840a522c875aae9516a-800x.jpg)