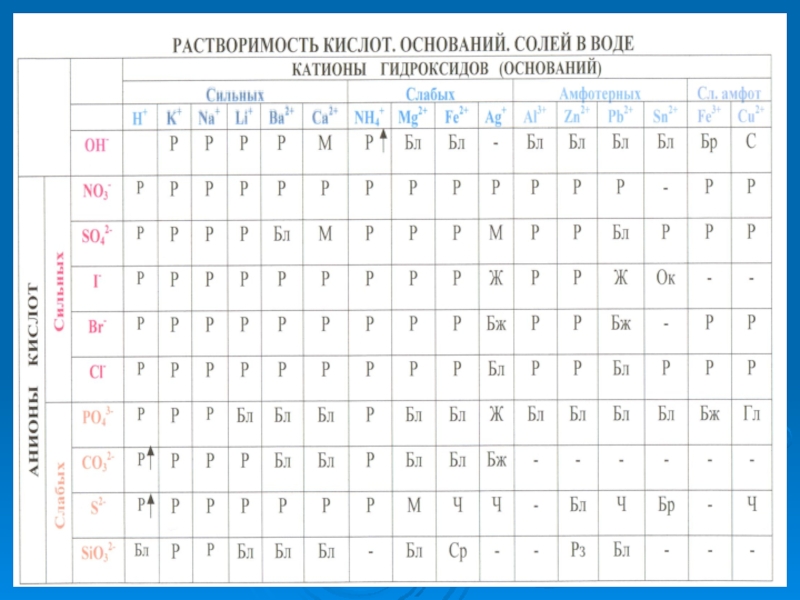
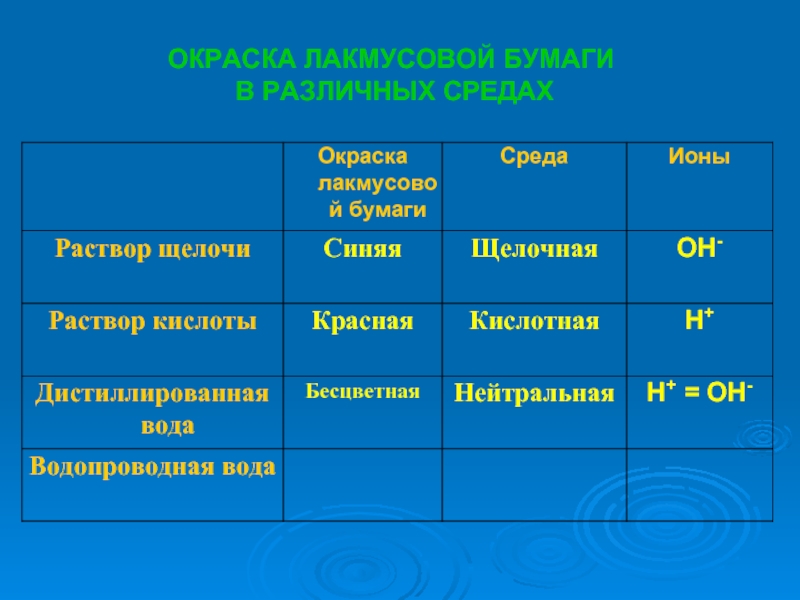
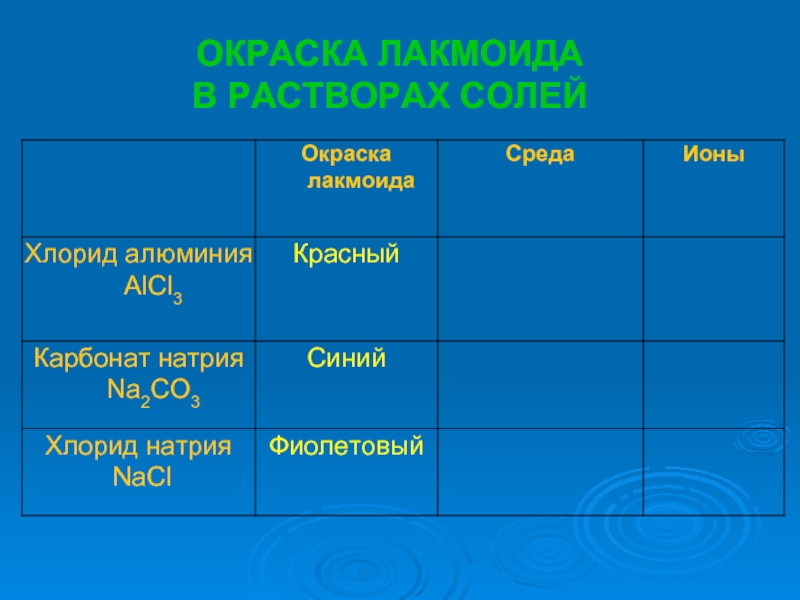
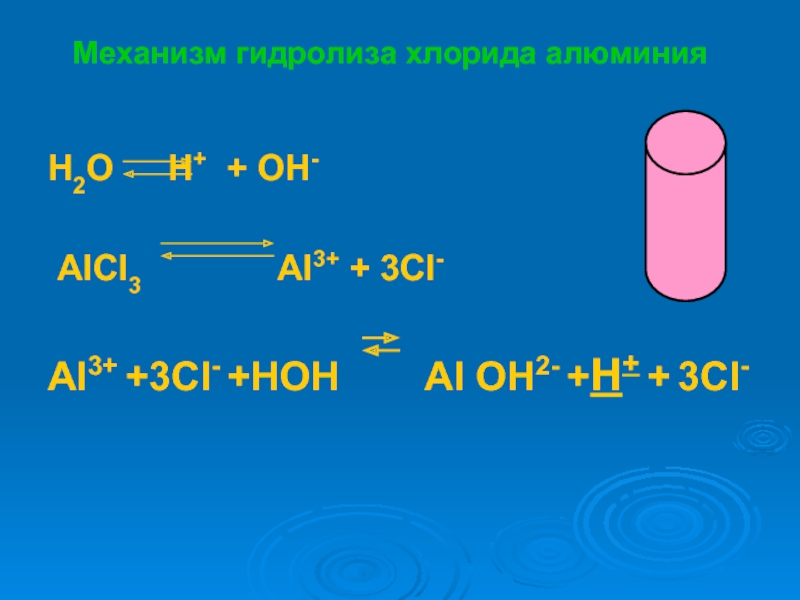
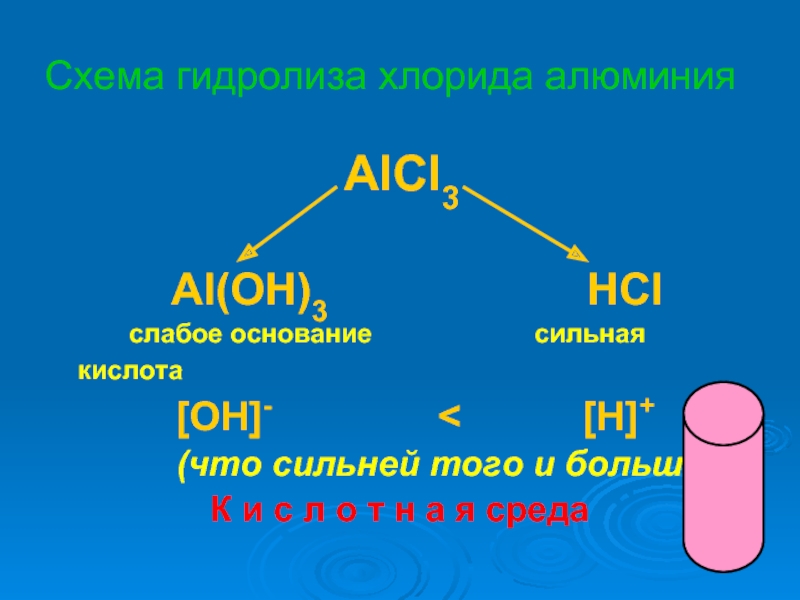
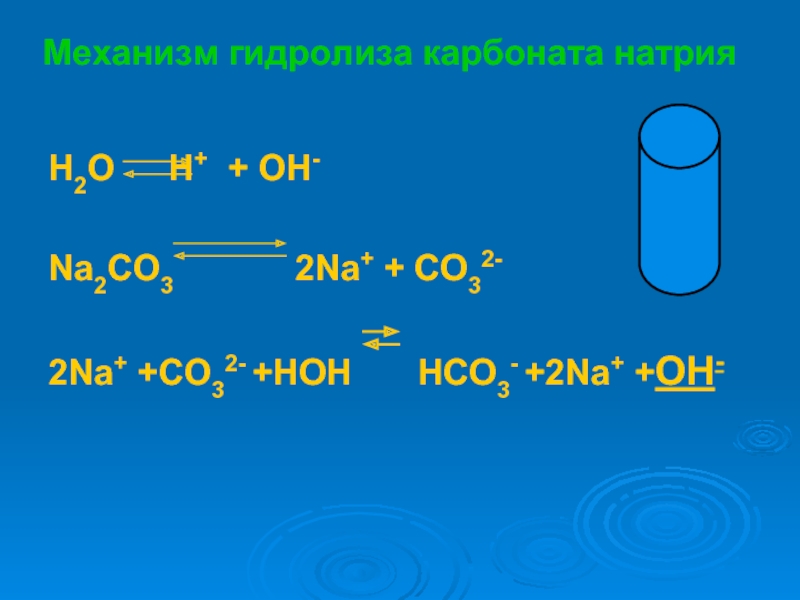
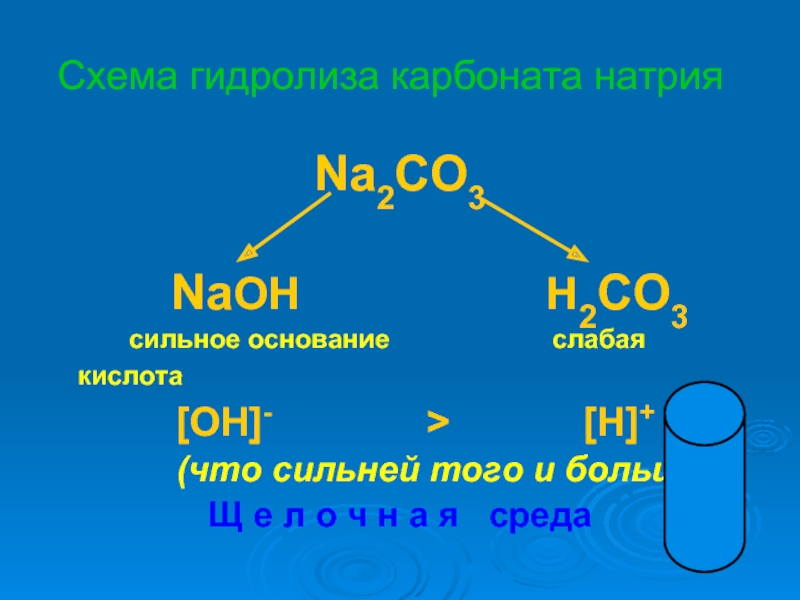
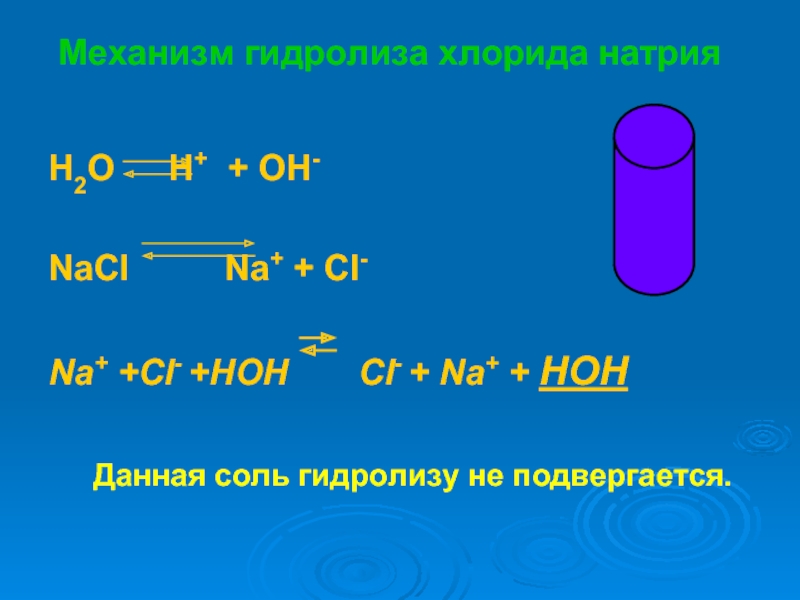
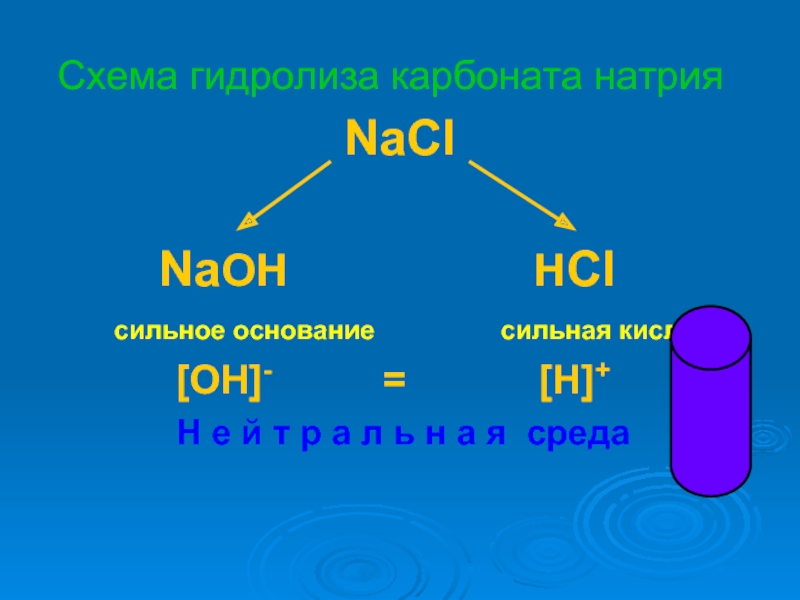
растворах.
Задачи :
сформулировать определение понятия «гидролиз»
научиться объяснять химические процессы, протекающие в водных растворах солей
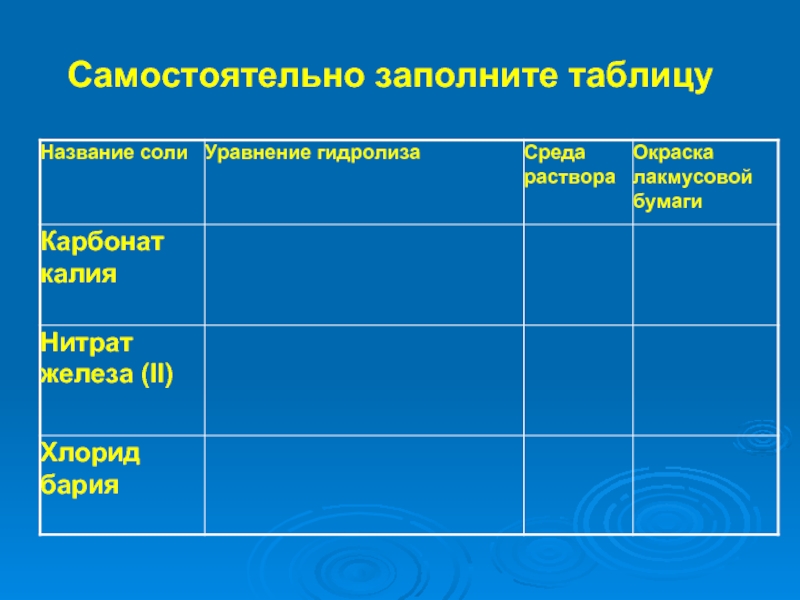
записывать уравнения реакций гидролиза
предсказывать и объяснять изменение кислотности среды и образование кислых и основных солей в этом процессе
познакомиться с ролью гидролиза солей в природе, хозяйственной деятельности и повседневной жизни человека.