Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическая связь и строение атома
Содержание
- 1. Химическая связь и строение атома
- 2. Понятие о химической связиХимическая связь – это
- 3. Виды ковалентной связи : Ковалентная неполярная связь
- 4. Ковалентная связь на примере молекулы метана: законченный
- 5. Ионная связь - прочная химическая связь, образующаяся
- 6. Слайд 6
- 7. Электроотрицательность элементовЭлектроотрицательность - это условная величина, которая
- 8. F, O, N, Cl, Br, S, P,
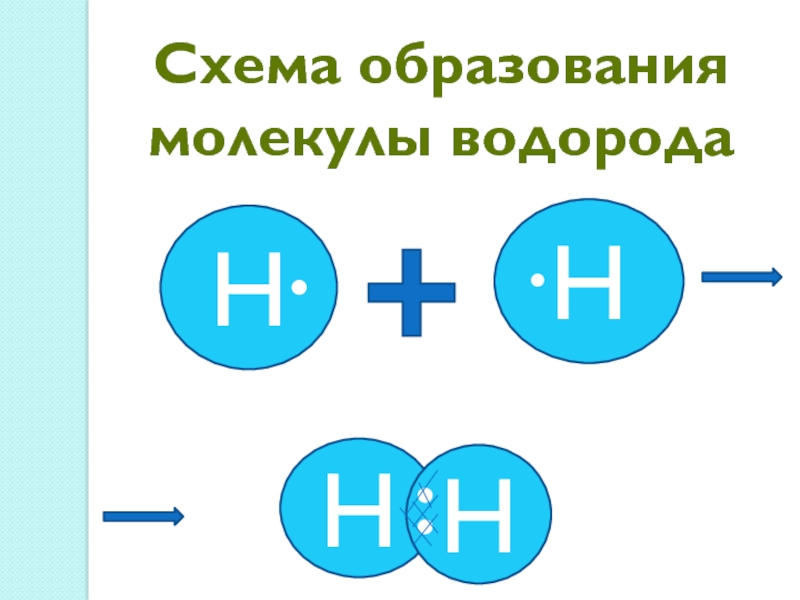
- 9. Схема образования молекулы водородаHHHH
- 10. Кристаллические решеткиИонные кристаллические решеткиАтомные кристаллические решеткиМолекулярные кристаллические решеткиМеталлические кристаллические решетки
- 11. Ионные кристаллические решеткиИонными называют кристаллические решетки, в
- 12. Рассмотрим строение кристалла поваренной соли, в узлах которого находятся ионы хлора и натрия.
- 13. Атомные кристаллические решеткиАтомными называют кристаллические решётки, в
- 14. Молекулярные кристаллические решеткиМолекулярными называют кристаллические решётки, в
- 15. Металлические кристаллические решеткиМеталлическими называют решётки, в узлах
- 16. Два изображения кристаллической решетки галита
- 17. Степень окисленияСтепень окисления – это условно принятый
- 18. Определение степени окисления атома элемента по химической
- 19. Спасибо за внимание!!!
- 20. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Понятие о химической связи
Химическая связь – это связь между атомами,
обеспечивающая существование веществ с четко определенным составом. При образовании ковалентной
химической связи важную роль в уменьшении полной энергии играет обменное взаимодействие.Ковалентная связь
Ионная связь
Виды химической связи:
Слайд 3Виды ковалентной связи :
Ковалентная неполярная связь – это связь
с помощью общих электронных пар, равноудалённых от ядер обоих атомов.
Ковалентная полярная связь – это химическая связь с помощью общих электронных пар, которые смещены в сторону более электроотрицательного атома.
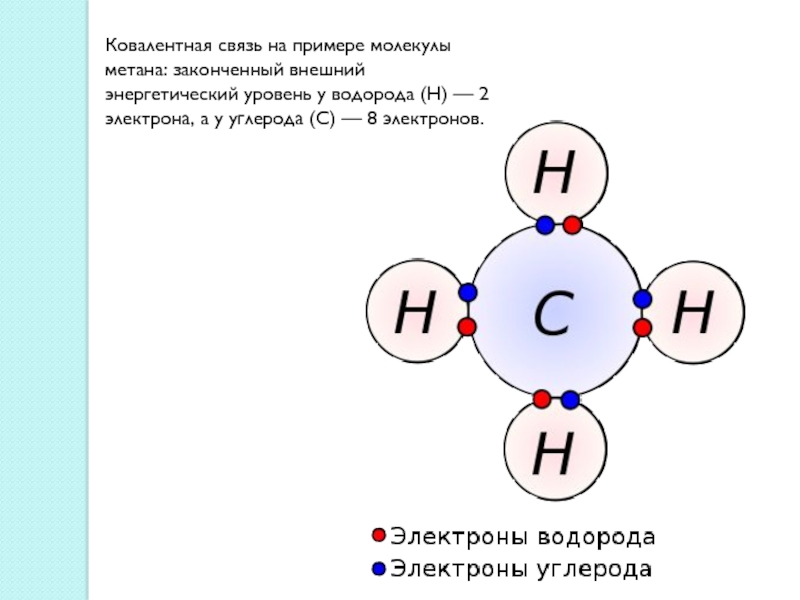
Слайд 4Ковалентная связь на примере молекулы метана: законченный внешний энергетический уровень
у водорода (H) — 2 электрона, а у углерода (C)
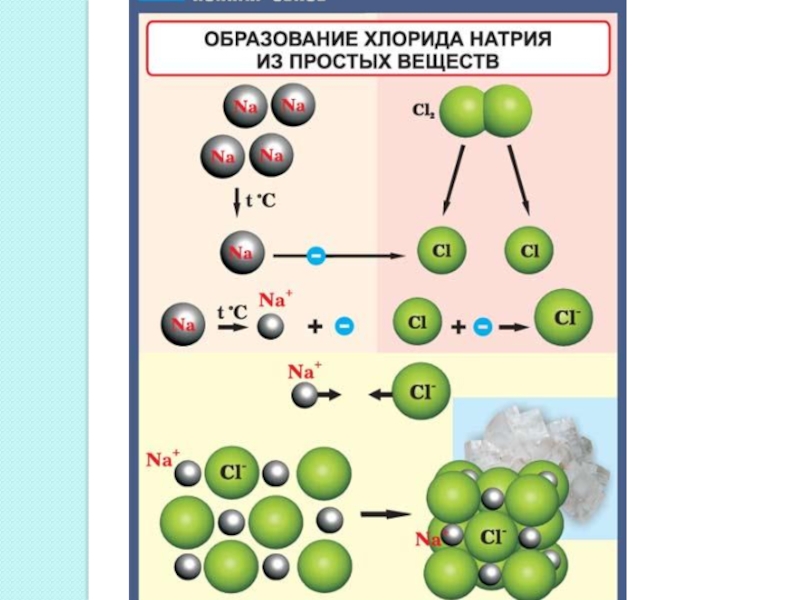
— 8 электронов.Слайд 5Ионная связь - прочная химическая связь, образующаяся между атомами с
большой разностью электроотрицательностей, при которой общая электронная пара полностью переходит
к атому с большей электроотрицательностью.Вид химической связи :
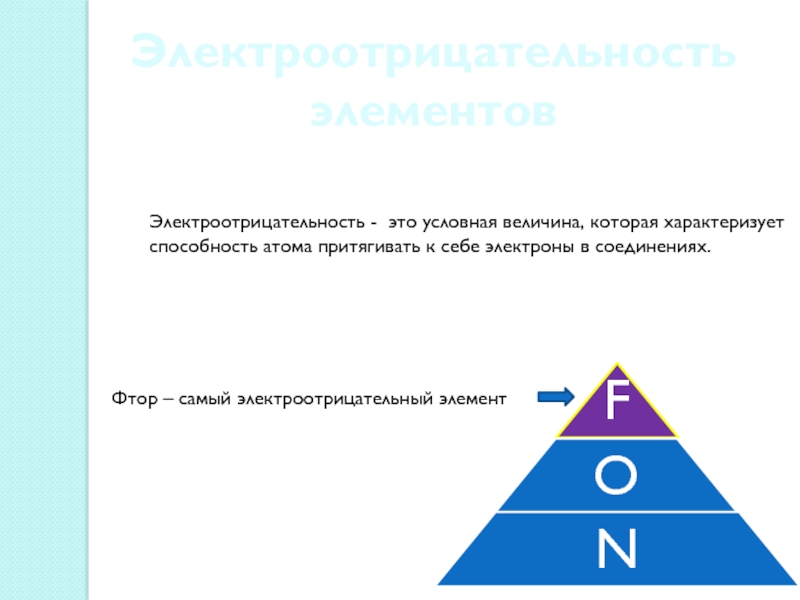
Слайд 7Электроотрицательность элементов
Электроотрицательность - это условная величина, которая характеризует способность атома
притягивать к себе электроны в соединениях.
Фтор – самый электроотрицательный элемент
Слайд 10Кристаллические решетки
Ионные кристаллические решетки
Атомные кристаллические решетки
Молекулярные кристаллические решетки
Металлические кристаллические решетки
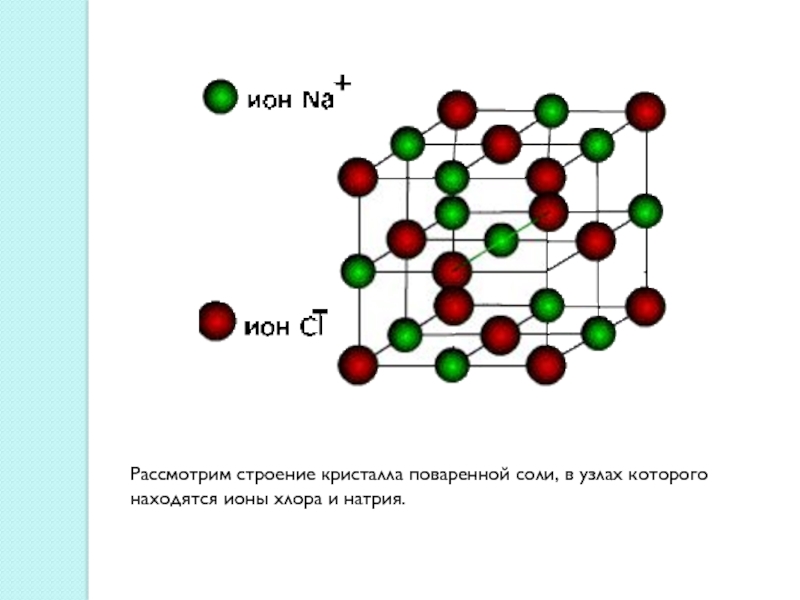
Слайд 11Ионные кристаллические решетки
Ионными называют кристаллические решетки, в узлах которых находятся
ионы. Их образуют вещества с ионной связью. Ионные кристаллические решётки
имеют соли, некоторые оксиды и гидроксиды металлов.Связи между ионами в кристалле очень прочные и устойчивые.Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи.
Слайд 12Рассмотрим строение кристалла поваренной соли, в узлах которого находятся ионы
хлора и натрия.
Слайд 13Атомные кристаллические решетки
Атомными называют кристаллические решётки, в узлах которых находятся
отдельные атомы, которые соединены очень прочными ковалентными связями.
В природе
встречается немного веществ с атомной кристаллической решёткой. К ним относятся бор, кремний, германий, кварц, алмаз. Алмаз - самый твёрдый природный материал.Кристаллическая решётка алмаза.
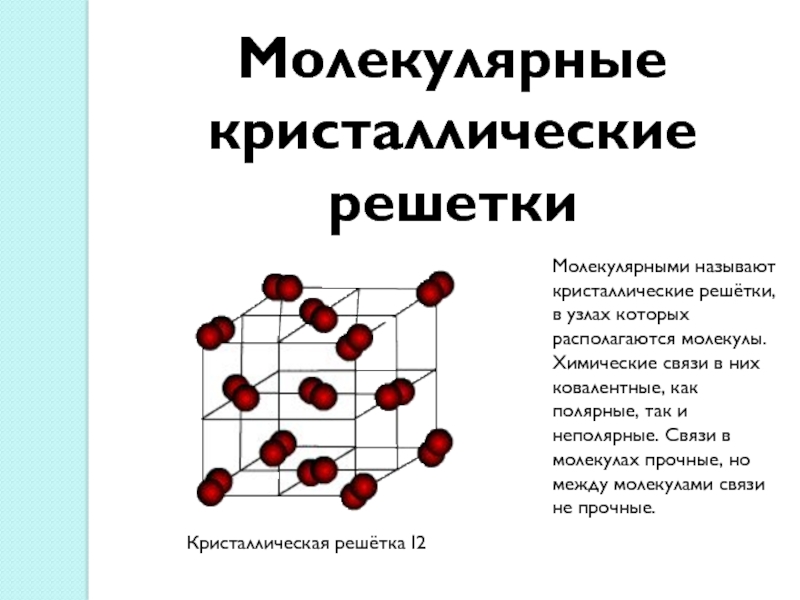
Слайд 14Молекулярные кристаллические решетки
Молекулярными называют кристаллические решётки, в узлах которых располагаются
молекулы. Химические связи в них ковалентные, как полярные, так и
неполярные. Связи в молекулах прочные, но между молекулами связи не прочные.Кристаллическая решётка I2
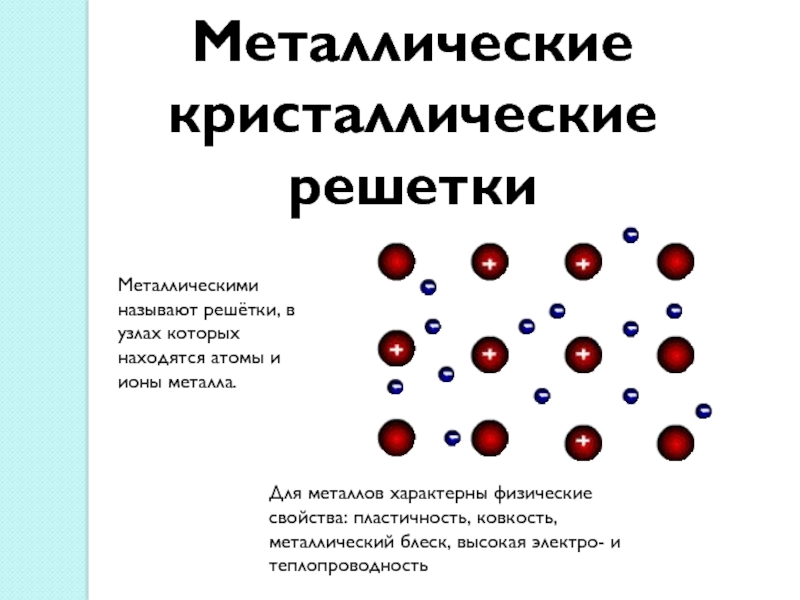
Слайд 15Металлические кристаллические решетки
Металлическими называют решётки, в узлах которых находятся атомы
и ионы металла.
Для металлов характерны физические свойства: пластичность, ковкость, металлический
блеск, высокая электро- и теплопроводностьСлайд 17Степень окисления
Степень окисления – это условно принятый электрический заряд, который
имел бы атом данного элемента в соединении, если бы все
связи в нем были ионными.Слайд 18Определение степени окисления атома элемента по химической формуле соединения :
Степень
окисления элемента в простом веществе равна нулю (электроотрицательность атомов одинакова).
Металлические
элементы в соединениях с неметаллическими всегда имеют положительную степень окисления (их электроотрицательность мала и электроны смещаются к атомам неметаллических элементов).Неметаллические элементы в соединениях с металлическими всегда имеют отрицательную степень окисления (их электроотрицательность больше, чем у металлических элементов).
Водород в соединениях имеет степень окисления +1 (за исключением бинарных соединениях с металлическими элементами).
Кислород в соединениях имеет степень окисления -2 (за исключением соединений с фтором, пероксида водорода H2O2 и т. п.)
Величина степени окисления атома в соединении равна числу валентных электронов, которые приняли участие в образовании химической связи.
Алгебраическая сумма степеней окисления всех атомов в соединении равна нулю
В бинарном соединении неметаллов положительную степень окисления имеет элемент с меньшей электроотрицательностью.