Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
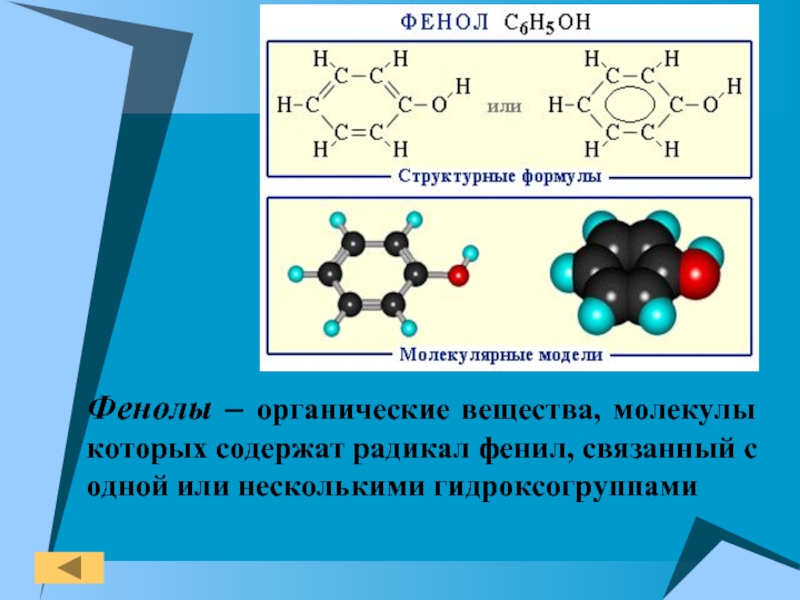
Фенолы
Содержание
- 1. Фенолы
- 2. План урокаФенолыКлассификация феноловСтроение молекулыФизические свойства фенолаХимические свойства фенолаПолучениеПрименениеЧем опасен фенолСимптомы отравления фенолом
- 3. Фенолы – органические вещества, молекулы которых содержат радикал фенил, связанный с одной или несколькими гидроксогруппами
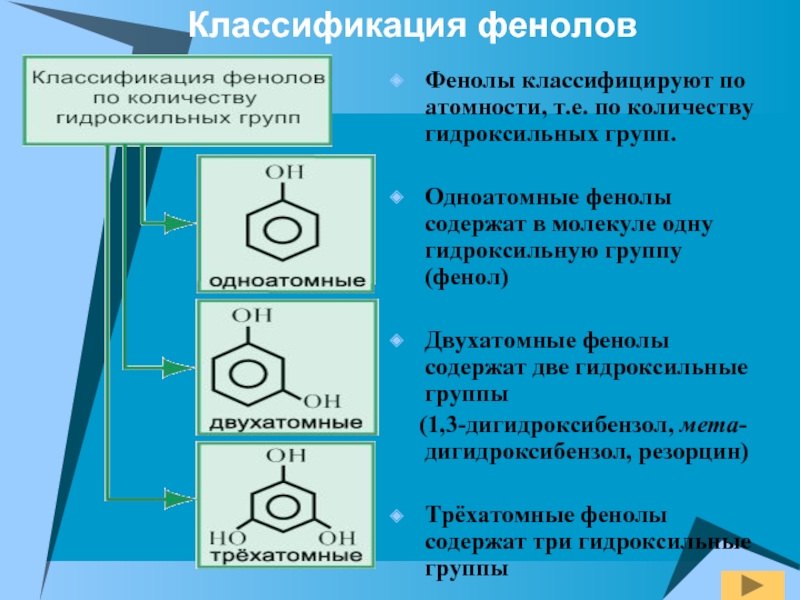
- 4. Фенолы классифицируют по атомности, т.е. по количеству
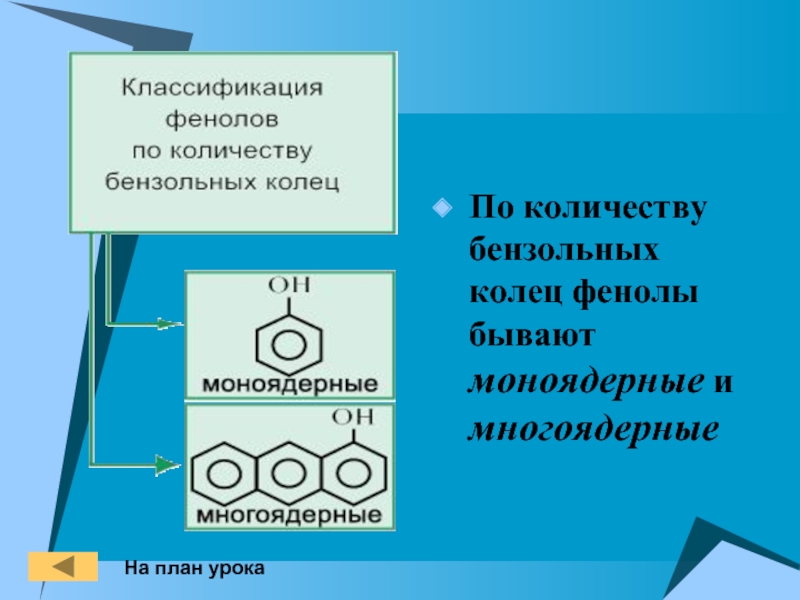
- 5. По количеству бензольных колец фенолы бывают моноядерные и многоядерныеНа план урока
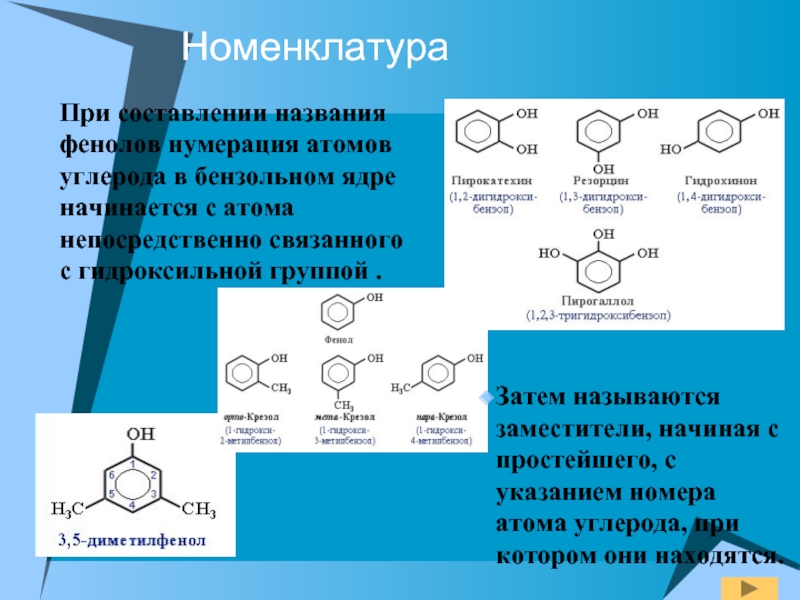
- 6. НоменклатураПри составлении названия фенолов нумерация атомов углерода
- 7. Строение молекулы фенолаГидроксогруппа и бензольное кольцо оказывают
- 8. Физические свойства фенолаФенол - твёрдое бесцветное кристаллическое
- 9. на план урока
- 10. Химические свойства фенолаХимические свойства фенола обусловлены наличием в его молекулегидроксильной группыбензольного ядра
- 11. Химические свойства, обусловленные наличием гидроксильной группы1. Диссоциация
- 12. 2.Взаимодействие с натриемФенол, как и спирты, взаимодействует
- 13. 3. Взаимодействие со щелочами Влияние
- 14. Слайд 14
- 15. Карболовая кислота в
- 16. Химические свойства, обусловленные наличием бензольного ядра
- 17. 2. Реакции замещения. А. Галогенирование –
- 18. Слайд 18
- 19. Б. Нитрование фенола Нитрование фенола
- 20. В результате полного нитрования фенола
- 21. При нагревании в присутствии никелевого
- 22. 4.Реакции поликонденсации с альдегидамиНа план урока
- 23. 5. Качественная реакция на фенол
- 24. Слайд 24
- 25. Получение фенола1. Фенол выделяют из каменноугольной смолы.
- 26. Применение фенола.Фенол применяют для производства фенолформальдегидных пластмасс,
- 27. Слайд 27
- 28. Сфера применения фенолов
- 29. Слайд 29
- 30. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2План урока
Фенолы
Классификация фенолов
Строение молекулы
Физические свойства фенола
Химические свойства фенола
Получение
Применение
Чем опасен фенол
Симптомы
отравления фенолом
Слайд 3Фенолы – органические вещества, молекулы которых содержат радикал фенил, связанный
с одной или несколькими гидроксогруппами
Слайд 4Фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп.
Одноатомные
фенолы содержат в молекуле одну гидроксильную группу (фенол)
Двухатомные фенолы содержат
две гидроксильные группы (1,3-дигидроксибензол, мета-дигидроксибензол, резорцин)
Трёхатомные фенолы содержат три гидроксильные группы
Классификация фенолов
Слайд 6Номенклатура
При составлении названия фенолов нумерация атомов углерода в бензольном ядре
начинается с атома непосредственно связанного с гидроксильной группой .
Затем
называются заместители, начиная с простейшего, с указанием номера атома углерода, при котором они находятся.
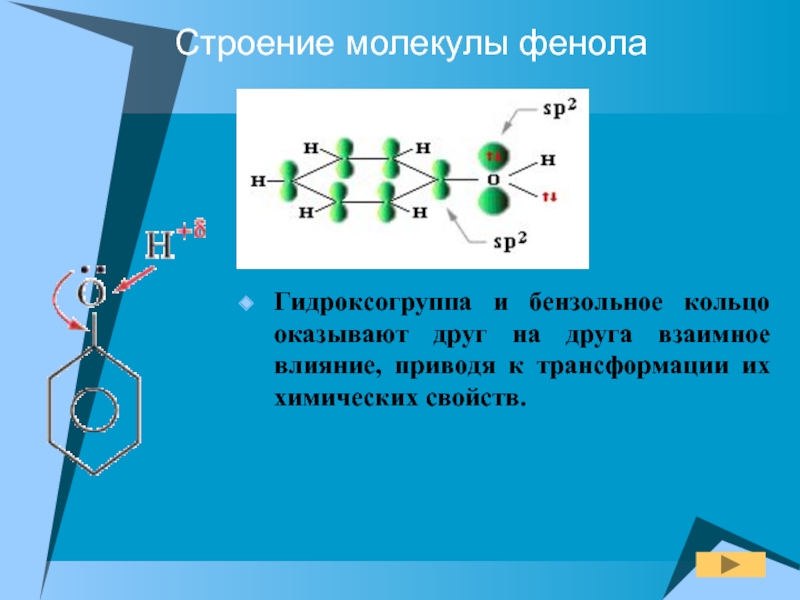
Слайд 7Строение молекулы фенола
Гидроксогруппа и бензольное кольцо оказывают друг на друга
взаимное влияние, приводя к трансформации их химических свойств.
Слайд 8Физические свойства фенола
Фенол - твёрдое бесцветное кристаллическое вещество. Вследствие частичного
окисления на воздухе он бывает окрашен в розовый цвет. Его
температура плавления +42ºС, температура кипения +181ºС. Фенол обладает резким характерным запахом. В холодной воде он мало растворим, но уже при 70 ºС растворяется в любых отношениях.Фенол ядовит! При попадании на кожу вызывает ожоги поэтому с фенолом необходимо обращаться осторожно!
Слайд 10Химические свойства фенола
Химические свойства фенола обусловлены наличием в его молекуле
гидроксильной
группы
бензольного ядра
Слайд 11Химические свойства, обусловленные наличием гидроксильной группы
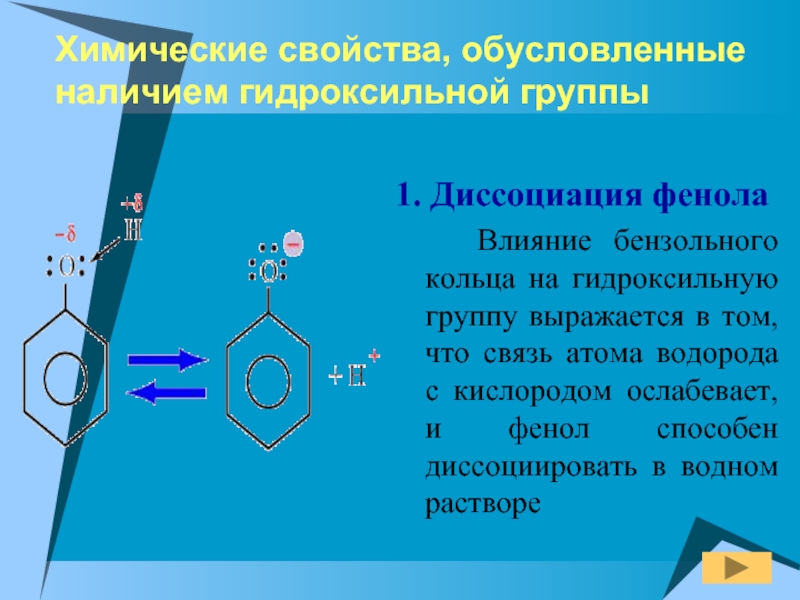
1. Диссоциация фенола
Влияние
бензольного кольца на гидроксильную группу выражается в том, что связь
атома водорода с кислородом ослабевает, и фенол способен диссоциировать в водном растворе
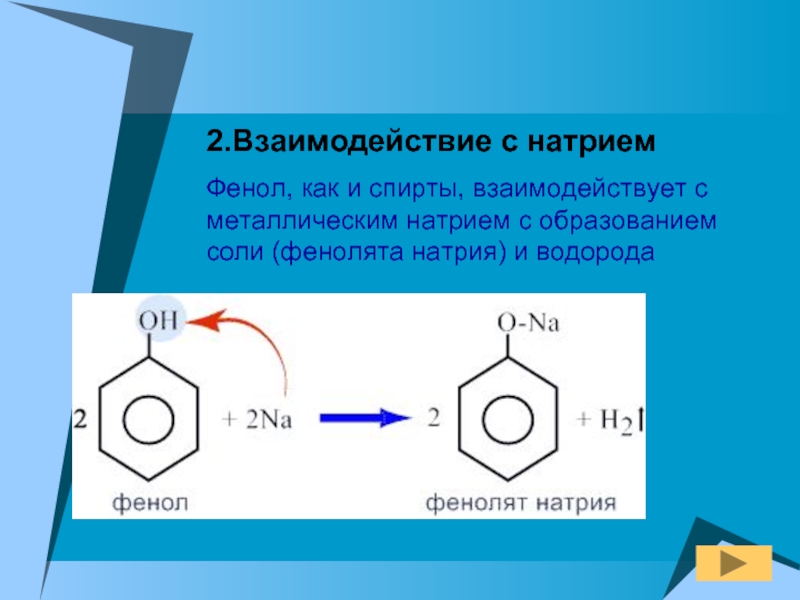
Слайд 122.Взаимодействие с натрием
Фенол, как и спирты, взаимодействует с металлическим натрием
с образованием соли (фенолята натрия) и водорода
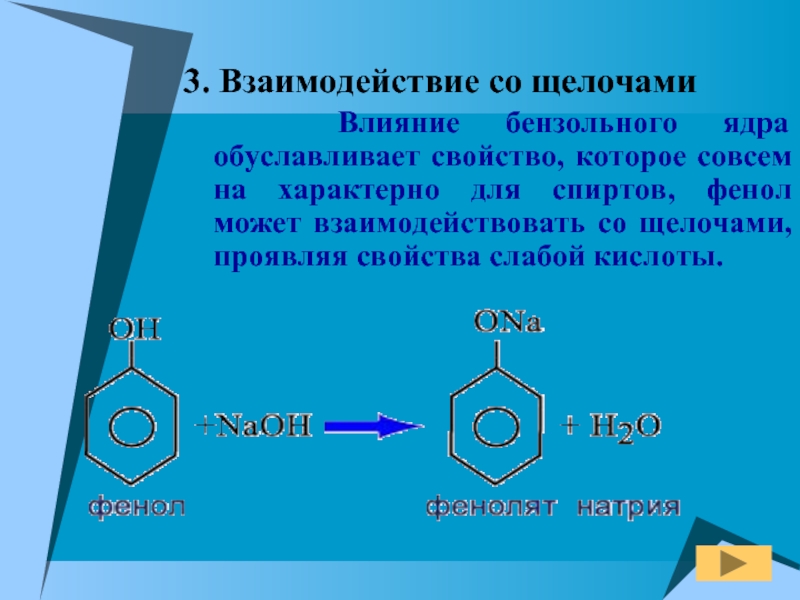
Слайд 133. Взаимодействие со щелочами
Влияние бензольного ядра обуславливает
свойство, которое совсем на характерно для спиртов, фенол может взаимодействовать
со щелочами, проявляя свойства слабой кислоты.
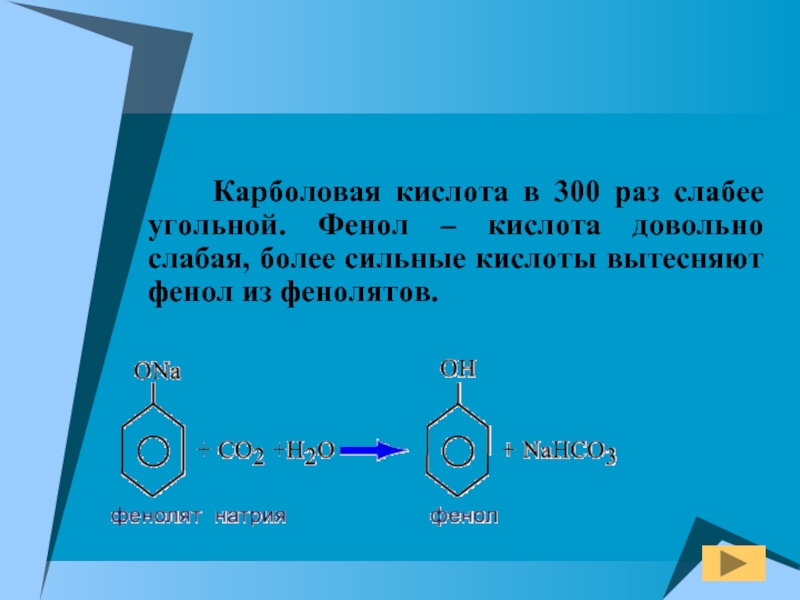
Слайд 15
Карболовая кислота в 300 раз слабее
угольной. Фенол – кислота довольно слабая, более сильные кислоты вытесняют
фенол из фенолятов.
Слайд 16Химические свойства, обусловленные наличием бензольного ядра
Отличия от
ароматических углеводородов:
1. Реакции окисления
Фенол окисляется кислородом воздуха, приобретая фиолетовую
окраску.
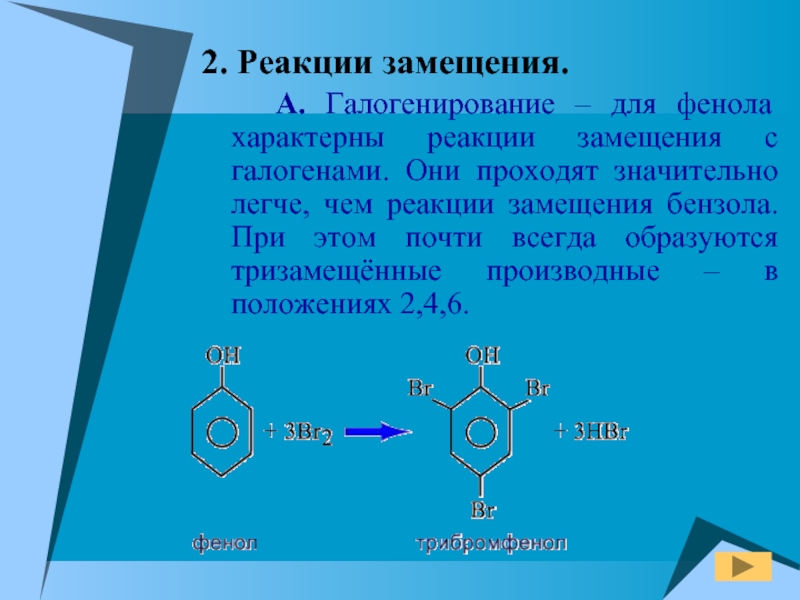
Слайд 172. Реакции замещения.
А. Галогенирование – для фенола характерны
реакции замещения с галогенами. Они проходят значительно легче, чем реакции
замещения бензола. При этом почти всегда образуются тризамещённые производные – в положениях 2,4,6.
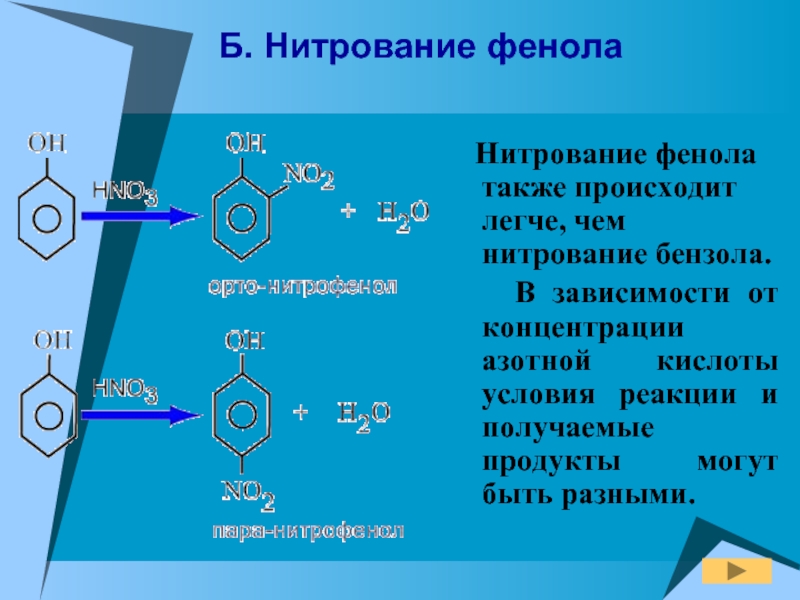
Слайд 19Б. Нитрование фенола
Нитрование фенола также происходит легче, чем
нитрование бензола.
В зависимости от концентрации азотной кислоты условия
реакции и получаемые продукты могут быть разными.
Слайд 20 В результате полного нитрования фенола образуется 2,4,6-тринитрофенол
(пикриновая кислота) –взрывчатое вещество.
В
XIX столетии её применяли в качестве жёлтого красителя до случая, когда в Париже (1871) одно текстильное предприятие в результате взрыва было снесено с поверхности земли.
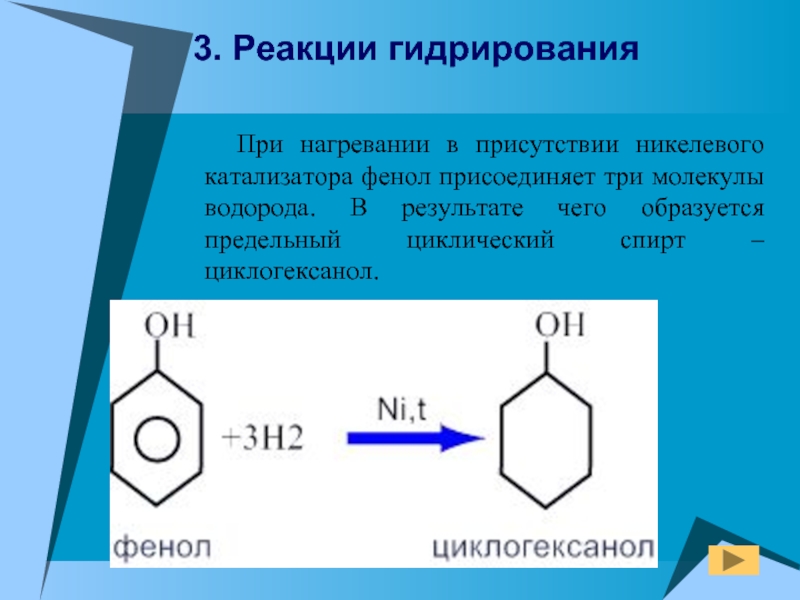
Слайд 21 При нагревании в присутствии никелевого катализатора фенол присоединяет
три молекулы водорода. В результате чего образуется предельный циклический спирт
– циклогексанол.3. Реакции гидрирования
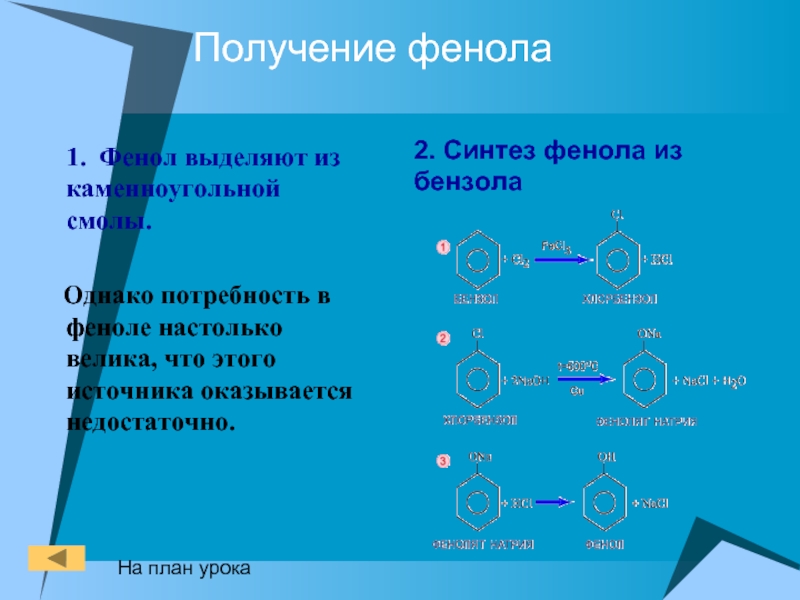
Слайд 25Получение фенола
1. Фенол выделяют из каменноугольной смолы.
Однако
потребность в феноле настолько велика, что этого источника оказывается недостаточно.
2.
Синтез фенола из бензолаНа план урока
Слайд 26Применение фенола.
Фенол применяют для производства фенолформальдегидных пластмасс, синтетического волокна капролактам,
красителей, лекарств, взрывчатых веществ и других продуктов. Раствор фенола в
воде обладает дезинфицирующими свойствамиНа план урока
Слайд 27
Чем опасен фенол.
Практически
сразу после получения фенола ученые установили, что это химическое вещество обладает не только полезными свойствами, что позволяет его использовать в различных сферах науки и производства, но и является сильнодействующим ядом. Так, вдыхание паров фенола в течение непродолжительного времени может привести к раздражению носоглотки, ожогам дыхательных путей и последующему отеку легких с летальным исходом. При соприкосновении раствора фенола с кожей образуются химические ожоги, которые впоследствии трансформируются в язвы. Слайд 28 Сфера применения фенолов достаточно широка, но
большинство жителей нашей страны узнало о них из-за скандала,
разразившегося в конце 1990-х гг. вокруг печально известных «фенольных домов» – панельных многоэтажек серии П-49/П, построенных в конце 1970 – начале 1980-х гг. Эти дома в свое время считались экспериментальными. В бетон, использованный при их строительстве, добавляли фенолформальдегид. Это должно было ускорить его затвердевание и тем самым приблизить сроки сдачи домов. Новоселы, поначалу обрадовавшиеся просторным квартирам, вскоре поняли, что вместе с новым жильем они получили целый букет проблем со здоровьем – это и аллергия, и болезни глаз, почек, дыхательных путей, и даже злокачественные новообразования.Дело в том, что фенол и его производные без труда проникают в организм человека через кожу и желудочно-кишечный тракт, а пары фенола – через легкие. В организме фенол легко образует соединения с другими веществами, присутствующими в организме. Чем выше концентрация фенола в крови, тем сильнее его неблагоприятное влияние на здоровье человека.