Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химические свойства оксидов
Содержание
- 1. Химические свойства оксидов
- 2. Классификация оксидов по химическим свойствамОКСИДЫНесолеобразующиеБезразличныеСО, NO, N2O, SiOСолеобразующие ОсновныеВаО, СаО КислотныеSO3, N2O5АмфотерныеZnO, Al 2O3химические свойства
- 3. Несолеобразующие оксиды – это оксиды, которые не
- 4. Солеобразующие оксиды – это оксиды, которые взаимодействуют
- 5. Основные оксиды – это оксиды, которым в
- 6. Кислотные оксиды – это оксиды, которым в
- 7. Амфотерные оксиды – это оксиды, которым соответствуют
- 8. Химические свойства основных оксидовосновной оксид + вода
- 9. Химические свойства кислотных оксидовкислотный оксид + вода
- 10. Химические свойства амфотерных оксидов
- 11. Способы получения оксидовГорение сложных веществ:
- 12. Скачать презентанцию
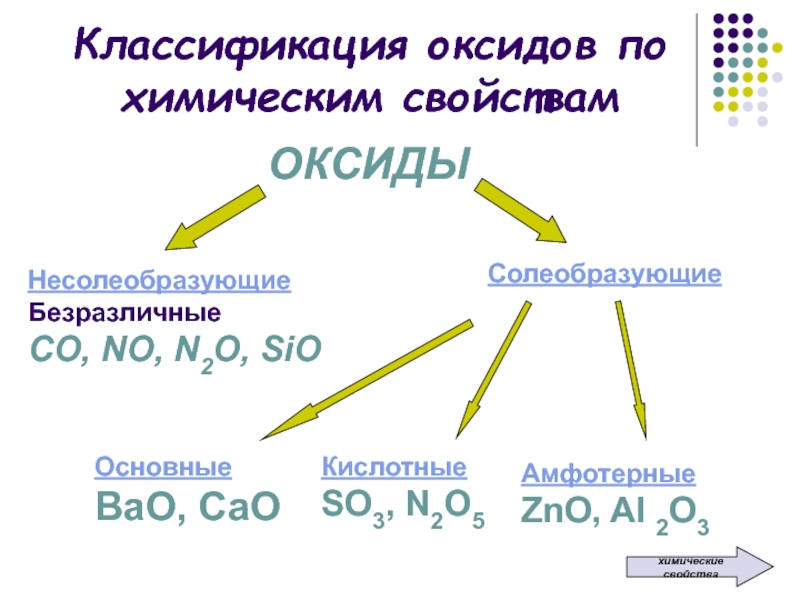
Классификация оксидов по химическим свойствамОКСИДЫНесолеобразующиеБезразличныеСО, NO, N2O, SiOСолеобразующие ОсновныеВаО, СаО КислотныеSO3, N2O5АмфотерныеZnO, Al 2O3химические свойства
Слайды и текст этой презентации
Слайд 2Классификация оксидов по химическим свойствам
ОКСИДЫ
Несолеобразующие
Безразличные
СО, NO, N2O, SiO
Солеобразующие
Основные
ВаО, СаО
Слайд 3Несолеобразующие оксиды – это оксиды, которые не взаимодействуют ни с
кислотами, ни с основаниями и не образуют солей
СО, NO, N2O,
SiO Слайд 4Солеобразующие оксиды – это оксиды, которые взаимодействуют с кислотами или
со щелочами с образованием солей и воды
Слайд 5Основные оксиды – это оксиды, которым в качестве гидроксидов соответствуют
основания
Образованы металлами в степени окисления +1, +2
К2О → КОН
MgO →
Mg(OH)2Слайд 6Кислотные оксиды – это оксиды, которым в качестве гидроксидов соответствуют
кислоты
Образованы неметаллами и металлами в степени окисления +5 и выше
SО3
→ Н2SО4 Слайд 7Амфотерные оксиды – это оксиды, которым соответствуют гидроксиды, проявляющие свойства
как оснований, так и кислот
Образованы металлами в степени окисления +3,
+4, а также оксиды ВеО, ZnO, SnO, PbOZnO → Zn(OH)2 или Н2ZnО2
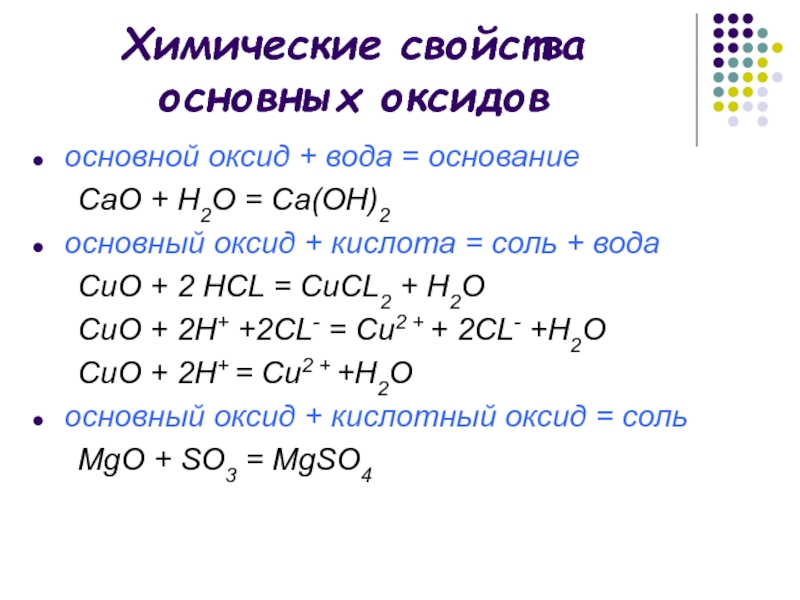
Слайд 8Химические свойства основных оксидов
основной оксид + вода = основание
СаO + H2O = Са(OН)2
основный оксид +
кислота = соль + водаCuO + 2 HCL = CuCL2 + H2O
CuO + 2H+ +2CL- = Cu2 + + 2CL- +Н2О
CuO + 2H+ = Cu2 + +Н2О
основный оксид + кислотный оксид = соль
MgO + SO3 = MgSO4
Слайд 9Химические свойства кислотных оксидов
кислотный оксид + вода = кислота
Р2O5 + 3H2O = 2H3РO4
кислотный оксид
+ основание = соль + водаCO2 + Mg(OН)2= MgCO3 + H2O
CO2 + Mg+ +2OН- = MgCO3 + Н2О
кислотный оксид + основный оксид = соль
SO3 + MgO = MgSO4
Слайд 10Химические свойства амфотерных оксидов
Основные
С кислотами: ZnO + 2НСl → ZnСl2 + Н2О
С кислотными оксидами: ZnO+ SiO2 = ZnSiO3
Кислотные
С основаниями: ZnO + 2NaОН = Na2ZnO2 +Н2О
С основными оксидами: ZnO + MgО = MgZnO2
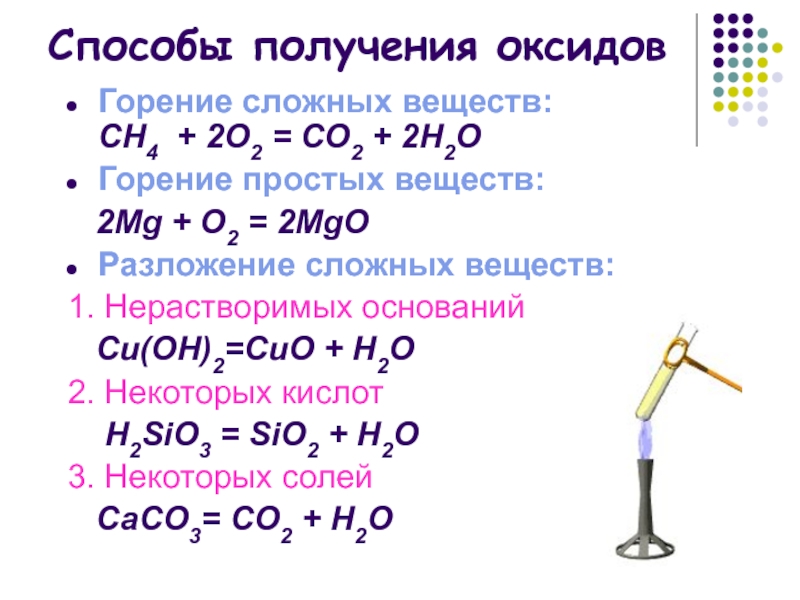
Слайд 11Способы получения оксидов
Горение сложных веществ:
СН4 + 2О2 = СО2 + 2Н2О
Горение простых веществ:
2Mg + О2 = 2MgО
Разложение сложных веществ:
1. Нерастворимых оснований
Cu(OН)2=CuО + H2O
2. Некоторых кислот
H2SiO3 = SiO2 + H2O
3. Некоторых солей
СаСО3= СО2 + Н2О