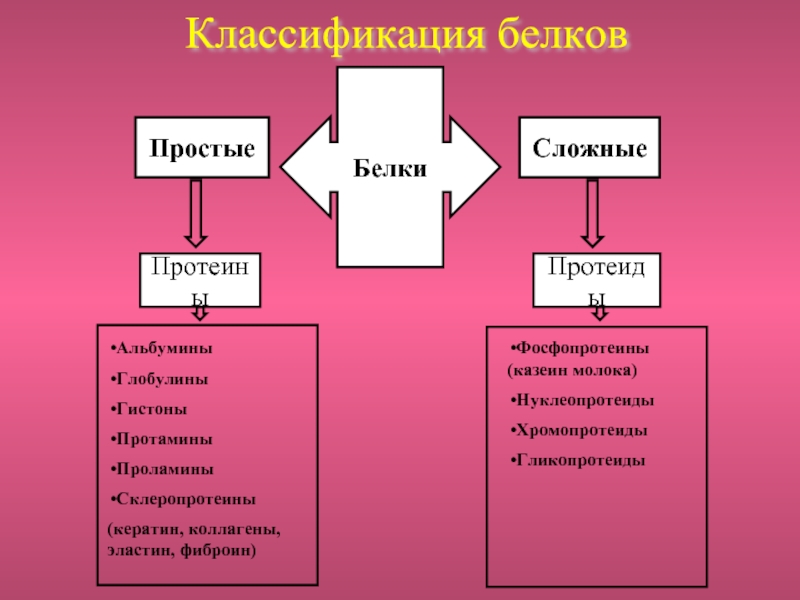
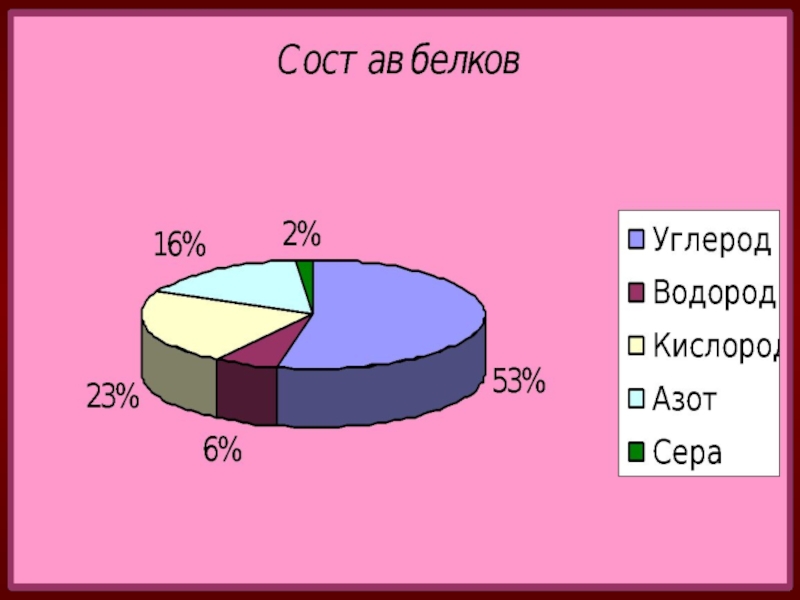
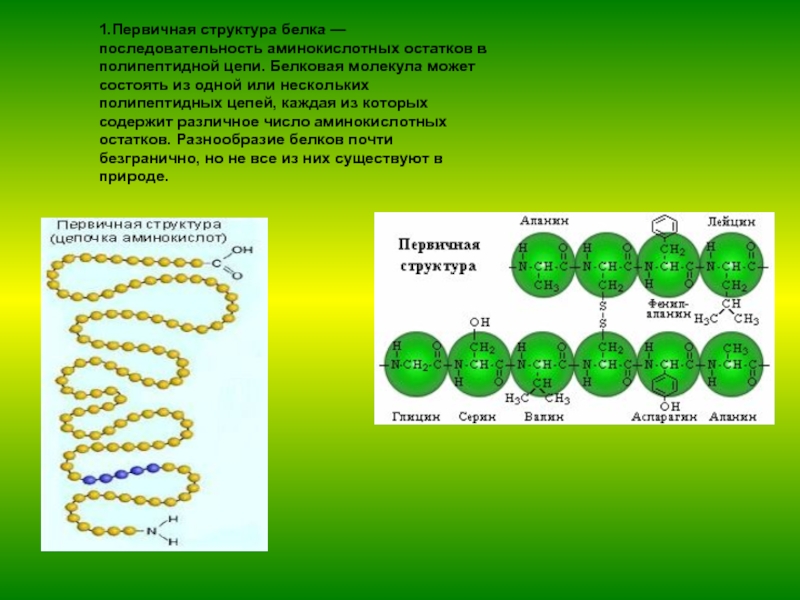
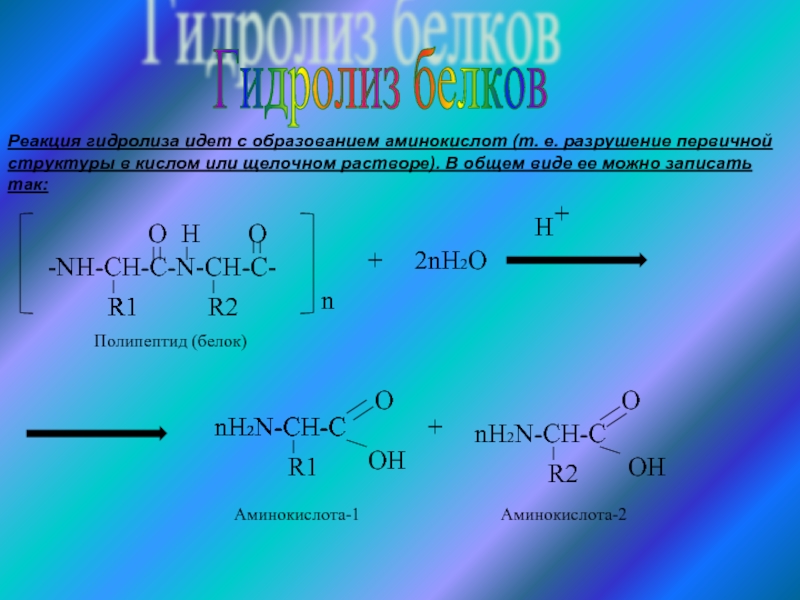
незапамятных времен использовался человеком как составная часть пищи.
По описаниям Плиния
Старшего, уже в Др. Риме яичный белок применялся и как лечебное средство.Впервые термин белковый(albumineise) применительно ко всем жидкостям животного организма использовал французкий физиолог Ф. Кене в 1747 г.