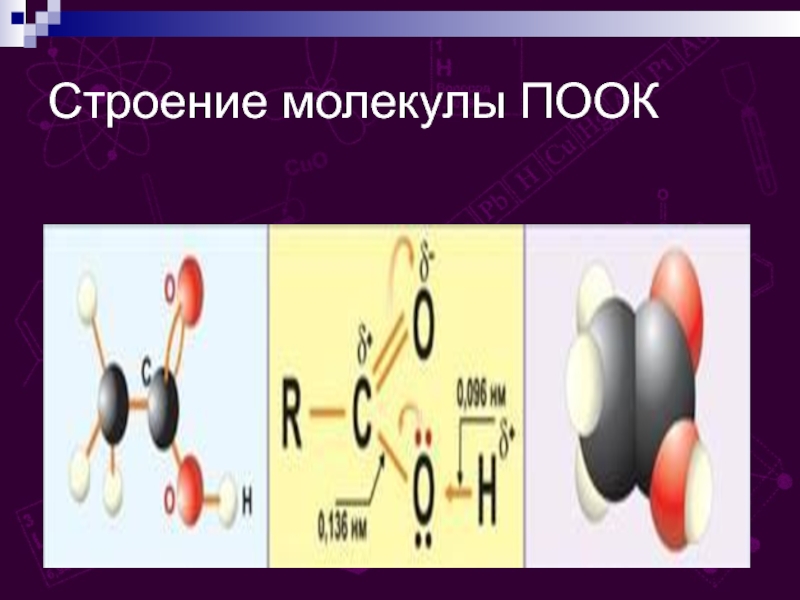
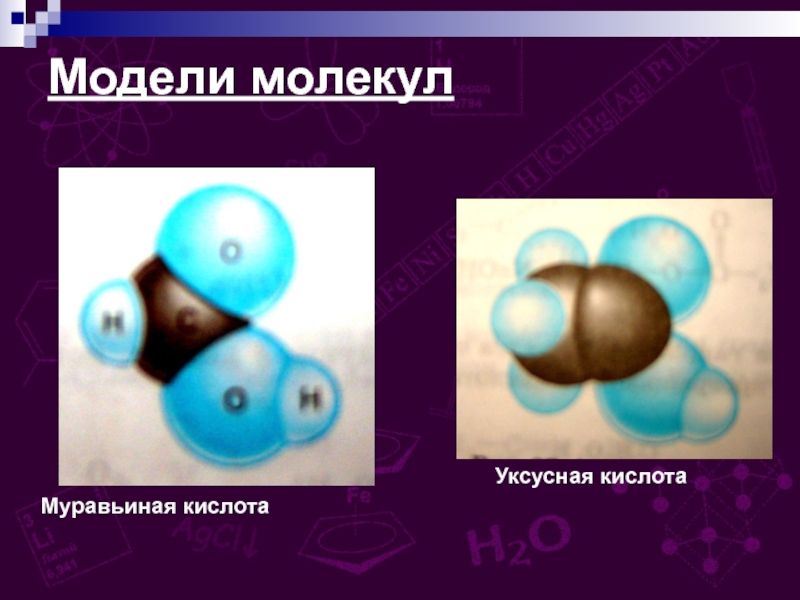
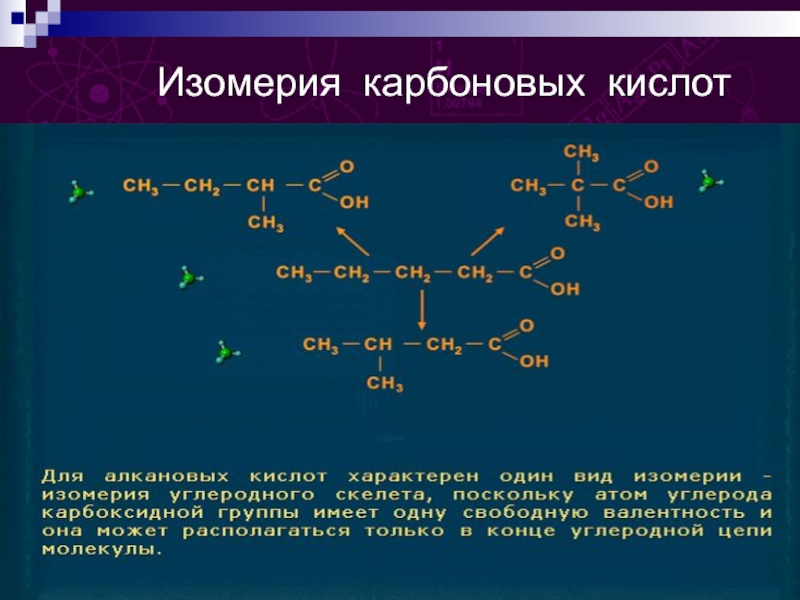
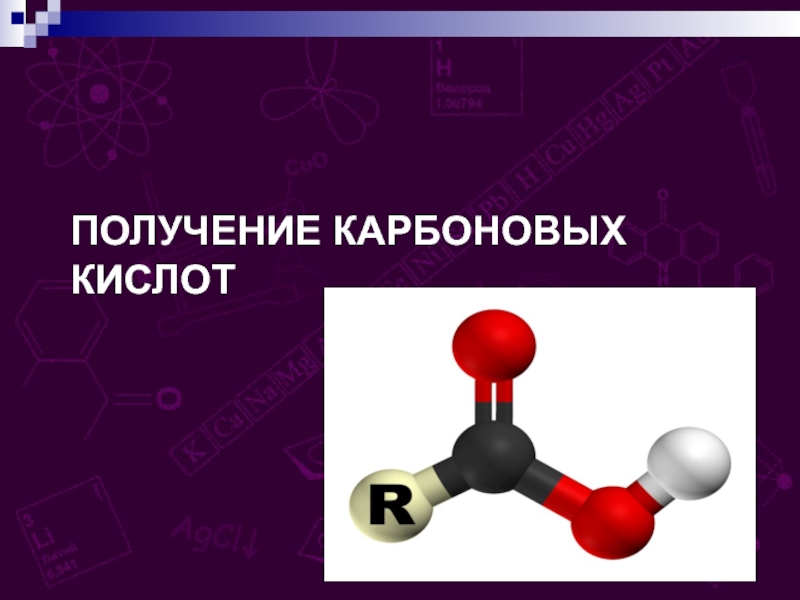
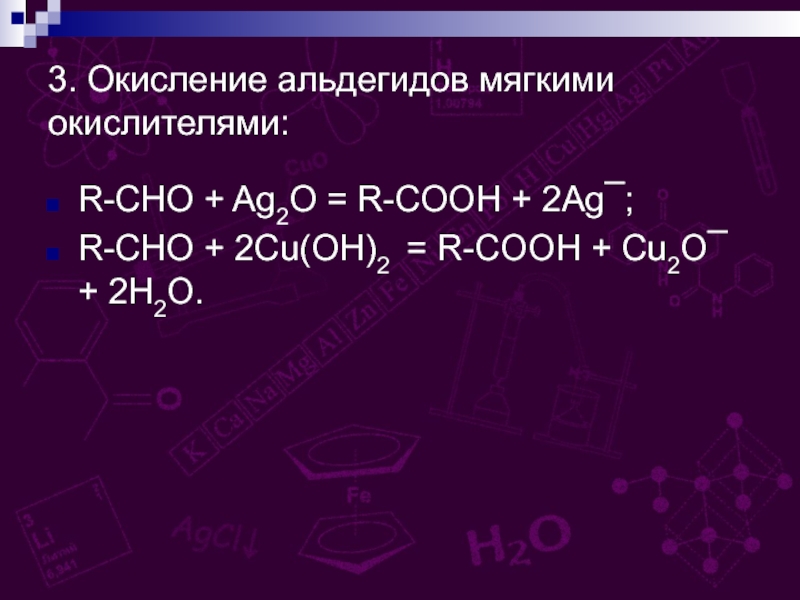
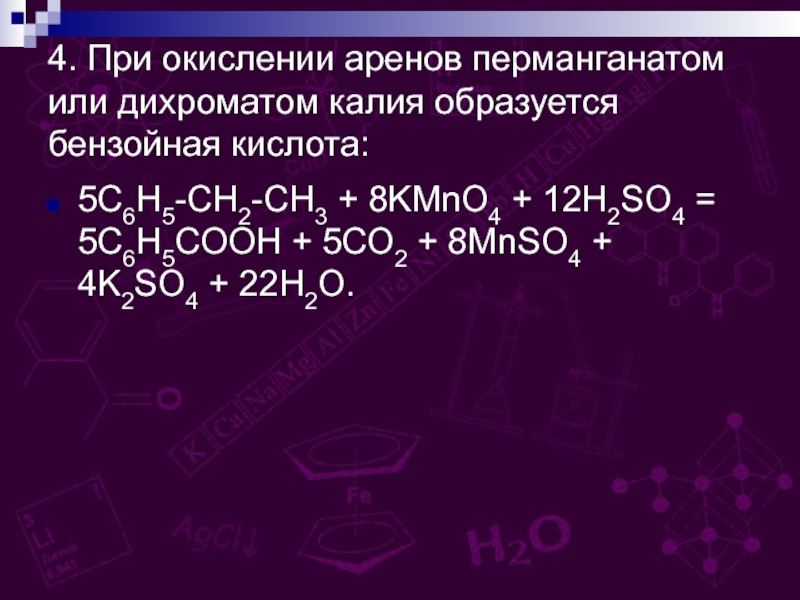
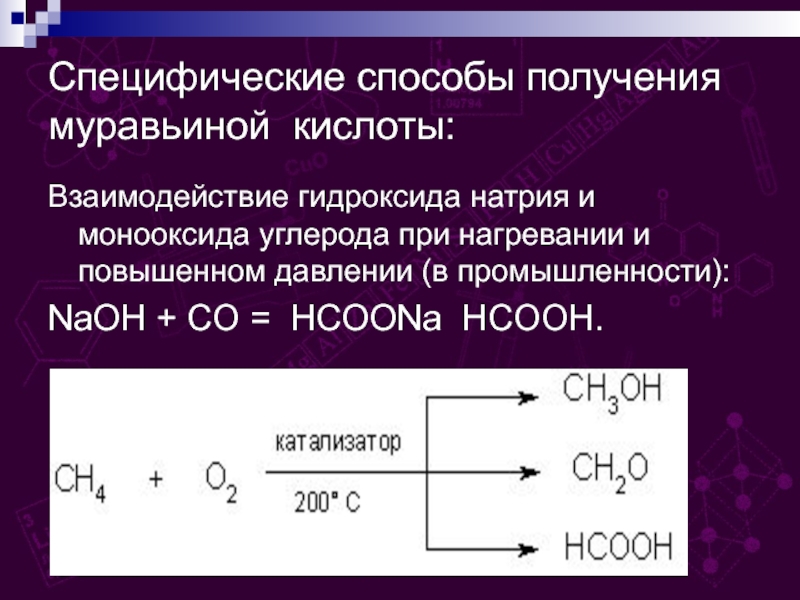
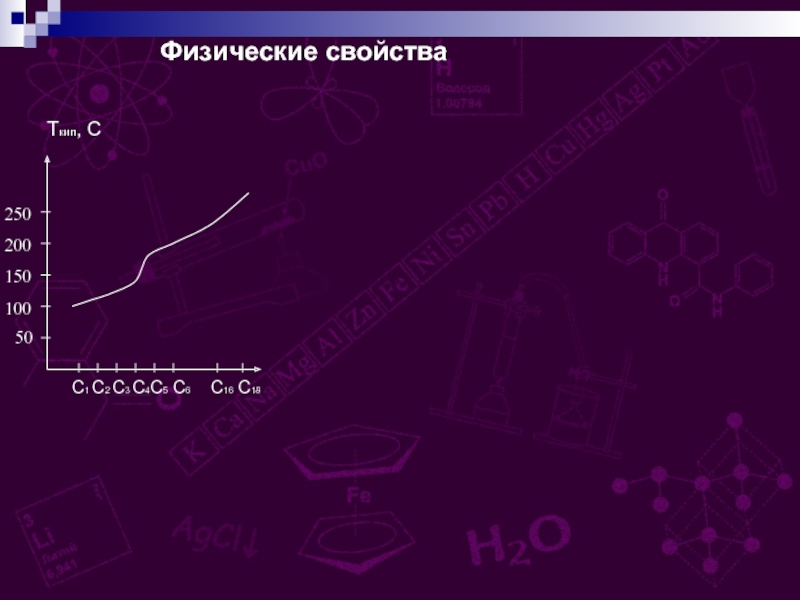
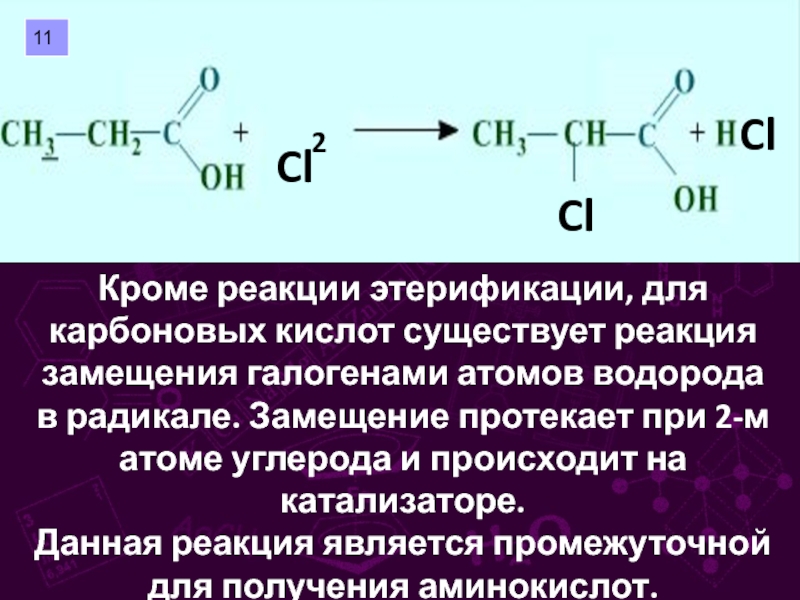
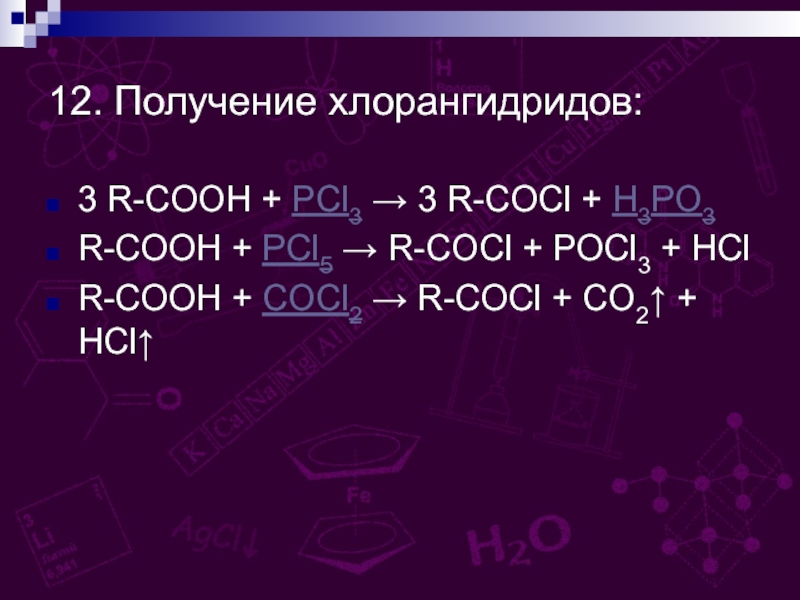
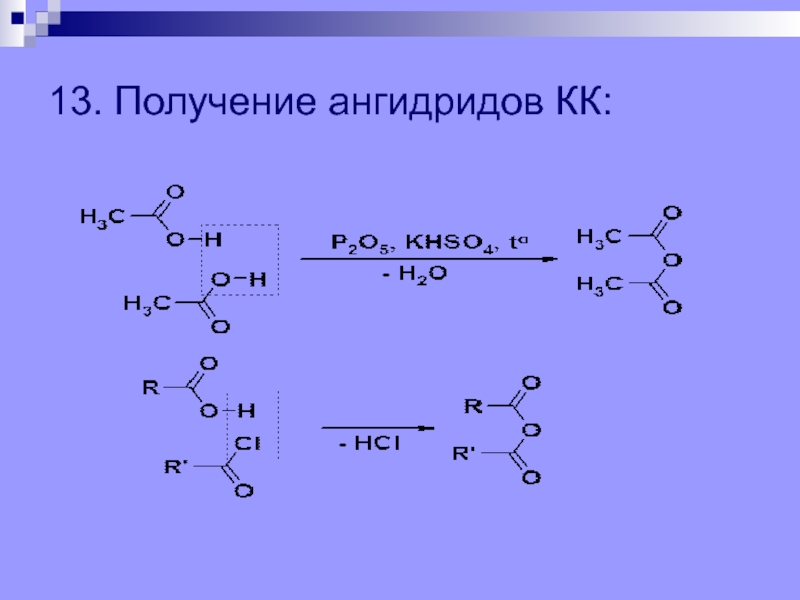
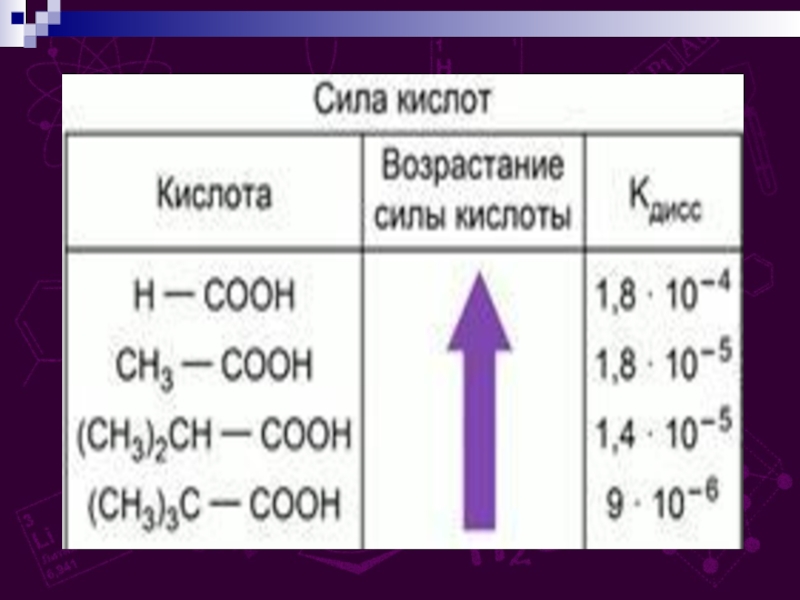
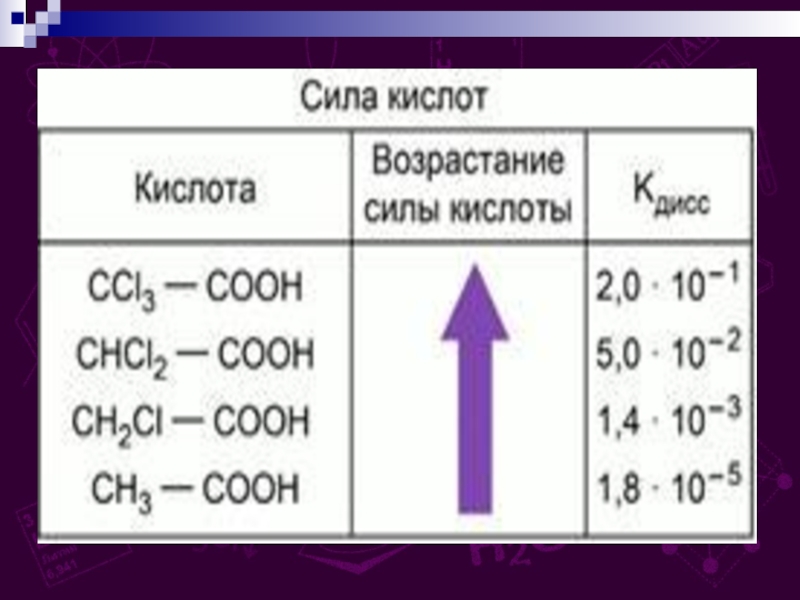
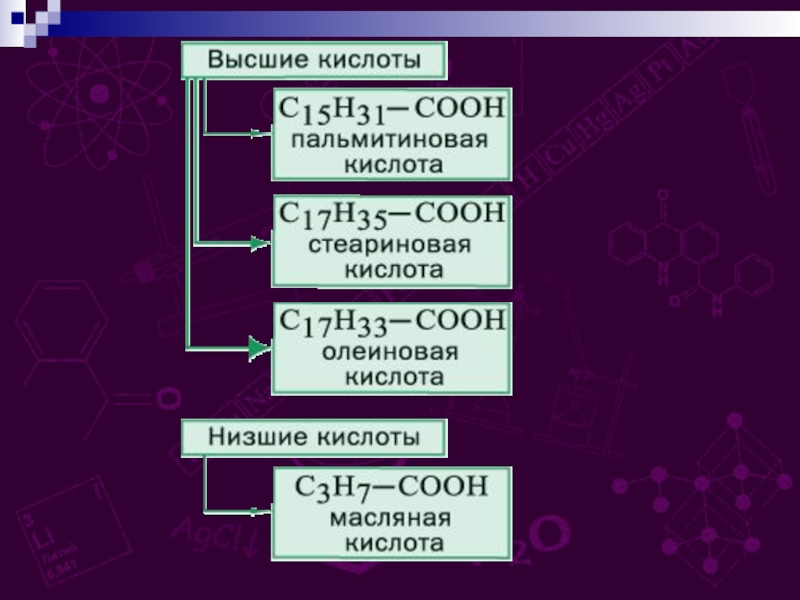
групп –СООН, соединённых с углеводородным радикалом.
Карбоксильная группа содержит две функциональные
группы - и, непосредственно связанные друг с другом:R
C
O
O
H
карбонил >С=О
гидроксил OH