Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кислород. Общая характеристика кислорода. Нахождение в природе. Получение
Содержание
- 1. Кислород. Общая характеристика кислорода. Нахождение в природе. Получение
- 2. Тема: КИСЛОРОД. ОБЩАЯ ХАРАКТЕРИСТИКА. НАХОЖДЕНИЕ В ПРИРОДЕ. ПОЛУЧЕНИЕ
- 3. I.Кислород – химический элемент1. Химический знак2.Положение в
- 4. I.Кислород – химический элементХимический знак – ОПоложение
- 5. Содержание кислорода в природе Распространение элементов в
- 6. Кремний ( IV) оксиды– SiO2
- 7. Алюминий оксиды- Al2O3
- 8. Атмосфера 21 % кислорода (1\5 часть).
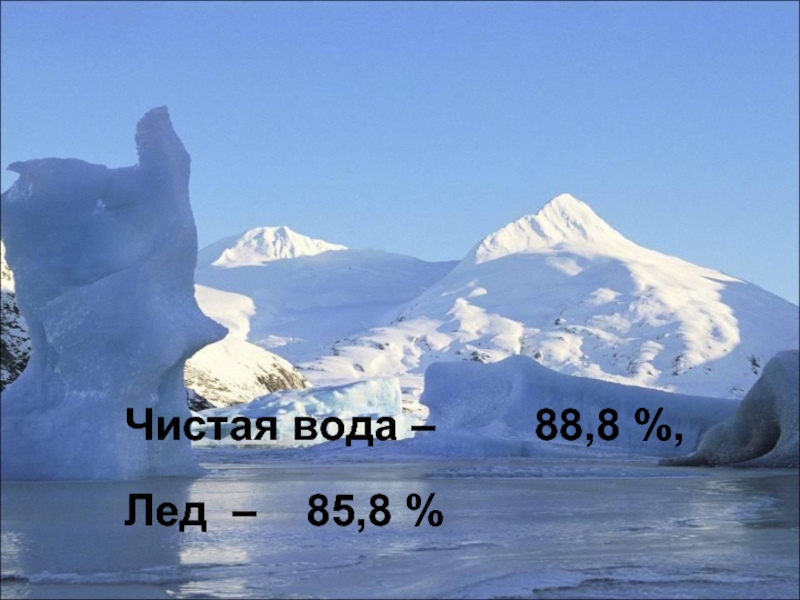
- 9. Чистая вода – 88,8 %, Лед – 85,8 %
- 10. Кислород – в организмеБелки, жиры, углеводы, гормоны, ферменты
- 11. II.Кислород –простое вещество 1.Химическая формула -
- 12. Карл Шееле, Швеция 1772 год: «Атмосферный
- 13. Джозеф Пристли, Англия, 1774 год Терекөмеш
- 14. Джозеф Пристли
- 15. Антуан Лоран Лавуазье, Франция, 1777 годПодлинная природа
- 16. Сказка2 KMnO4 = K2MnO4 + MnO2 +
- 17. Физические войства:ГазБез цвета, запаха, вкусаМалорастворим в водеҺавадан
- 18. Химические свойства Реакции горения неметаллов С+
- 19. Химические свойства Реакции горения сложных веществ
- 20. Слайд 20
- 21. Повторим1. Охарактеризуйте кислород как химический элемент.2.Где содержится
- 22. Задания для
- 23. Всем спасибо за урок!
- 24. Скачать презентанцию
Тема: КИСЛОРОД. ОБЩАЯ ХАРАКТЕРИСТИКА. НАХОЖДЕНИЕ В ПРИРОДЕ. ПОЛУЧЕНИЕ
Слайды и текст этой презентации
Слайд 3I.Кислород – химический элемент
1. Химический знак
2.Положение в периодической системе
3.Относительная
атомная масса
4.Валентность
4.В состав каких веществ входит
Слайд 4I.Кислород – химический элемент
Химический знак – О
Положение в период. Сист.-
Z=8, 2 период, IVA-Группа
2.Относительная атомная масса Аr(О)=16
3.Валентность – II
4.Входит
в состав: воды ,некоторых солей ,кислот, оксидов, минералов, органических веществ веществ ...Слайд 5Содержание кислорода в природе
Распространение элементов в природе (по массе,
в %)
1 -
кислород - 492 - алюминий - 7
3 - железо - 5
4 - кальций - 4
5 - натрий - 2
6 - калий - 2
7 - магний - 2
8 - водород - 1
9 - остальные - 2
10 - кремний - 26
Слайд 11II.Кислород –простое вещество
1.Химическая формула - О2
2.Молекулярная и
молярная массы
Mr(О2)=32; М =32 г/моль.3.Получение
4.Физические свойства
5.Химические свойства
6.Применение
Слайд 12Карл Шееле,
Швеция 1772 год:
«Атмосферный воздух состоит из
двух частей: «огненный воздух» - поддерживает дыхание и горение, «испорченный
воздух» - не поддерживает горения».Слайд 15Антуан Лоран Лавуазье, Франция, 1777 год
Подлинная природа этого газа была
установлена во Франции. Название Oxygenium – кислотообразующий, предложено Лавуазье.
Слайд 16Сказка
2 KMnO4 = K2MnO4 + MnO2 + O2 ↑
КМnO4 –
перманганат калия ; 1- стекловата
Получение кислорода в лаборатории
Слайд 17Физические войства:
Газ
Без цвета, запаха, вкуса
Малорастворим в воде
Һавадан бераз авыр
32>
29 тяж.возд.
Суда аз эри
Сжижается при -183 С- превращается в жидкость
При
температуре -218,8 C, превращается в кристаллическое состояниеСлайд 18Химические свойства
Реакции горения неметаллов
С+ O2 = С
O2
S + O2 = S O2
4P + 5O2 = 2 P2O5 2H2 + O2 = 2H2O
Реакции горения металлов
2Mg + O2 = 2MgO
3Fe + 2O2 = Fe3O4
2С a+ O2 = 2CaO
Слайд 19Химические свойства
Реакции горения сложных веществ
СН4+ 2O2
= СO2 + 2H2O
СS2 + 3O2
= 2S O2 + СO2 C2H6О + 3O2 = 2CO2 + 3H2O
Слайд 21Повторим
1. Охарактеризуйте кислород как химический элемент.
2.Где содержится кислород?
3. Кто
открыл кислород?
4.Как получают кислород?
5.Какими физическими свойствами обладает кислород?
6.В какие реакции
вступает кислород?7.Где применяется?
Слайд 22 Задания для закрепления 1.Сколько молекул содержится в 2 моль кислорода? 2.В
каком природном соединении больше кислорода ( % по массе) в
известняке СаСО3 или поташе К2СО3 ? 3.Расставьте коэффициенты в следующих уравнениях хим.реакции: AgNO3 → Ag +NO2 +O2 Mg(NO3)2 → MgO + NO2 +O2 4. Составьте уравнения хим.реакции горения следующих веществ: С2Н4, Сu2S 5. Из предложенного перечня выпишите формулы всех кислородсодержащих соединении Н2О, МgS , SiO2, NaOH, F eS2, H2SO4, CaCO3, Al2S3, ZnO. Сайт http://flsh.ucoz.ru
Теги