Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кислородсодержащие органические соединения
Содержание
- 1. Кислородсодержащие органические соединения
- 2. КИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ Кафедра ЭПП, к.х.н., доцент Саверченко А.Н.
- 3. Студент должен: знать строение, номенклатуру, свойства,
- 4. К кислородсодержащим органическим
- 5. Остальные валентности углерода могут участвовать в образовании
- 6. Спирты и их производные Производные углеводородов, представляющие
- 7. Спирты могут содержать и несколько гидроксильных групп
- 8. Строение. Изомерия.Изомерия предельных одноатомных спиртов, общая формула
- 9. Из бутана и изобутана могут быть произведены
- 10. Химические свойстваХимические свойства спиртов обусловлены наличием гидроксильной
- 11. Кислотные свойства спиртов.Атомы водорода гидроксильных групп в
- 12. По мере увеличения числа углеродных атомов в
- 13. Окисление спиртов.Кислород воздуха окисляет спирты только при
- 14. Большая склонность спиртов к окислению по сравнению
- 15. При окислении первичных спиртов образуются альдегиды, вторичных
- 16. Дегидратация спиртов. Дегидратация (отнятие воды от молекулы
- 17. Внутримолекулярная дегидратация, т.е. за счёт одной молекулы спирта, приводит к образованию этиленового углеводорода:
- 18. Образование сложных эфиров.Взаимодействие спиртов с кислотами (органическими
- 19. Способы получения
- 20. Реакция протекает при каталитическом участии образуемых щелочами
- 21. Таким образом, при действии водного раствора щелочи на галогеналкилы образуются спирты. Например:
- 22. Гидратация алкенов.При нагревании в присутствии катализаторов (хлорид
- 23. С гомологоми этилена реакция протекает по правилу Марковникова. Например:
- 24. Восстановление альдегидов и кетонов.При действии водорода в
- 25. Специфические способы получения спиртов.Некоторые спирты получают характерными
- 26. Синтез газ получают при пропускании паров воды
- 27. Многоатомные спирты
- 28. Химические свойства. 1. Реагируют со щелочными металлами:2. Реагируют с галогеноводородами:
- 29. 3. Реагируют с кислотами, образуя сложные
- 30. Рекомендуемая литература Коровин Николай Васильевич. Общая химия:
- 31. Скачать презентанцию
КИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ Кафедра ЭПП, к.х.н., доцент Саверченко А.Н.
Слайды и текст этой презентации
Слайд 3Студент должен: знать строение, номенклатуру, свойства, способы получения и применение кислородсодержащих органических
соединений
уметь
составлять названия и химические уравнения реакций кислородсодержащих органических соединений
Слайд 4 К кислородсодержащим органическим соединениям относят многочисленные
органические соединения, как природного происхождения, так и синтетические, являющиеся производными
углеводородов, в молекулах которых содержатся углеродные атомы, непосредственно связанные с кислородом.В органических кислородсодержащих веществах кислород в соединении с углеродом образует различные группы, в которых углерод затрачивает на соединении с атомами кислорода одну, две или три валентные связи:
Слайд 5Остальные валентности углерода могут участвовать в образовании связи либо с
углеродными атомами, либо с атомами водорода или других элементов.
Таким образом,
приведённые кислородсодержащие группы, можно представить как различные стадии окисления углеродных атомов в органических молекулах; эти группы связаны между собой так же, как и соединения, в состав которых они входят, взаимными окислительно-восстановительными превращениями. Гидроксильная группа содержится в спиртах, карбонильная – в альдегидах и кетонах, карбоксильная – в карбоновых кислотах.Слайд 6Спирты и их производные
Производные углеводородов, представляющие собой продукты замещения атома
водорода в углеводородной молекуле водным остатком, т.е. гидроксильной группой –
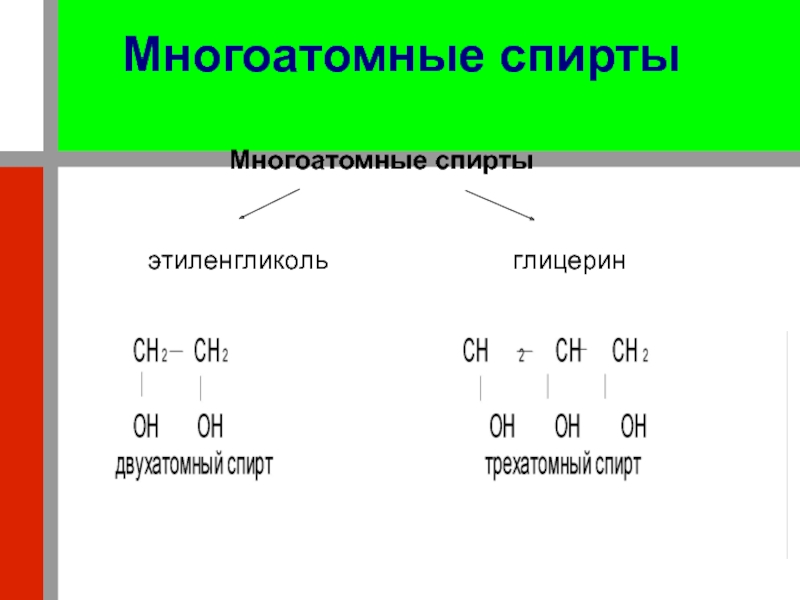
OH, называют спиртами. Эти вещества можно рассматривать и как производные воды, в молекуле которой один атом водорода замещён углеводородным радикалом R. Это можно представить схемой:Слайд 7Спирты могут содержать и несколько гидроксильных групп но при разных
атомах углерода. Число их характеризует атомность спирта. В соответствии с
этим спирты бывают одноатомные и многоатомные; последние подразделяются на двухатомные, трёхатомные и т.д. спирты.Слайд 8Строение. Изомерия.
Изомерия предельных одноатомных спиртов, общая формула которых CnH2n+1OH, обусловлена
изомерией углеродного скелета и изомерией положения гидроксильной группы.
Спирту состава C3H7OH
соответствует два изомера по положению гидроксильной группы:Слайд 9Из бутана и изобутана могут быть произведены четыре изомерных бутиловых
спирта.
В зависимости от положения гидроксильной группы при первичном, вторичном
и третичном углеродном атоме спирты могут быть первичными, вторичными и третичными:Слайд 10Химические свойства
Химические свойства спиртов обусловлены наличием гидроксильной группы. В разнообразных
химических превращениях спиртов особая роль принадлежит двум типам реакций:
разрыву связи
между атомами C и O (1), O и H(2).Положение гидроксильной группы существенно влияет на её поведение в этих превращениях.
Слайд 11Кислотные свойства спиртов.
Атомы водорода гидроксильных групп в спиртах проявляют определённую
подвижность. Подобно воде, спирты реагируют со щелочными металлами, которые замещают
водород спиртовых гидроксильных групп; при этом образуются алкоголяты и выделяется водород:Слайд 12По мере увеличения числа углеродных атомов в углеводородных радикалах спиртов
активность последних в этой реакции всё более уменьшается.
Высшие спирты реагируют
с натрием лишь при нагревании. Первичные спирты значительно активнее в реакциях со щелочными металлами, чем изомерные им вторичные и особенно третичные.В реакции со щелочными металлами спирты проявляют свойства кислот; но в результате влияния, оказываемого на гидроксильную группу алкильным радикалом, спирты – ещё более слабые кислоты, чем вода. Практически спирты – нейтральные вещества: они не показывают ни кислой, ни щелочной реакции на лакмус, не проводят электрический ток.
Слайд 13Окисление спиртов.
Кислород воздуха окисляет спирты только при высокой температуре; при
этом они горят. В результате происходит полное разрушение молекул с
образованием оксида углерода(IV) и воды.Возможно и умеренное окисление спиртов: при этом они окисляются легче, чем соответствующие предельные углеводороды. Углеводороды на холоду не взаимодействуют с раствором перманганата калия или хромовой смесью, спирты же окисляются ими.Внешне реакция проявляется в том, что в случае перманганата калия (KMnO4) исчезает его фиолетовая окраска, а в случае хромовой смеси (K2Cr2O7+H2SO4) её оранжевый цвет переходит в зеленый.Слайд 14Большая склонность спиртов к окислению по сравнению с углеводородами объясняется
влиянием имеющейся в их молекулах гидроксильной группы. Молекулы спиртов содержат
углеродные атомы, как бы уже подвергшиеся окислению, т.е. связанные с кислородом гидроксида, и поэтому действие окислителя прежде всего направляется на спиртовую группу. При этом окислению легче подвергаются спирты, в которых при углероде спиртовой группы имеется водород, - первичные и вторичные.Слайд 15При окислении первичных спиртов образуются альдегиды, вторичных – кетоны, окисление
третичных спиртов сопровождается разрывом углеродной цепи.
Слайд 16Дегидратация спиртов.
Дегидратация (отнятие воды от молекулы спирта) приводит к образованию
этиленовых углеводородов или простых эфиров. При избытке спирта дегидратация протекает
межмолекулярно, что приводит к образованию простого эфира:Слайд 17Внутримолекулярная дегидратация, т.е. за счёт одной молекулы спирта, приводит к
образованию этиленового углеводорода:
Слайд 18Образование сложных эфиров.
Взаимодействие спиртов с кислотами (органическими и неорганическими) приводит
к образованию производных кислот, называемых сложными эфирами:
Эта реакция называется реакцией
этерификации.Слайд 19Способы получения
Гидролиз галогеналканов.
При действии на галогеналкилы
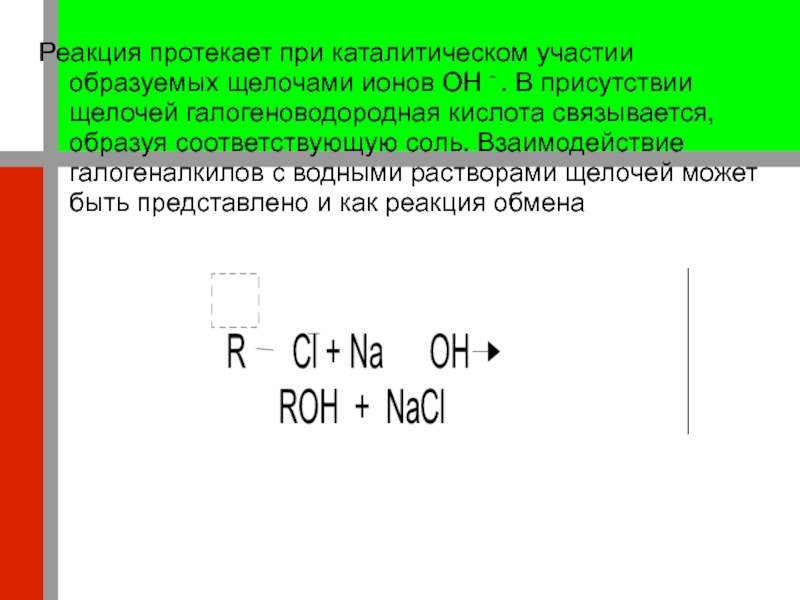
воды в присутствии щелочей происходит реакция гидролиза, в результате которой галоген замещается гидроксилом с образованием спирта и галогеноводородной кислоты. Слайд 20Реакция протекает при каталитическом участии образуемых щелочами ионов OH -
. В присутствии щелочей галогеноводородная кислота связывается, образуя соответствующую соль.
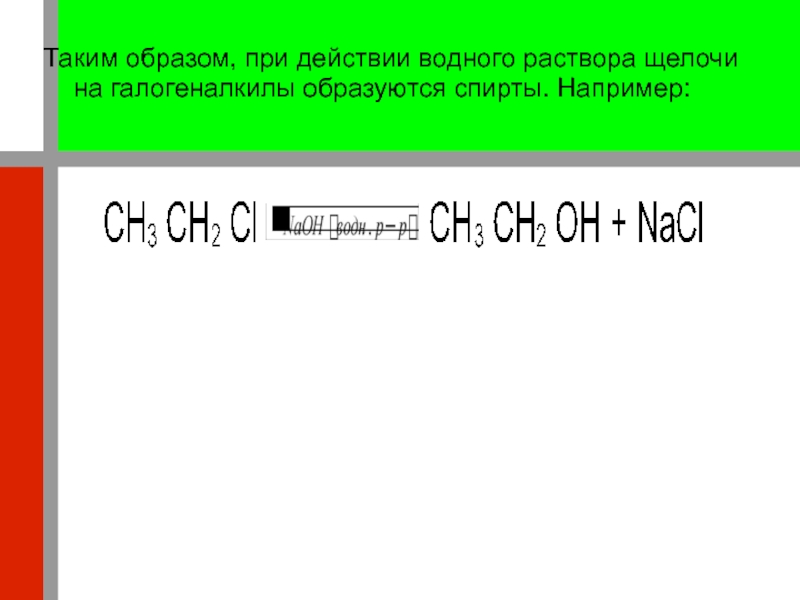
Взаимодействие галогеналкилов с водными растворами щелочей может быть представлено и как реакция обменаСлайд 21Таким образом, при действии водного раствора щелочи на галогеналкилы образуются
спирты. Например:
Слайд 22Гидратация алкенов.
При нагревании в присутствии катализаторов (хлорид цинка, серная кислота)
элементы воды (водород и гидроксил) присоединяются к углеродным атомам по
месту двойной связи с образованием спиртовСлайд 24Восстановление альдегидов и кетонов.
При действии водорода в момент выделения (H)
на карбонильные соединения альдегиды восстанавливаются в первичные спирты, а кетоны
– во вторичные:альдегид кетон
первичный спирт вторичный спирт
Слайд 25Специфические способы получения спиртов.
Некоторые спирты получают характерными только для них
способами. Так, метанол в промышленности получают при взаимодействии водорода с
оксидом углерода (II) при повышенном давлении и высокой температуре на поверхности катализатора:синтез газ - метанол
Слайд 26Синтез газ получают при пропускании паров воды над раскаленным углем:
Этанол
(этиловый спирт) в промышленности получают при спиртовом брожении глюкозы
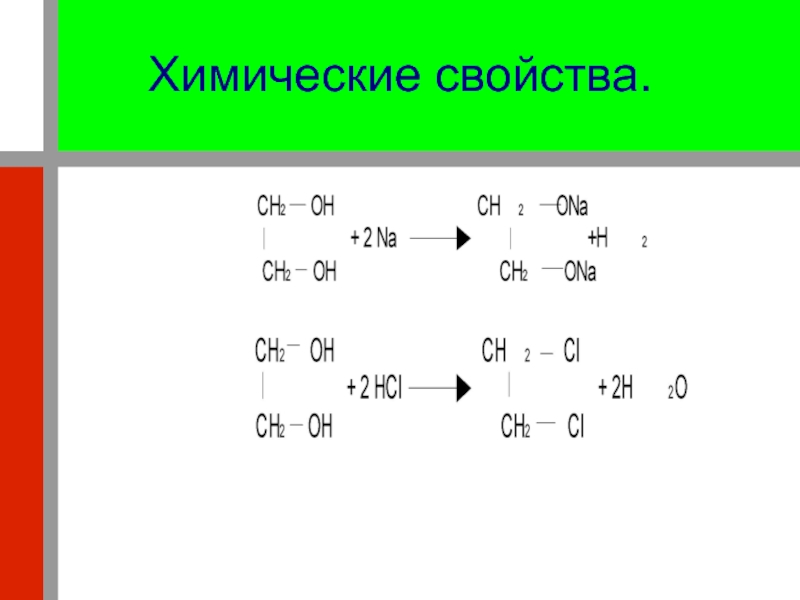
Слайд 29 3. Реагируют с кислотами, образуя сложные эфиры:
4. Реагируют
с гидроксидом меди (II) – качественная реакция на многоатомные спирты
(ярко-синее окрашивание раствора)Слайд 30Рекомендуемая литература
Коровин Николай Васильевич. Общая химия: Учебник. - 2-е изд.,
испр. и доп. - М.: Высш. шк., 2000. - 558с.:
ил.Павлов Н.Н. Общая и неорганическая химия: Учеб. для вузов. – 2-е изд., перераб. и доп. – М.: Дрофа, 2002. – 448 с.: ил.
Ахметов Наиль Сибгатович. Общая и неорганическая химия: Учебник для студ. химико-технологических спец. вузов / Н.С.Ахметов. - 4-е изд., исп. - М.:Высш. шк.: Академия, 2001. - 743с.: ил.
Глинка Николай Леонидович. Общая химия: Учебное пособие для вузов / Н.Л.Глинка; Ермаков Л.И (ред.) – 29–е изд.; исп. – М.: Интеграл Пресс, 2002 – 727с.: ил.
Писаренко А.П., Хавин З.Я. Курс органической химии – М.: Высшая школа,1975,1985.
Альбицкая В.М., Серкова В.И. Задачи и упражнения по
органической химии. – М.: Высш. шк., 1983.
Грандберг И.И. Органическая химия – М.: Дрофа, 2001.
Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия М.: Высш. Шк., 1981
Иванов В.Г., Гева О.Н., Гаверова Ю.Г. Практикум по
органической химии – М.: Академия., 2000.