Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Урок химии
Содержание
- 1. Урок химии
- 2. Сегодня мы на урокеОкунёмся в прошлое, пройдемся
- 3. Задания группам1. Почему железный век наступил после
- 4. Пир царя Соломона Иерусалимский храм
- 5. Начало железного века
- 6. «Железная эпоха»На некоторых древних языках железо именуется
- 7. Характеристика железа как химического элемента1. Химический символ
- 8. Распространение железа на ЗемлеВ земной коре содержится
- 9. Соотнесите названия с химическими формулами Ответы:1.3.2.1.3.2.4.4.1. Пирит2. Магнетит3. Сидерит4. Гематит1. Fе3О42. FеСО3 3. FеS24. Fе2О3
- 10. Булат – это смесь железа с углеродом.Издревле
- 11. Выберите физические свойства, характерные для железа1. Серебристо-белый
- 12. «Гвозди в желудке»Крокодил переваривает за несколько месяцев проглоченные железные наконечники копий и 15-сантиметровые стальные крючки.
- 13. Сумма коэффициентов в каждом уравнении равна…Fe +
- 14. ЛабораторияОпыт № 1 «Магнитные свойства железа»Опыт № 2 «Взаимодействие железа с кислотами, солями»
- 15. Взаимодействие железа со сложными веществами1. с кислотамиFe
- 16. «Железо в живых организмах»Большая часть железа
- 17. Биологическая роль железа
- 18. «Железо или пластик?»Сплавы на основе железа универсальны,
- 19. Железный век продолжается…Железа выплавляется в 50 раз больше, чем алюминия.
- 20. РефлексияСегодня:Я удивился….Я понял….Я задумался…
- 21. Домашнее задание1. Прочитайте параграф учебника № 412.
- 22. Соединения железаОксиды1. FeO – основный, нерастворим в
- 23. Гидроксид : Fe(OH)₂ - слабое основаниеСоли: FeCI₂
- 24. Fe₂O₃ - амфотерный, с преобладанием основных свойств,
- 25. Гидроксид Fe(OH)₃ -амфотерный, красно-бурое аморфное веществоFe(OH)₃ ↔
- 26. Соли:FeCI₃
- 27. Соединения Fe(III) обладают окислительными свойствамиКачественные реактивы на
- 28. FeO₃ - кислотный, не полученГидроксид: H₂FeO₄ –
- 29. 1. Гексагидроксоферрат (III) натрия имеет формулу:а) Na2[Fe(ОН)4];
- 30. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Сегодня мы на уроке
Окунёмся в прошлое, пройдемся по настоящему, заглянем
в будущее
Побываем на пиршестве царя Соломона
Посетим химическую лабораторию
Ответим на множество
вопросовВы удивитесь, что Вы знаете и умеете так много!
Слайд 3Задания группам
1. Почему железный век наступил после медного и бронзового?
2.
Что такое булат?
3. В 1963 году в некоторых газетах появилась
небольшая заметка о том, что врачи извлекли из организма женщины 130 гвоздей и 340 иголок. Металлические предметы под воздействием кислоты желудочного сока уменьшили свой первоначальный вес на 400 граммов. Возможно ли такое?4. Почему мясо красное?
5. Есть ли будущее у железа, не заменит ли его пластиковое оборудование?
Слайд 6«Железная эпоха»
На некоторых древних языках железо именуется «небесным камнем»
Самый крупный
метеорит Гоба нашли в 1920 г. в Африке весом около
60 тонн.Слайд 7Характеристика железа как химического элемента
1. Химический символ и название элемента
Fe
– железо
2. Положение в Периодической системе(атомный номер, номер периода и
группы)26, 4 период, VIII В группа
3. Строение атома (заряд ядра, число электронов, число уровней, распределение электронов по уровням)
(+26; 26; 4; 2е,8е,14е,2е)
4. Электронная конфигурация
1s 2s 2p 3s 3p 4s 3d
5. Степени окисления: +2, +3
2
2
2
2
6
6
6
Слайд 8Распространение железа на Земле
В земной коре содержится 4,65% (по массе)
железа. По распространенности железо занимает 4-е место после кислорода, кремния,
алюминия. Редко встречается самородное железо (метеоритного или земного происхождения).Слайд 9Соотнесите названия с химическими формулами
Ответы:
1.3.
2.1.
3.2.
4.4.
1. Пирит
2. Магнетит
3. Сидерит
4. Гематит
1.
Fе3О4
2. FеСО3
3. FеS2
4. Fе2О3
Слайд 10Булат – это смесь железа с углеродом.
Издревле на Руси славились
булатные мечи.
Раскрыть секрет булата удалось в первой половине ХIХ века
русскому химику Павлу Петровичу Аносову.Дмитрий Константинович Чернов объяснил происхождение булата, связав их с особенностями структуры
Слайд 11Выберите физические свойства, характерные для железа
1. Серебристо-белый металл
2. Самый твёрдый
металл
3. Ковкий
4. Температура плавления +1539оС
5. Пластичный
6. Легко режется ножом
7.
Проводит электрический ток8. Лёгкий
9. Проводит тепло
10. Легко намагничивается и размагничивается
Ответы: 1,3,4,5,7,9,10
Слайд 12«Гвозди в желудке»
Крокодил переваривает за несколько месяцев проглоченные железные наконечники
копий и 15-сантиметровые стальные крючки.
Слайд 13Сумма коэффициентов в каждом уравнении равна…
Fe + S→ FeS
Fe
+ O2 → Fe3O4
Fe + HCl→ FeCl2 + H2
Ответы:
3, 6, 5Слайд 14Лаборатория
Опыт № 1 «Магнитные свойства железа»
Опыт № 2 «Взаимодействие железа
с кислотами, солями»
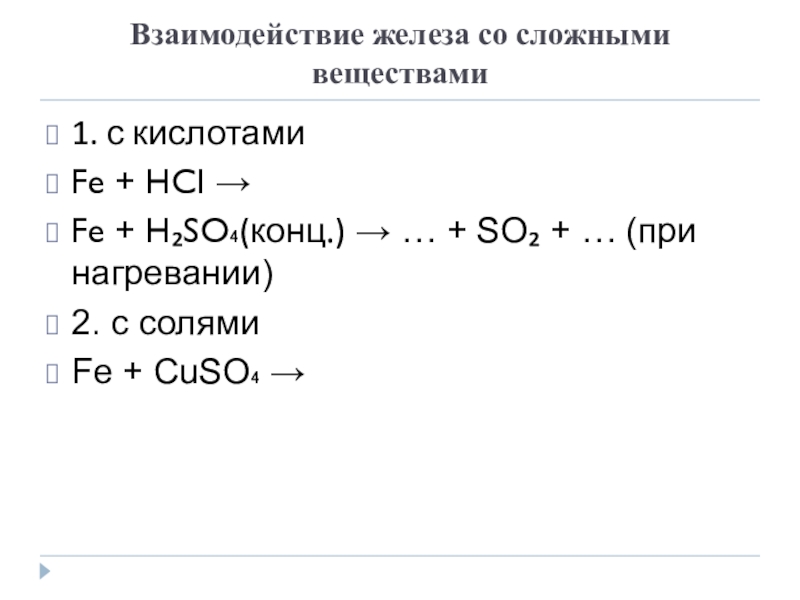
Слайд 15Взаимодействие железа со сложными веществами
1. с кислотами
Fe + HCI →
Fe + H₂SO₄(конц.) → … + SO₂ + … (при
нагревании)2. с солями
Fe + CuSO₄ →
Слайд 16
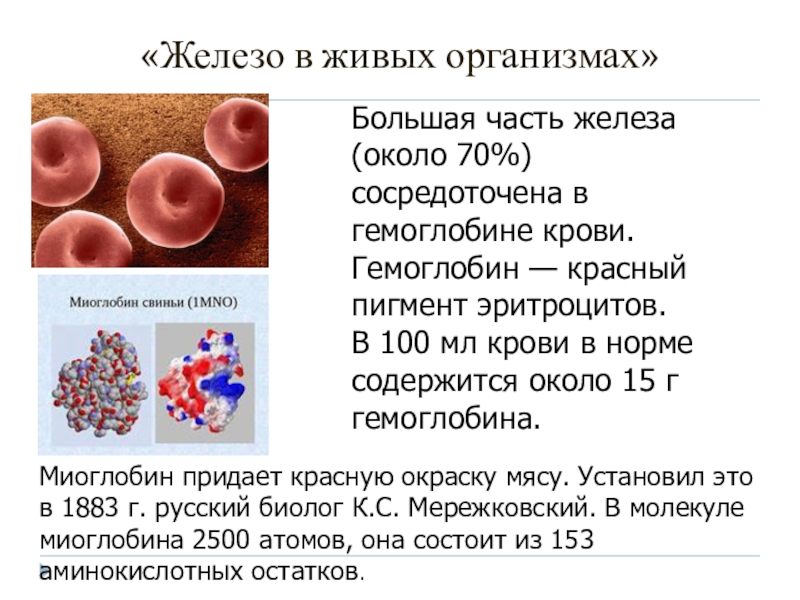
«Железо в живых организмах»
Большая часть железа (около 70%) сосредоточена в
гемоглобине крови.
Гемоглобин — красный пигмент эритроцитов.
В 100 мл крови в
норме содержится около 15 г гемоглобина. Миоглобин придает красную окраску мясу. Установил это в 1883 г. русский биолог К.С. Мережковский. В молекуле миоглобина 2500 атомов, она состоит из 153 аминокислотных остатков.
Слайд 18«Железо или пластик?»
Сплавы на основе железа универсальны, технологичны, доступны и
в массе – дешевы. Сырьевая база этого металла тоже не
вызывает опасений Железу еще долго быть фундаментом цивилизации.Слайд 21Домашнее задание
1. Прочитайте параграф учебника № 41
2. По желанию:
А) Сочините
сказку «Путешествие железа через века»
Б) Сотворите выставку железных изделий
Слайд 22Соединения железа
Оксиды
1. FeO – основный, нерастворим в воде.
Получение:
t
А) Fe(OH)₂
= FeO + H₂O (в атмосфере азота)t
Б) Fe₂O₃ + H₂ = 2FeO + H₂O
t
В) Fe₂O₃ + CO = 2FeO + CO₂
Взаимодействует с кислотами.
(составить уравнения реакций с HCI, H₂SO₄ в молекулярном и ионном виде)
Слайд 23Гидроксид : Fe(OH)₂ - слабое основание
Соли: FeCI₂ , FeSO₄
Соединения Fe(II)
обладают восстановительными свойствами
Fe(OH)₂ + O₂ + 2H₂O = 4Fe(OH)₃
FeCI₂ +
CI₂ = 2FeCI₃10 FeSO₄ + 2KMnO₄ + 8H₂ SO₄ = 5Fe₂ (SO₄)₃ + 2MnSO₄ + K₂ SO₄ + 8H₂O
Качественный реактив на соединения Fe(II):
K₃ [(Fe(CN)₆] – гексацианоферрат (III) калия или «красная кровяная соль»
3Fe + 2[Fe(CN)₆ ]= Fe₃ [Fe(CN)₆]₂↓ синий «турнбулева синь»
2+
3-
Слайд 24Fe₂O₃ - амфотерный, с преобладанием основных свойств, красно-бурый, нерастворимый в
воде порошок)
Получение:
tА) 2Fe(OH)₃ = Fe₂O₃ + 3H₂O
t
Б)4FeS₂ + 11O₂ = 8SO₂ + 2Fe₂O₃
t
В) 4Fe(NO₃)₃ = 2Fe₂O₃ + 12NO₂ + 3O₂
Взаимодействует с кислотами (составить уравнения реакций с HCI, H₂SO₄ в молекулярном и ионном виде)
Слайд 25Гидроксид Fe(OH)₃ -амфотерный, красно-бурое аморфное вещество
Fe(OH)₃ ↔ HFeO₂ + H₂O
Получение:
А)
окисление Fe(OH)₂
Б) обмен между растворами солей Fe(III) и щелочами
(составить уравнения реакций в молекулярном и ионном виде)В) необратимый гидролиз солей Fe(III):
Fe₂S₃ + 6H₂O = 2Fe(OH)₃↓ + 3H₂S↑
Взаимодействует с сильными кислотами и значительно слабее Fe(OH)₂ (составить уравнения реакций в молекулярном и ионном виде)
Слайд 27Соединения Fe(III) обладают окислительными свойствами
Качественные реактивы на соединения железа (III):
А)
K₄ [(Fe(CN)₆] – гексацианоферрат (II) калия или «желтая кровяная соль»
4Fe
+ 3[Fe(CN)₆ ]= Fe₄ [Fe(CN)₆]₃↓ зелено-синий «берлинская лазурь»
Б) роданиды (соли тициановой кислоты HNCS)
Fe + 3KNCS ↔ Fe(NCS)₃ кроваво-красный
3+
4-
3+
Слайд 28FeO₃ - кислотный, не получен
Гидроксид: H₂FeO₄ – железная кислота (существует
только в растворах)
Соли: ферраты K₂FeO₄ , CaFeO₄
Слайд 291. Гексагидроксоферрат (III) натрия имеет формулу:
а) Na2[Fe(ОН)4]; б)
Nа[Fe(ОН)4];
в) Nа3[Fе(ОН)6]; г) NаFеО2.
2. Степень окисления железа в
ионе FeO42–:а) +3; б) +2; в) 0; г) +6.
3. Раствор красной кровяной соли является реактивом для обнаружения:
а) Fe3+; б) Fe2+; в) Fe3O4; г) Fe0.
4. В реакции оксида железа(II) с углеродом окислителем является:
а) С0; б) O2–; в) Fe2+; г) Fe0.
5. При окислении гидроксида железа(II) во влажном воздухе образуется:
а) оксид железа(II); б) оксид железа(III);
в) гидроксид железа(III); г) железо.























![Урок химии Соединения Fe(III) обладают окислительными свойствамиКачественные реактивы на соединения железа (III):А) K₄ Соединения Fe(III) обладают окислительными свойствамиКачественные реактивы на соединения железа (III):А) K₄ [(Fe(CN)₆] – гексацианоферрат (II) калия или](/img/thumbs/f11ec78101245074bdf4178b367afc2c-800x.jpg)

![Урок химии 1. Гексагидроксоферрат (III) натрия имеет формулу:а) Na2[Fe(ОН)4]; б) Nа[Fe(ОН)4];в) Nа3[Fе(ОН)6]; 1. Гексагидроксоферрат (III) натрия имеет формулу:а) Na2[Fe(ОН)4]; б) Nа[Fe(ОН)4];в) Nа3[Fе(ОН)6]; г) NаFеО2.2. Степень](/img/thumbs/a8dfe2482430855eb80cbba73f2931e4-800x.jpg)



















