Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
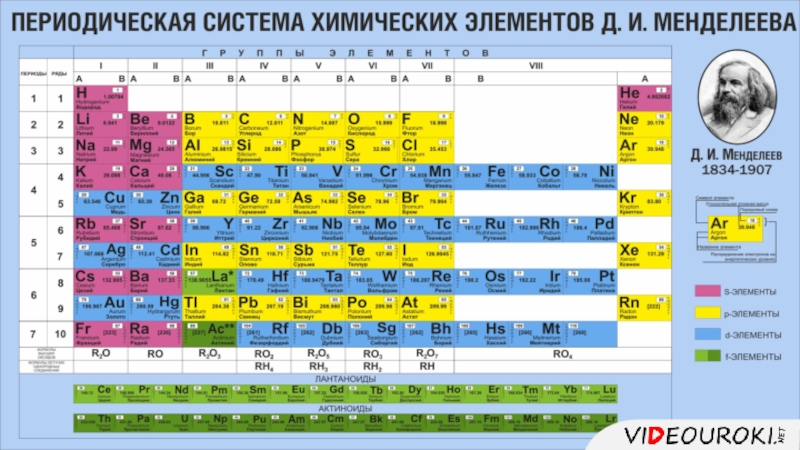
Презентация. Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева
Содержание
- 1. Презентация. Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева
- 2. Слайд 2
- 3. Задание по химии…
- 4. Химические элементы в Периодической системе – это героиИм нужно дать определенные характеристики
- 5. 1.Описывать элемент следует по 7 пунктам
- 6. Слайд 6
- 7. Слайд 7
- 8. Слайд 8
- 9. Слайд 9
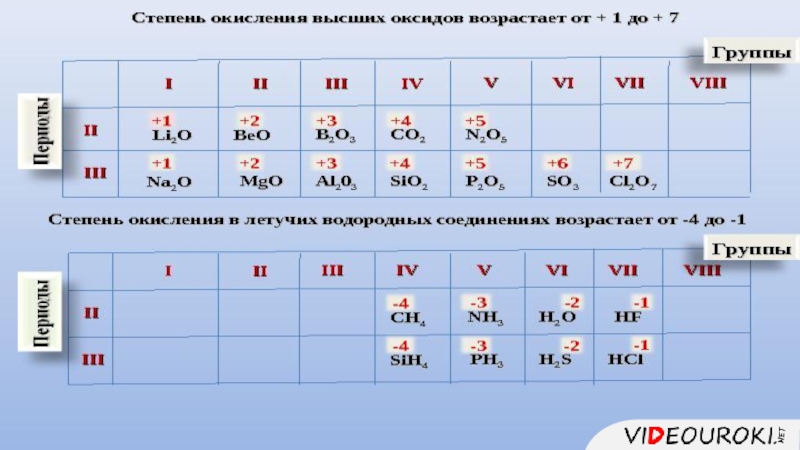
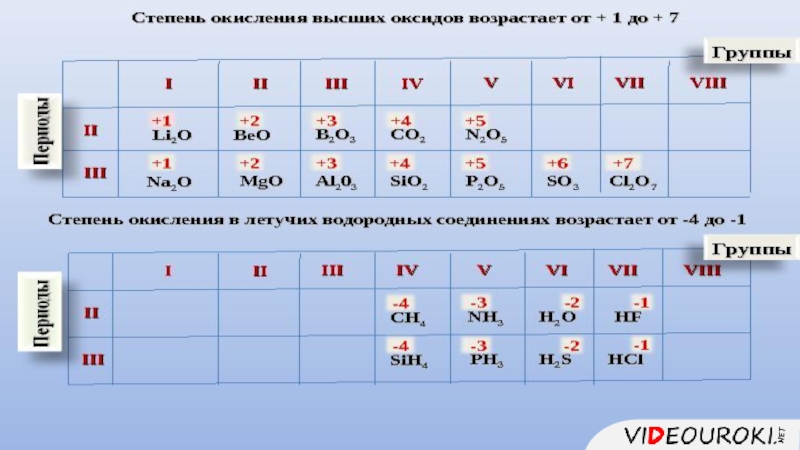
- 10. 1.Состав высшего оксида, его характер (основный, кислотный, амфотерный)
- 11. 1.Состав высшего гидроксида, его характер (кислородсодержащая кислота, основание, амфотерный гидроксид)
- 12. Слайд 12
- 13. Основные закономерности изменения свойств
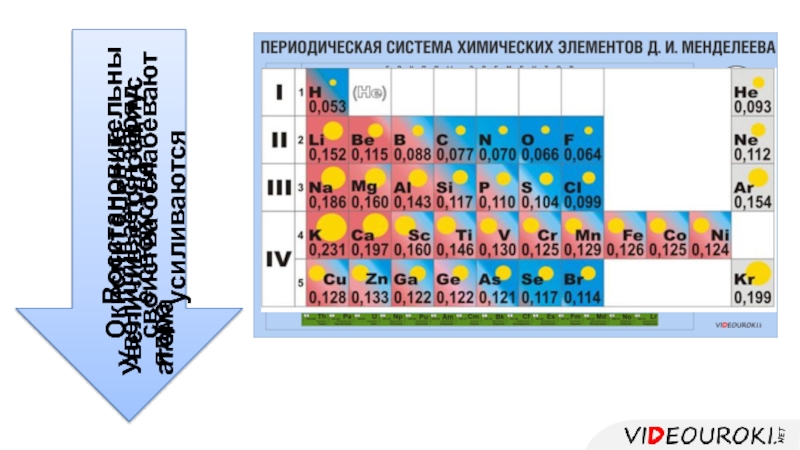
- 14. Увеличивается заряд ядраУвеличивается радиус атомаВосстановительные свойства усиливаютсяОкислительные свойства ослабевают
- 15. Слайд 15
- 16. Увеличивается заряд ядраУменьшается радиус атомаВосстановительные свойства ослабеваютОкислительные свойства усиливаются
- 17. Слайд 17
- 18. Металлические свойства усиливаютсяМеталлические свойства ослабеваютНеметаллические свойства усиливаютсяНеметаллические свойства ослабевают
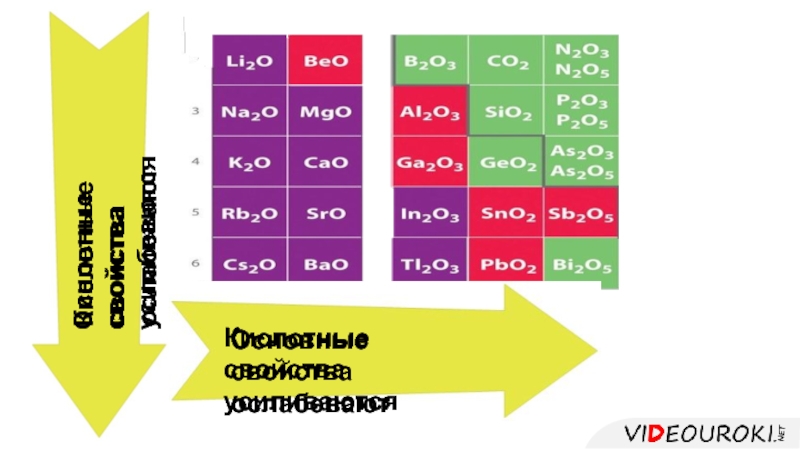
- 19. Основные свойства ослабеваютОсновные свойства усиливаютсяКислотные свойства ослабеваютКислотные свойства усиливаются
- 20. Слайд 20
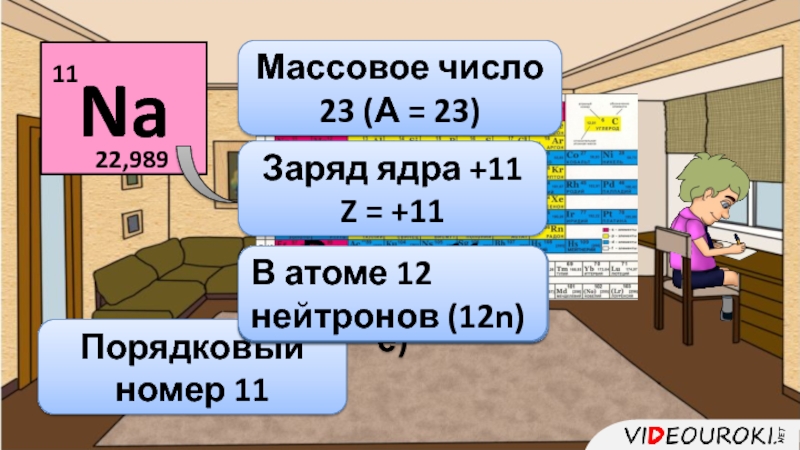
- 21. Порядковый номер 11Массовое число 23 (А =
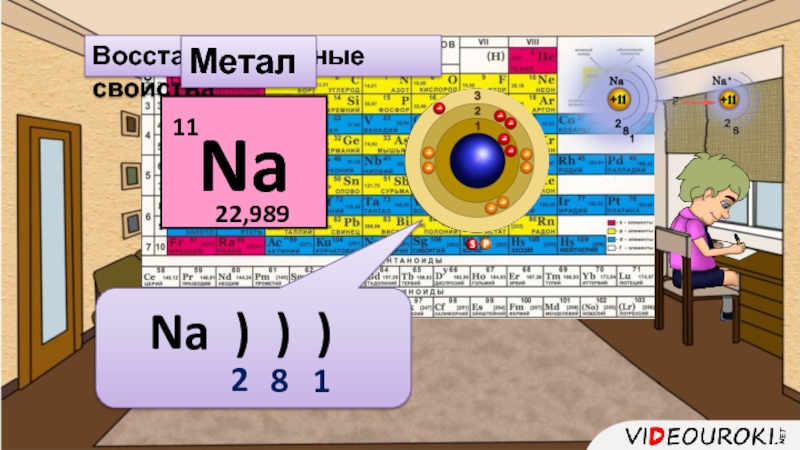
- 22. Na ) ) ) 281Восстановительные свойстваМеталл
- 23. Металлическая химическая связьМеталлическая кристаллическая решеткаМеталлический блескПластичностьТепло и – электропроводность
- 24. Слайд 24
- 25. Слайд 25
- 26. Na2OОсновный оксид Реагирует с кислотами Реагирует с
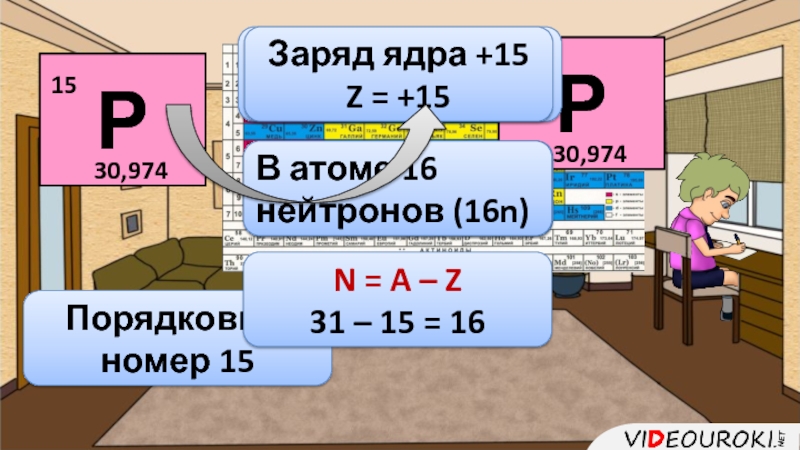
- 27. Порядковый номер 15Массовое число 31 (А =
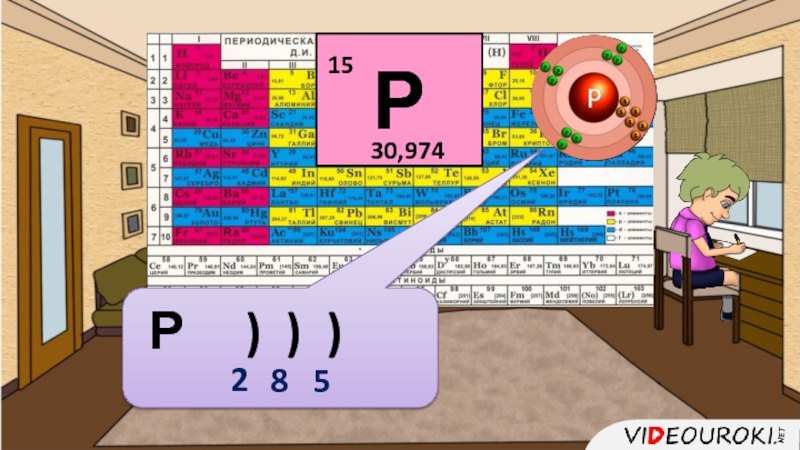
- 28. Р ) ) ) 285
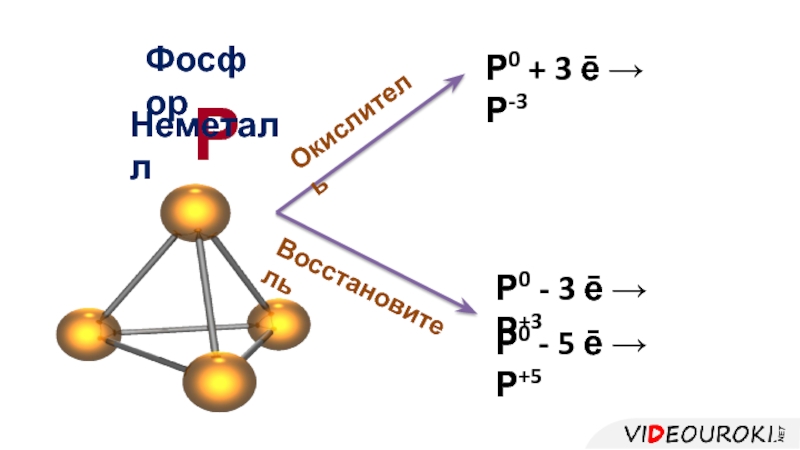
- 29. РФосфорОкислитель Р0 + 3 ē → Р-3Восстановитель
- 30. Фосфор – неметаллХарактерно явление аллотропииБелый фосфорКрасный фосфорЧёрный фосфор
- 31. Слайд 31
- 32. Слайд 32
- 33. Кислотный оксид Реагирует с основнымиоксидами Реагирует с
- 34. Слайд 34
- 35. Скачать презентанцию
Слайды и текст этой презентации
Слайд 4Химические элементы в Периодической системе – это герои
Им нужно дать
определенные характеристики
Слайд 111.
Состав высшего гидроксида, его характер (кислородсодержащая кислота, основание, амфотерный гидроксид)
Слайд 14Увеличивается заряд ядра
Увеличивается радиус атома
Восстановительные свойства усиливаются
Окислительные свойства ослабевают
Слайд 16Увеличивается заряд ядра
Уменьшается радиус атома
Восстановительные свойства
ослабевают
Окислительные свойства
усиливаются
Слайд 18Металлические свойства усиливаются
Металлические свойства ослабевают
Неметаллические свойства усиливаются
Неметаллические свойства ослабевают
Слайд 19Основные свойства
ослабевают
Основные свойства
усиливаются
Кислотные свойства
ослабевают
Кислотные свойства
усиливаются
Слайд 21Порядковый номер 11
Массовое число 23 (А = 23)
Заряд ядра +11
Z
= +11
В атоме 11 электронов (11 ē)
N = A –
Z23 – 11 = 12
В атоме 12 нейтронов (12n)
Слайд 23Металлическая химическая связь
Металлическая кристаллическая решетка
Металлический блеск
Пластичность
Тепло и – электропроводность
Слайд 26Na2O
Основный оксид
Реагирует с кислотами
Реагирует с кислотными
оксидами
Реагирует с
водой
Оксид натрия
Гидроксид натрия
NaOH
Растворимое в воде основание
Реагирует с кислотами
Реагирует
с кислотными оксидами
Реагирует с солями
Натрий не образует летучих водородных соединений
Слайд 27Порядковый номер 15
Массовое число 31 (А = 31)
Заряд ядра +15
Z
= +15
В атоме 15р и 15 ē
N = A –
Z31 – 15 = 16
В атоме 16 нейтронов (16n)
Слайд 33Кислотный оксид
Реагирует с основными
оксидами
Реагирует с основаниями
Реагирует с водой
Оксид фосфора (V)
Фосфорная кислота
Реагирует с основаниями
Реагирует с металлами
Реагирует с
основными оксидами
Реагирует с солями
Фосфор образует летучее водородное соединение: РН3 – фосфин
P2O5
H3PO4